Or
| Per a altres significats, vegeu «Or (desambiguació)». |
L'or és l'element químic de símbol Au i nombre atòmic 79. Està situat al grup 11 de la taula periòdica. El seu símbol ve del llatí aurum. L'or és un metall de transició tou, brillant, groc, pesant, mal·leable, dúctil i que no reacciona amb la majoria de productes químics, però és sensible al clor i a l'aigua règia. El metall es troba normalment en estat pur i en forma de palletes (trossos) i dipòsits al·luvials (partícules petites) i és un dels metalls tradicionalment emprats per a encunyar monedes. L'or s'empra com estàndard monetari per a moltes nacions i també es fa servir en la joieria, la indústria i l'electrònica. Al final de l'any 2006, s'estimava que el total d'or que s'havia minat al llarg de la història era de 158.000 tones.[2] Això es pot representar mitjançant un cub amb un costat de només 20,2 metres de llarg. Els usos industrials moderns inclouen l'odontologia i l'electrònica, on l'or ha trobat tradicionalment un ús gràcies a la seva bona resistència a la corrosió oxidativa i la seva excel·lent qualitat com a conductor de l'electricitat.
| Or | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
79Au
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||
Groc metàl·lic Cristalls d'or  Línies espectrals de l'or | ||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Or, Au, 79 | |||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 11, 6, d | |||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 196,966569(4) | |||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d10 6s1 2, 8, 18, 32, 18, 1 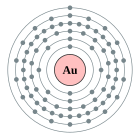
| |||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
19,30 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
17,31 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.337,33 K, 1.064,18 °C | |||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.129 K, 2.856 °C | |||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 12,55 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 324 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,418 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 5, 4, 3, 2, 1, −1, −2 (òxid amfòter) | |||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,54 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 890,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| 2a: 1.980 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 144 pm | |||||||||||||||||||||||||||||||||||||||
| Radi covalent | 136±6 pm | |||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 166 pm | |||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Xarxa cúbica centrada en la cara 
| |||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[1] | |||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 22,14 nΩ·m | |||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 318 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 14,2 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) 2.030 m·s−1 | |||||||||||||||||||||||||||||||||||||||
| Resistència a tracció | 120 MPa | |||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 79 GPa | |||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 27 GPa | |||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 180 GPa | |||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,44 | |||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,5 | |||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 216 MPa | |||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 25 HB MPa | |||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-57-5 | |||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops de l'or | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
L'art de treballar l'or rep el nom d'orfebreria.
Propietats fisicoquímiques
modificaL'or és un element metàl·lic que exhibeix un color groc en brut, però que pot mostrar-se negre, robí o morat en divisions fines. És considerat per alguns com l'element més bell de tots i és el metall més mal·leable i dúctil que es coneix.[3] De fet, una unça (28,35 g) d'or pot modelar-se en un llençol que cobreixi 28 metres quadrats. Com és un metall bla, els aliatges amb altres metalls a fi de proporcionar-li duresa són freqüents.
Es tracta d'un metall molt dens, amb un alt punt de fusió i una alta afinitat electrònica. Els seus estats d'oxidació més importants són +1 i +3. També es troba en l'estat d'oxidació +2, així com en estats d'oxidació superiors, però és menys freqüent.
A més, l'or és un bon conductor de la calor i de l'electricitat, i no l'afecta l'aire ni la majoria d'agents químics. Té una alta resistència a l'alteració química per part de la calor, la humitat i la majoria dels agents corrosius, i així està ben adaptat al seu ús en l'encunyació de monedes i en la joieria.
Color
modificaEl color de l'or pur és un groc metàl·lic. L'or, el cesi i el coure són els únics elements metàl·lics que tenen un color natural que no sigui ni gris ni blanc. El color gris habitual dels metalls depèn del seu «mar d'electrons», que és capaç d'absorbir i tornar a emetre fotons al llarg d'un ampli rang de freqüències. L'or reacciona de manera diferent, depenent d'efectes relativistes subtils que afecten els orbitals que envolten els àtoms d'or.[4][5]
Es poden aconseguir aliatges d'or acolorit com ara l'or rosa, mitjançant l'afegiment de diverses quantitats de coure i argent, tal com s'indica a la imatge. Els aliatges amb pal·ladi o níquel també són importants en la joieria comercial, ja que produeixen aliatges d'or blanc. Menys habitualment, l'afegiment de manganès, alumini, ferro, indi i altres elements poden produir més colors inusuals d'or per diverses aplicacions.[6]
Preu
modificaCom altres metalls preciosos, l'or es mesura en unitats de pes troy i en grams. Quan forma aliatges amb altres metalls el terme quirat n'indica la puresa que presenta, amb 24 quirats s'indica que és totalment pur i els nombres menors que aquest indiquen pureses també menors. La puresa del lingot d'or o de les monedes d'or també es poden expressar en termes decimals que van del 0 a l'1, conegudes com les mil·lèsimes de finor (millesimal fineness), essent el 0,995 or molt pur.
El preu de l'or es determina a través del comerç en els mercats de derivats financers però un procediment conegut com el Gold Fixing de Londres, originat des de setembre de 1919, proporciona un preu de referència diari a la indústria.
Històricament l'encunyació d'or va fer que aquest s'usés àmpliament com a moneda; quan es va introduir el paper moneda aquest va ser utilitzat com un rebut redimible per moneda d'or o lingots d'or. En un sistema monetari conegut com a patró or, es donava un cert pes d'or en nom d'una unitat monetària. Durant un llarg període el govern dels Estats Units va establir el valor del dòlar com que una unça troy (troy ounce) equivalia a 20,67 $ (664,56 $/kg), però l'any 1934 el dòlar va ser devaluat a $35.00 per unça troy ($1125,27/kg). Cap a 1961, va passar a fer difícil mantenir aquest preu, i un pool de bancs europeus i americans acordaren manipular el mercat per evitar futures devaluacions de monedes contra la incrementada demanda d'or.
El 17 de març de 1968, les circumstàncies econòmiques causaren el col·lapse d'aquest pool de l'or i es va establir un esquema de preus de dos nivells mitjançant el qual l'or encara va ser utilitzat per ajustar els comptes internacionals en el vell 35,00 $ per unça troy (1,13 $ / g), però en el mercat privat es va permetre la fluctuació en el preu de l'or. Tanmateix el sistema de dos nivells de preus va ser abandonat el 1975, quan el preu de l'or es va anar a buscar al seu nivell de lliure mercat. Els bancs centrals encara mantenen les reserves d'or, encara que el nivell general ha anat disminuint. El dipositari d'or més gran del món és el del Banc de la Reserva Federal dels Estats Units de Nova York, que posseeix al voltant del 3%[7] de l'or extret, així com l'or dipositat en lingots d'or dels Estats Units a Fort Knox.
L'any 2005 l'organime internacional World Gold Council estimà que el subministrament mundial d'or era de 3.859 tones i la demanda en canvi de 3.754 tones, situació que donava un superàvit de 105 tones.[8]
Des de 1968 el preu de l'or ha oscil·lat molt, des d'un màxim de $850/oz ($27,300/kg) el 21 de gener de 1980, fins a un mínim de $252,90/oz ($8,131/kg) el 21 de juny de 1999 (London Gold Fixing).[9] El període de 1999 a 2001 marcà el fons o «Brown Bottom» després de 20 anys.[10] Els preus pujaren ràpidament des de 1991, però el màxim de 1980 no va ser ultrapassat fins al 3 de gener de 2008 amb un nou màxim de $865.35 per unça troy.[11] Un altre preu rècord es va establir el 17 de març de 2008 amb $1023,50/oz ($32,900/kg).[11]
A la darreria de 2009, els mercats de l'or van experimentar noves pujades per l'increment de la demanda d'or i la feblesa del dòlar US. El desembre de 2009, l'or passà la important barrera d'US$1200 per unça per tancar a $1215.[12] Posteriorment l'or va tenir noves alces el maig de 2011 quan la crisi del deute de la Unió Europea va fer sentir la compra d'or com un actiu segur.[13][14] El març de 2011, l'or assolí un preu màxim absolut amb $1432,57, a causa de la preocupació dels inversors per la crisi i les protestes populars d'Àfrica del Nord i el Mitjà Orient.[15]
Des d'abril de 2001 el preu de l'or s'ha més que quintuplicat en valor respecte al dòlar US amb un nou màxim de $1.913,50 el 23 d'agost de 2011,[16] amb especulacions sobre que aquest mercat baixista secular havia acabat i el mercat alcista havia tornat.[17]
Aplicacions
modificaL'or pur és massa tou per a ser usat normalment i s'endureix aliant-lo amb argent i coure. L'or i els seus molts aliatges s'empren força en joieria, la fabricació de monedes i també com a patró monetari en molts països. A causa de la seva bona conductivitat elèctrica i la seva resistència a la corrosió, així com una bona combinació de propietats químiques i físiques, es va començar a emprar al final del segle xx com a metall en la indústria.
Altres aplicacions:
- L'or exerceix funcions crítiques en ordinadors, telecomunicacions, naus espacials, motors d'avions de reacció, i molts altres productes.
- La seva alta conductivitat elèctrica i resistència a l'oxidació ha permès un ampli ús com a capes primes electrodipositades sobre la superfície de connexions elèctriques per a assegurar una connexió bona, de baixa resistència.
- Com l'argent, l'or pot formar fortes amalgames amb el mercuri que de vegades s'empra en empastos dentals.
- L'or col·loidal (nanopartícules d'or) és una solució intensament acolorida que s'està estudiant en molts laboratoris amb fins mèdics i biològics. També és la forma emprada com a pintura daurada en ceràmiques.
- L'àcid cloroàuric es fa servir en fotografia.
- L'isòtop d'or 198Au, d'una vida mitjana de 2,7 dies, s'empra en alguns tractaments de càncer i altres malalties.
- S'empra com a recobriment de materials biològics permetent ser vist a través del microscopi electrònic de rastreig.
- S'empra com a recobriment protector en molts satèl·lits pel fet que és un bon reflector de la llum infraroja.
Com a moneda
modificaA tot el món l'or s'ha usat per a vehicular el canvi monetari, ja sia per l'emissió i reconeixement de les monedes d'or o de l'or sense encunyar, o a través de bitllets de paper convertibles en or establint els patrons d'or en els quals el valor total de la moneda emesa es representa per les reserves emmagatzemades d'or.
Tanmateix, la producció d'or no ha crescut amb relació a les economies mundials. Avui la producció que surt de la mineria d'or està en declivi.[18] Amb el fort creixement de les economies en el segle xx, i l'increment de divises, les reserves mundials d'or el seu comerç de mercat s'han convertit en una petita fracció de tots els mercats i els tipus de canvi fixos de les monedes a l'or ja no se sustenten.
A principis de la Primera Guerra Mundial a les nacions en guerra es van desplaçar cap a un estàndard d'or fraccional, inflant les seves monedes per finançar l'esforç bèl·lic. Després de Segona Guerra Mundial l'or va ser substituït per un sistema de moneda convertible i més tard al sistema de Bretton Woods. El Patró or, i la convertibilitat directa de les monedes amb l'or han estat abandonats pels governs del món, sent reemplaçat per la moneda fiduciària. Suïssa va ser l'últim país de lligar la seva moneda a l'or, el va donar suport al 40% del seu valor fins que els suïssos es van unir al Fons Monetari Internacional el 1999.[19]
L'or pur és massa tou per al seu ús monetari diari i típicament l'or s'endureix per aliatges amb el coure, l'argent o altres metalls. La puresa de l'or es mesura en quirats. Les monedes d'or angleses en circulació des de 1526 fins a la dècada de 1930, típicament tenien l'estàndard de 22 quirats que s'anomenava duresa crown gold, En canvi als Estats Units després de 1837 la puresa de les monedes d'or era lleugerament inferior de 0,900 fine gold, o 21,6 quirats.
Indústria
modifica- El soldador d'or es fa servir per unir components en l'orfebreria a alta temperatura. Perquè aquest treball tingui la màxima qualitat, el soldador d'or ha de tenir els mateixos quirats que el que s'està treballant. Els soldadors d'or estan fets com a mínim en tres nivells de punts de fusió.
- De l'or se'n pot fer fil d'or que es fan servir en els brodats.
- L'or dona un color intensament vermell quan es fa servir com a agent colorant en la fabricació del vidre grosella.
- En fotografia els tòners d'or es fan servir per canviar el color de les fotos en blanc i negre amb bromur d'argent cap a tons blaus o marrons o per incrementar-ne l'estabilitat.[20]
- Com que l'or és un bon reflector de la radiació electromagnètica com la infraroja i la llum visible i també les ones de ràdio, es fa servir com a capa protectora de molts satèl·lits artificials, en frontals de protecció a l'infraroig, en els vestits de protecció tèrmica, els cascos dels astronautes i en avions per a la guerra electrònica com és l'avió EA-6B Prowler.
- L'or es fa servir com a capa reflectora en els CDs del tipus Gold CD.
- Els automòbils poden usar l'or per dissipar la calor. Els McLaren utilitzen una làmina d'or en el compartiment del model de motor F1.[21]
- Es pot fabricar or tan prim que sembla transparent. Es fa servir en algunes finestres d'aeronaus per desglaçar, fent-hi passar electricitat. La calor que produeix l'or per la seva resistència elèctrica és suficient per evitar la formació del gel.[22]
Electrònica
modificaLa concentració d'electrons lliures en l'or metall és 5,90×1022 cm−3. L'or és molt conductor de l'electricitat i s'ha fet servir pel cablejat elèctric en algunes aplicacions d'alta energia (el coure i l'argent són més conductors per volum, però l'or té l'avantatge de la seva resistència a la corrosió). Per exemple es van usar cables d'or durant alguns experiments atòmics del Manhattan Project però es va fer servir més els cables d'argent.
Encara que l'or resulta atacat pel clor lliure, la bona conductivitat de l'or i la resistència general a la corrosió en altres ambients (incloent-hi la resistència als àcids no clorats) l'han portat a un ús industrial generalitzat en l'era electrònica per a recobriments de capa prima de connectors elèctrics de tota classe on hi assegura bones connexions. Per exemple l'or es fa servir en els connectors dels cables electrònics més cars com ara cables d'àudio, vídeo i d'USB. El benefici d'usar l'or respecte a altres metalls connectors com l'estany és molt debatut. Els connectors d'or són sovint criticats pels experts audiovisuals dient que són innecessaris per a la majoria dels consumidors i els veuen simplement com un estratagema de màrqueting. No obstant això, l'ús de l'or en altres aplicacions en l'electrònica de connectors de lliscament en ambients molt humits o corrosius, i en ús dels connectors amb un cost de la fallada molt alt (en determinades aplicacions informàtiques, equips de comunicació, motors d'aeronaus) encara és molt habitual.[23]
A més dels contactes elèctrics lliscants, l'or també es fa servir en contactes elèctrics a causa de la seva resistència a la corrosió, conductivitat elèctrica, ductilitat i la manca de toxicitat.[24] els contactes de l'interruptor estan generalment més subjectes a corrosió que els contactes que llisquen. Filferros fins d'or s'utilitzen per connectar un dispositiu semiconductor al seu paquet a través d'un procés conegut com a enllaç del filferro.
Història
modificaL'or, de símbol Au (del llatí aurum), es coneix des de l'antiguitat. Per exemple, hi ha jeroglífics egipcis del 2600 aC que descriuen el metall, i també es menciona diverses vegades en l'Antic Testament. S'ha considerat com un dels metalls més preciosos i el seu valor s'ha emprat com a estàndard per a moltes monedes al llarg de la història.
L'or ha estat conegut i utilitzat pels artesans des del calcolític. Es coneixen objectes d'or als Balcans del quart mil·lenni abans de Crist, com els trobats a la Varna Necròpolis, Bulgària. Altres elements d'or com petits lingots i el disc de Nebra varen aparèixer a l'Europa Central el segon mil·lenni abans de Crist a l'edat del bronze.
Jeroglífics egipcis anteriors al 2600 aC mostren l'or, quan el rei Tushratta de Mitanni exclamava que a Egipte era «més abundant que la pols».[25] Egipte i en especial Núbia tenien els recursos per a ser els majors productors d'or durant gran part de la història. El mapa més antic conegut, el Papir de les mines, mostra el plànol d'una mina d'or a Núbia, juntament amb indicacions geològiques locals. Els mètodes primitius de treball varen ser descrits per Estrabó i Diodor de Sicília, i incloïa focs de mineria. es grans explotacions mineres també van estar presents a través del Mar Roig al territori que actualment és Aràbia Saudita.
La llegenda del velló d'or pot referir-se a la utilització de llanes per atrapar la pols d'or dels placers al món antic. L'or és esmentat sovint a l'Antic Testament, a partir del llibre del Gènesi i s'inclou com un els presents de l'adoració dels Reis Mags. Al llibre de l'Apocalipsi 21:21 es descriu la ciutat de la Nova Jerusalem que tenia els carrers «fets d'or pur, transparent com el cristall». L'extrem sud-est del mar Negre era famós pel seu or. L'explotació es diu que data de l'època de Mides I, i aquest or va ser important en la creació de les -probablement- primeres monedes del món a regne de Lídia al voltant del 610 aC.[26] A partir del segle v o VI, l'estat de Chu va fer circular el Yuan Ying, una espècie de moneda d'or quadrada.
En la metal·lúrgia romana, els nous mètodes per a l'extracció d'or a gran escala es varen desenvolupar mitjançant la introducció dels mètodes de mineria hidràulica, especialment a Hispània del 25 aC en endavant i a la Dàcia a partir de l'any 106. Una de les mines era a Las Médulas (Lleó), on set llargs aqüeductes els permetien alimentar un dipòsit al·luvial de grans dimensions. Les mines de Roșia Montană a Transsilvània també eren molt grans, i fins fa molt poc, encara explotades per mètodes a cel obert. També varen explotar dipòsits més petits a Britànnia, tant en placers com en dipòsits de roca dura a Dolaucothi. Els diversos mètodes que utilitzaren estan ben descrits per Plini el Vell a la seva enciclopèdia Naturalis Historiae escrita cap al final del segle i.
L'Imperi de Mali a l'Àfrica es va fer famós a tot el Vell Món per la seva gran quantitat d'or. Mansa Musa I, governant de l'imperi (1312-1337) es va fer famós a tot el món antic pel seu gran hajj a la Meca el 1324. Quan va passar pel Caire, el juliol de 1324, anava acompanyat per una caravana de camells que incloïa milers de persones i gairebé un centenar de camells. Va regalar tant or que va baixar el seu preu a Egipte durant més d'una dècada.[27] Un historiador àrab contemporani va comentar:
| « | L'or estava a un alt preu a Egipte fins que van arribar en aquest any. El mizqal no va ser inferior a 25 dirhams i en general per sobre, però des d'aquest moment va caure del seu valor, abaratir els preus i s'ha mantingut barat fins ara. El mizqal no superava els 22 dirhams o menys. Aquest ha estat l'estat de coses durant uns dotze anys, fins al dia d'avui a causa de la gran quantitat d'or que van portar a Egipte i va passar allà [...] | » |
| — Chihab Al-Umari[28] | ||
L'exploració europea d'Amèrica va ser impulsada en gran part pels informes dels adorns d'or que es mostraven profusament pels nadius americans, especialment a Amèrica Central, el Perú, Equador i Colòmbia. Els asteques consideraven l'or com el producte dels déus, que anomenaven «excrement diví» (teocuitlatl en nàhuatl).[29] No obstant això, per als pobles indígenes de Nord-amèrica, l'or era considerat inútil i es donava més valor a altres minerals més útils, com per exemple obsidiana, el pedrenyal i pissarra.[30]
Tot i que el preu d'alguns metalls del grup del platí poden ser molt més gran, l'or ha estat considerat com el més desitjable dels metalls preciosos, i el seu valor s'ha utilitzat històricament com l'estàndard per a moltes monedes (conegut com a patró or). L'or ha estat utilitzat com a símbol de puresa, valor, reialesa, i en particular les funcions que combinen aquestes propietats. L'or com un signe de riquesa i prestigi va ser ridiculitzat per Thomas More al seu tractat Utopia. En aquesta illa imaginària, l'or és tan abundant que es fa servir per fer les cadenes dels esclaus, la vaixella i els seients de bany. Quan els ambaixadors d'altres països arribaven vestit amb joies d'or ostentoses i insígnies, els utopistes els confonen amb funcionaris de baixa categoria, fent els honors als que anaven més modestament vestits del seu grup.
Hi ha una antiga tradició de mossegar l'or per comprovar la seva autenticitat. Encara que això no és certament una manera professional d'examinar l'or, la prova de la mossegada pot identificar l'or perquè és un metall tou, com ho indica la seva puntuació a l'escala Mohs de duresa mineral. Com més pur és l'or més fàcil ha de ser de marcar.
L'or a l'antiguitat era relativament fàcil d'obtenir geològicament. No obstant això, el 75% de tot l'or que s'ha produït s'ha extret abans de 1910.[31] S'ha estimat que tot l'or refinat existent formaria un cub de 20 m. de costat (el que equival a 8.000 m³).[31]
Un dels objectius principals dels alquimistes era produir or a partir d'altres substàncies, com ara el plom - mitjançant la interacció d'una substància mítica anomenada pedra filosofal. Encara que mai varen tenir èxit en aquest intent, els alquimistes varen fomentar l'interès en el qual es podia fer amb les substàncies, establint les bases per a la química. El símbol de l'or va ser un cercle amb un punt al centre (☉), que també va ser l'antic símbol astrològic dels caràcters xinesos per al mar.
Durant el segle xix, es va produir la febre de l'or que va permetre la descoberta de grans dipòsits d'or. El primer descobriment documentat d'or als Estats Units va ser la Reed Gold Mine a Carolina del Nord el 1803[32] Altres febres d'or es varen desenvolupar a Califòrnia, Colorado, Nova Zelanda, Austràlia, Sud-àfrica i a Canadà.
A causa del seu valor històricament alt, la major part de l'or extret al llarg de la història encara està en circulació en una forma o una altra.
Joieria
modificaEls quirats corresponen al percentatge d'or contingut en el metall.
| Quirats | 24 | 22 | 18 | 14 | 10 | 9 |
| % Or | 100 | 91,67 | 75 | 58,3 | 41,67 | 37,5 |
L'or pur de 24 quirats no és gaire utilitzat en joieria, sol estar aliat per a simplificar-ne el treball:
- amb níquel (or blanc)
- amb coure i amb argent (or groc o rosat)
- amb coure (or roig)
- amb argent (or verd)
- amb ferro (or gris)
- amb alumini (or violeta)
També es pot utilitzar en forma de fulles per a daurar llibres, estàtues,...
Paper biològic
modificaL'or no és un element essencial per a cap ésser viu. Alguns tiolats (o semblants) d'or (I) s'empren com antiinflamatoris en el tractament de l'artritis reumatoide i altres malalties reumàtiques. No es coneix bé el funcionament d'aquestes sals d'or. L'ús d'or en medicina és conegut com a crisoteràpia.
La majoria d'aquests compostos són poc solubles i és necessari injectar-los. Alguns són més solubles i es poden administrar per via oral, i són millor tolerats. Aquest tractament sol presentar alguns efectes secundaris, generalment lleus, però és la causa principal d'abandó entre els pacients.
Abundància i obtenció
modificaEl nombre atòmic de l'or, 79, en fa un dels elements amb el nombre atòmic més elevat que existeixen a la natura. Com tots els elements amb un nombre atòmic més alt que el del plom, es creu que l'or s'ha format en un procés de nucleosíntesi de supernova. Aquestes explosions dispersaren pols que contenien metalls (incloent-hi metalls pesants com l'or) a la regió de l'espai que més endavant es condensaria en el sistema solar i la Terra.
Pel fet que és relativament inert, se sol trobar com a metall, de vegades com a palletes grans, però generalment es troba en petites inclusions en alguns minerals, vetes de quars, pissarra, roques metamòrfiques i dipòsits al·luvials originats d'aquestes fonts. L'or està àmpliament distribuït i sovint es troba associat als minerals quars i pirita, i es combina amb tel·luri en els minerals calaverita, silvanita i altres. El país de Sud-àfrica és el principal productor d'or, cobrint aproximadament dos terços de la demanda global d'or.
L'or s'extreu per lixiviació amb cianur. L'ús del cianur facilita l'oxidació de l'or formant-se Au(CN)₂2- en la dissolució. Per a separar l'or es torna a reduir emprant, per exemple, zinc. S'ha intentat reemplaçar el cianur per algun altre lligand a causa dels problemes mediambientals que genera, però o no són rendibles o també són tòxics.
Hi ha una gran quantitat d'or en els mars i oceans, sent la seva concentració d'entre 0,1 µg/kg i 2 µg/kg, però en aquest cas no hi ha cap mètode rendible per a extreure'l.
Investigacions recents suggereixen que de vegades els microbis poden tenir un paper important en la formació de dipòsits d'or, transportant i precipitant l'or per formar grans i palletes que s'acumulen en dipòsits al·luvials.[33]
Consum
modificaL'Índia és el primer consumidor mundial d'or, car els indis compren aproximadament un 25% de l'or del món,[34] adquirint aproximadament 800 tones d'or per any. L'Índia també és el primer importador d'aquest metall; el 2008, l'Índia importà unes 400 tones d'or.[35]
Com altres metalls preciosos, l'or es mesura en unces troy i en grams. Quan s'hi fan aliatges amb altres metalls, es fa servir el terme "quirat" per indicar la quantitat d'or que hi ha present, sent 24 quirats l'or pur, i quirats inferiors una proporció menor. La puresa d'un lingot d'or també es pot expressar amb una xifra decimal que va de 0 a 1, conegut com a llei, i l'or de 0,995 o més és molt pur.
| Producció | Reserves mineres | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
| ||||||||||||||||||||||||||||||||||||||||
| Xifres del Servei Geològic dels Estats Units 2001, en tones | |||||||||||||||||||||||||||||||||||||||||
Isòtops
modificaL'or només té un isòtop estable, el 197Au, que també és el seu únic isòtop que existeix a la natura. Se n'han sintetitzat 36 radioisòtops, amb una massa atòmica que varia entre 169 i 205. El més estable és el 195Au, amb un període de semidesintegració de 186,1 dies. el 195Au també és l'únic isòtop que es desintegra per captura d'electrons. El menys estable és el 171Au, que es desintegra per emissió de protons, amb una semivida de 30 µs. La majoria dels radioisòtops de l'or amb una massa atòmica inferior a 197 es desintegren per alguna combinació d'emissió de protons, desintegració α, i desintegració β+. Les excepcions són el 195Au, que es desintegra per captura d'electrons, i el 196Au, que té una ruta menor de desintegració β+. Tots els radioisòtops de l'or amb una massa atòmica superior a 197 es desintegren per desintegració β-.[36]
També se n'han caracteritzat com a mínim 32 isòmers nuclears, amb una massa atòmica que varia entre 170 i 200. Dins d'aquest ventall, només el 178Au, el 180Au, el 181Au, el 182A, i el 188Au manquen d'isòmers. L'isòmer més estable de l'or és el 198 m2Au, amb una semivida de 2,27 dies. L'isòmer menys estable de l'or és el 177 m2Au, amb una semivida de només7 ns. el 184 m1Au té tres rutes de desintegració: la desintegració β+, la transició isomèrica i la desintegració alfa. Cap altre isòmer o isòtop de l'or no té tres rutes de desintegració.[36]
Compostos
modificaTot i que l'or és un metall noble, forma molts i diversos compostos. L'estat d'oxidació de l'or en els seus compostos va de -1 a +5, però dominen l'Au(I) i l'Au(III). L'or(I), conegut com a ió aurós, és l'estat d'oxidació més habitual, amb lligands "tous" com ara tioèters, tiolats i fosfines terciàries. Els compostos d'Au(I) són típicament lineals. Un bon exemple és Au(CN)₂−, que és la forma soluble de l'or que es troba a la mineria. Curiosament, els complexos aurosos de l'aigua són rars. Els halurs d'or binaris, com ara AuCl, formen cadenes polimèriques en zig-zag, també amb coordinació lineal a Au. La majoria de medicaments basats en or són derivats de l'Au(I).[37]
L'or (III) ("àuric") és un estat d'oxidació comú i és il·lustrat pel clorur d'or (III), AuCl₃. El seu derivat és l'àcid cloroàuric, HAuCl₄, que es forma quan l'Au es dissol en aigua règia. Els complexos d'Au (III), com altres compostos d8 són típicament plans quadrats.
Estats d'oxidació menys comuns: Au(-I), Au(II), and Au(V)
modificaEls compostos que contenen l'anió Au− reben el nom d'aururs. L'aurur de cesi, CsAu, es cristal·litza en el motiu de clorur de cesi.[38] Altres aururs inclouen els del Rb+, K+, i el tetrametilamoni (CH₃)₄N+.[39] Els compostos d'or(II) solen ser diamagnètics, amb enllaços Au-Au com ara [Au(CH₂)₂P(C₆H₅)₂]₂Cl₂. Un complex d'Au(II) legítim i destacable és el catió tetraxenó-or(II), que conté xenó com a lligand, [AuXe₄](Sb₂F11)₂.[40] El pentafluorur d'or és l'únic exemple d'Au(V), l'estat d'oxidació verificat més alt.[41]
Alguns compostos d'or presenten enllaços aurofílics, cosa que descriu la tendència dels ions d'or a interaccionar a distàncies que són massa llargues per ser un enllaç Au-Au convencional, però més curtes que els enllaços de Van der Waals.[42][43] S'estima que la força d'aquesta interacció és comparable a la d'un enllaç d'hidrogen.
Compostos de valència mixta
modificaSón nombrosos els compostos clúster ben definits.[39] En aquests casos, l'or té un estat d'oxidació fraccional. Un exemple representatiu és l'espècie octahèdrica {Au(P(C₆H₅)₃)}₆2+. Els calcogenurs d'or, com ara «AuS», tenen quantitats iguals d'Au(I) i Au(III).
Toxicitat
modificaL'or pur és no tòxic i no irritant quan s'ingereix[44] i de vegades es fa servir per decorar aliments en forma de pa d'or. També és un component de les begudes alcohòliques Goldschläger, Gold Strike i Goldwasser. L'or ha estat aprovat com a additiu alimentari a la Unió Europea (E175 del Codex Alimentarius).
Els compostos solubles (sals d'or), com ara el cianur d'or de potassi, utilitzat en la galvanització de l'or, són tòxics per al fetge i els ronyons. Hi ha hagut casos rars d'enverinament letal amb or a causa de cianur d'or de potassi.[45][46] La toxicitat de l'or es pot alleujar mitjançant teràpia de quelació, amb un agent quelant com ara el Dimercaprol.
El 2001, l'American Contact Dermatitis Society votà l'or com a Al·lergogen de l'Any.
Altres significats
modificaHeràldica
modificaL'or també és un color, un tipus de groc emprat a l'heràldica. En gravat es representa mitjançant punts fins repartits per la superfície del camp o figura.
Indústria musical
modificaA la indústria musical, el disc d'or és un certificat que s'ofereix per un determinat nombre de discos venuts. A Espanya la SGAE n'ofereix un als músics que venen més de 50.000 còpies. Als Estats Units és la RIAA que ofereix el disc d'or si un disc aconsegueix vendre almenys 500.000 còpies.[47]
Noces d'or
modificaLes noces d'or corresponen al 50è aniversari del casament d'una parella.
Edat d'or
modificaL'edat d'or és un mite que fa referència a una etapa de la humanitat de màxim desenvolupament social, tècnic i ètic, a diferència dels temps presents, degradats (es creu doncs que s'ha produït una involució). Aquesta edat d'or s'identifica amb un passat remot, amb el Paradís o amb una raça prèvia als humans contemporanis.
Referències
modifica- ↑ Magnetic susceptibility of the elements and inorganic compounds a Lide, D. R. CRC Handbook of Chemistry and Physics (en anglès). 86a edició. CRC Press, 2005. ISBN 0-8493-0486-5.
- ↑ «World Gold Council». Arxivat de l'original el 2008-05-11. [Consulta: 4 juliol 2008].
- ↑ «Or». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «Relativity in Chemistry». Math.ucr.edu. [Consulta: 5 abril 2009].
- ↑ Schmidbaur, Hubert; Cronje, Stephanie; Djordjevic, Bratislav; Schuster, Oliver «Understanding gold chemistry through relativity» (en anglès). Chemical Physics, 311, 1–2, 2005, pàg. 151–161. DOI: 10.1016/j.chemphys.2004.09.023.
- ↑ [Enllaç no actiu]«Gold Jewellery Alloys > Utilise Gold. Scientific, industrial and medical applications, products,suppliers from the World Gold Council». Utilisegold.com, 20-01-2000. Arxivat de l'original el 2008-06-19. [Consulta: 5 abril 2009].
- ↑ Hitzer, Eckhard; Perwass, Christian. «THE HIDDEN BEAUTY OF GOLD», 22-11-2006. Arxivat de l'original el 2012-01-27. [Consulta: 10 maig 2011].
- ↑ «World Gold Council > value > research & statistics > statistics > supply and demand statistics». Arxivat de l'original el 2006-07-19. [Consulta: 22 juliol 2006].
- ↑ Kitco.com Arxivat 2018-07-14 a Wayback Machine., Gold – London PM Fix 1975 – present (GIF), Consultat 2006-07-22.
- ↑ "Goldfinger Brown's £2 billion blunder in the bullion market" Arxivat 2008-05-11 a Wayback Machine.. The Times (London), 15 abril 2007.
- ↑ 11,0 11,1 «LBMA statistics». Lbma.org.uk, 31-12-2008. Arxivat de l'original el 2009-02-10. [Consulta: 5 abril 2009].
- ↑ «Gold hits yet another record high». BBC News, 02-12-2009 [Consulta: 6 desembre 2009].
- ↑ «PRECIOUS METALS: Comex Gold Hits All-Time High». The Wall Street Journal, 11-05-2010 [Consulta: 4 agost 2010].[Enllaç no actiu]
- ↑ ; Chang, Sue«Gold futures hit closing record as investors fret rescue deal». MarketWatch, 11-05-2010. [Consulta: 4 agost 2010].
- ↑ «Gold hits record, oil jumps with Libya unrest». yahoo.com, 01-03-2011. [Consulta: 1r març 2011].
- ↑ «Gold Extends Biggest Decline in 18 Months After CME Raises Futures Margins». www.bloomberg.com, 23-08-2011. [Consulta: 30 agost 2011].
- ↑ «Gold starts 2006 well, but this is not a 25-year high!|Financial Planning». Ameinfo.com. [Consulta: 5 abril 2009].
- ↑ King, Byron. «Gold mining decline». BullionVault.com, 20-07-2009. [Consulta: 23 novembre 2009].
- ↑ «Swiss Narrowly Vote to Drop Gold Standard». The New York Times, 19-04-1999.
- ↑ Kodak (2006) Toning black-and-white materials Arxivat 2016-08-17 a Wayback Machine.. Technical Data/Reference sheet G-23, maig 2006.
- ↑ Super cars.net. 1994 McLaren F1
- ↑ «The Demand for Gold by Industry». Gold bulletin.
- ↑ Krech, Shepard; McNeill, John Robert and Merchant, Carolyn. Encyclopedia of world environmental history, Volume 3. Routledge, 2004, p. 597. ISBN 0415937345.
- ↑ «General Electric Contact Materials». Electrical Contact Catalog (Material Catalog). Tanaka Precious Metals, 2005. Arxivat de l'original el 2007-01-01. [Consulta: 21 febrer 2007].
- ↑ Reeves, Nicholas Akhenaten: Egypt's False Prophet, Thames & Hudson, p.69 ISBN 0-500-28552-7
- ↑ «A Case for the World's First Coin: The Lydian Lion». [Consulta: 24 juliol 2009].
- ↑ Mansa Musa Arxivat 2006-05-24 a Wayback Machine. - Pàgines de la Història Negre
- ↑ «Kingdom of Mali – Primary Source Documents» (en anglès). African studies Center. Boston University. [Consulta: 30 gener 2012].
- ↑ Berdan, Frances; Anawalt, Patricia Rieff. The Codex Mendoza. 2. University of California Press, 1992, p. 151. ISBN 9780520062344.
- ↑ Museu Virtual de Sierra Nevada
- ↑ 31,0 31,1 «Goldsheet – yearly and cumulative world gold production charts». Arxivat de l'original el 2006-06-12. [Consulta: 22 juliol 2006].
- ↑ Moore, Mark A. «Reed Gold Mine State Historic Site». North Carolina Office of Archives and History, 2006. Arxivat de l'original el 2008-12-19. [Consulta: 13 desembre 2008].
- ↑ «Environment & Nature News - Bugs grow gold that looks like coral - 28/01/2004». [Consulta: 22 juliol 2006]. Investigació doctoral de Frank Reith de la Universitat Nacional d'Austràlia, publicada el 2004.
- ↑ http://www.nakedcapitalism.com/2008/03/indias-love-affair-with-gold-tarnishing.html
- ↑ http://www.commodityonline.com/news/Gold-Why-China-outbeats-India-in-gold-reserves-17196-3-1.html
- ↑ 36,0 36,1 Audi, G. «The NUBASE Evaluation of Nuclear and Decay Properties». Nuclear Physics A. Atomic Mass Data Center, 729, 2003, pàg. 3–128. DOI: 10.1016/j.nuclphysa.2003.11.001.
- ↑ Shaw III, C. F. «Gold-Based Medicinal Agents». Chemical Reviews, 99, 9, 1999, pàg. 2589–2600. DOI: 10.1021/cr980431o.
- ↑ Jansen, Martin «Effects of relativistic motion of electrons on the chemistry of gold and platinum». Solid State Sciences, 7, 12, 2005, pàg. 1464–1474. DOI: 10.1016/j.solidstatesciences.2005.06.015.
- ↑ 39,0 39,1 Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ Seidel, S.; Seppelt, K. «Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe₄2+(Sb₂F11−)₂». Science, 290, 5489, 2000, pàg. 117–118. DOI: 10.1126/science.290.5489.117. PMID: 11021792.
- ↑ Riedel, S.; Kaupp, M. «Revising the Highest Oxidation States of the 5d Elements: The Case of Iridium(+VII)». Angewandte Chemie International Edition, 45, 22, 2006, pàg. 3708–3711. DOI: 10.1002/anie.200600274.
- ↑ Hubert Schmidbaur «Ludwig Mond Lecture. High-carat gold compounds». Chem. Soc. Rev., 24, 1995, pàg. 391–400. DOI: 10.1039/CS9952400391.
- ↑ Hubert Schmidbaur «The Aurophilicity Phenomenon: A Decade of Experimental Findings, Theoretical Concepts and Emerging Application». Gold Bulletin, 33, 1, 2000, pàg. 3–10.
- ↑ S Dierks. «Gold MSDS». Electronic Space Products International, Maig 2005.
- ↑ I. H. Wright, C. J. Vesey «Acute poisoning with gold cyanide». Anaesthesia, 41, 79, 1986, pàg. 936–939. DOI: 10.1111/j.1365-2044.1986.tb12920.x.
- ↑ Wu, Ming-Ling; Tsai, Wei-Jen; Ger, Jiin; Deng, Jou-Fang; Tsay, Shyh-Haw; Yang, Mo-Hsiung. «Cholestatic Hepatitis Caused by Acute Gold Potassium Cyanide Poisoning». Clinical toxicology, 39, 7, 2001, pàg. 739–743. DOI: 10.1081/CLT-100108516.
- ↑ RIAA - Gold & Platinum (anglès). Consultat el 17 de setembre del 2009.
Bibliografia
modifica- Binder, H.: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3
- Faulk W, Taylor G (1979) An Immunocolloid Method for the Electron Microscope Immunochemistry 8, 1081–1083.
- Kodak (2006) Toning black-and-white materials Arxivat 2016-08-17 a Wayback Machine.. Technical Data/Reference sheet G-23, maig del 2006.
- Roth J, Bendayan M, Orci L (1980) FITC-Protein A-Gold Complex for Light and Electron Microscopic Immunocytochemistry. Journal of Histochemistry and Cytochemistry 28, 55–57.
- World Gold Council, Jewellery Technology, Jewellery Alloys Arxivat 2008-06-19 a Wayback Machine.
Vegeu també
modificaEnllaços externs
modifica- webelements.com - Or (anglès)
- environmentalchemistry.com - Or (anglès)
- Or com un afer no governamental Arxivat 2015-01-13 a Wayback Machine. (en anglès)
- Preus de l'or i economia (anglès)
- Història de l'or (italià)
| Aquest article conté una o més imatges PNG amb text que pot ser traduït al català. (ajuda) |