Fluorid uraničný
| Fluorid uraničný | |
|---|---|
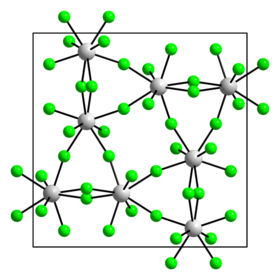 β polymorf | |
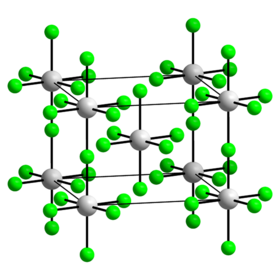 α polymorf | |
| Obecné | |
| Systematický název | Fluorid uraničný |
| Anglický název | Uranium pentafluoride |
| Německý název | Uran(V)-fluorid |
| Sumární vzorec | UF5 |
| Vzhled | světle žlutá paramagnetická pevná látka |
| Identifikace | |
| Registrační číslo CAS | 13775-07-0 |
| EC-no (EINECS/ELINCS/NLP) | 237-405-9 |
| PubChem | 83723 |
| SMILES | F[U](F)(F)(F)F |
| InChI | InChI=1S/5FH.U/h5*1H;/q;;;;;+5/p-5
Key: JNVYCANIFQDNST-UHFFFAOYSA-I |
| Vlastnosti | |
| Molární hmotnost | 333,02 g/mol |
| Teplota tání | 348 °C |
| Teplota změny krystalové modifikace | 130 °C |
| Hustota | 5,823 g/cm3 (α polymorf)
6,45 g/cm3 (β polymorf) |
| Struktura | |
| Krystalová struktura | tetragonální |
| Hrana krystalové mřížky | a = 651,2 pm, c = 446,3 pm (α polymorf)
a = 1150 pm, c = 519,8 pm (β polymorf) |
| Tvar molekuly | čtvercová pyramida |
| Bezpečnost | |
Některá data mohou pocházet z datové položky. | |
Fluorid uraničný je anorganická sloučenina s chemickým vzorcem UF5. Je to světle žlutá paramagnetická pevná látka. Fluorid uraničný je zajímavý, jelikož je příbuzný fluoridu uranovému, který se hojně využívá k výrobě uranového paliva. Krystalizuje ve dvou polymorfních formách, označovaných jako α- a β-UF5.
Příprava
[editovat | editovat zdroj]Fluorid uraničný je meziproduktem při oxidaci fluoridu uraničitého na fluorid uranový:[1]
- 2 UF4 + F2 → 2 UF5
- 2 UF5 + F2 → 2 UF6
Lze jej připravit redukcí fluoridu uranového oxidem uhelnatým při zvýšené teplotě:[2]
- 2 UF6 + CO → 2 UF5 + COF2
Fluorid uraničný vzniká také reakcí chloridu uranového nebo chloridu uraničného s fluorovodíkem:[1]
- 2 UCl6 + 10 HF → 2 UF5 + 10 HCl + Cl2
- 2 UCl5 + 10 HF → 2 UF5 + 10 HCl
Je možné jej připravit synproporcionací fluoridu uranového a uraničitého:[1]
- UF4 + UF6 → 2 UF5
Je možné jej také připravit redukcí fluoridu uranového bromovodíkem[1], nebo oxidem siřičitým při teplotě 160 °C.[3]
Vlastnosti
[editovat | editovat zdroj]α polymorf je lineární koordinační polymer skládající se z řetězců oktaedrických molekul uranu ve kterých jeden z pěti atomů fluoru tvoří můstek k dalšímu atomu uranu.[4] Struktura fluoridu uraničného je podobná struktuře fluoridu vanadičného. α polymorf krystalizuje v tetragonální krystalové soustavě s prostorovou grupou I4/m (Číslo 87) a parametry mřížky a = 651,2 pm a c = 446,3 pm.[1] Ve vakuu sublimuje při teplotě nad 150 °C, disproporcionovat začíná při 150 °C.[1] Tvoří světle modré až světle šedé krystaly a taje při 348 °C.[1]
U β polymorfu má uran strukturu čtvercového antiprismatu.[5] β polymorf krystalizuje v tetragonální krystalové soustavě s prostorovou grupou I42d (Číslo 122) a parametry mřížky a = 1150 pm a c = 519,8 pm.[1] β polymer je světle žlutý.
Při 130 °C přechází polymorf β na polymorf α.[4]
Monomer
[editovat | editovat zdroj]Molekulární UF5 může vznikat jako přechodný monomer UV-fotolýzou fluoridu uranového. Předpokládá se, že molekula bude mít tvar čtvercové pyramidy.[6]

Využití
[editovat | editovat zdroj]Fluorid uraničný se využívá při laserovém obohacování fluoridu uranového. Při tomto procesu je molekula obsahující 235U prvním laserem excitovaná a druhým laserem je následně odštěpen atom fluoru. Vzniklý pevný 235UF5 lze snadno odfiltrovat. 238UF6 se nepřeměňuje, takže je možné jednotlivé izotopy snadno oddělit. Po počátečním nadšení z tohoto procesu se následně objevila skepse ohledně jeho proveditelnosti v průmyslu.[7]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Uranium pentafluoride na anglické Wikipedii a Uran(V)-fluorid na německé Wikipedii.
- ↑ a b c d e f g h BRAUER, Georg. Handbuch der präparativen anorganischen Chemie: in drei Bänden. [s.l.]: Ferdinand Enke Verlag book s. Dostupné online. ISBN 978-3-432-87813-3. S. 1203–1204. (německy)
- ↑ HALSTEAD, Gordon W.; GARY ELLER, P.; PAINE, Robert T. 35. Uranium(V) Fluorides and Alkoxides. Příprava vydání John P. Fackler. 1. vyd. Svazek 21. [s.l.]: Wiley Dostupné online. ISBN 978-0-471-86520-9, ISBN 978-0-470-13252-4. DOI 10.1002/9780470132524.ch35. S. 162–167. (anglicky)
- ↑ GARY ELLER, P.; LARSON, A.C.; PETERSON, J.R. Crystal structures of α-UF5 and U2F9 and spectral characterizationof U2F9. Inorganica Chimica Acta. 1979-01, roč. 37, s. 129–133. Dostupné online [cit. 2023-12-29]. DOI 10.1016/S0020-1693(00)95530-0. (anglicky)
- ↑ a b HOWARD, C.J.; TAYLOR, J.C.; WAUGH, A.B. Crystallographic parameters in α-UF5 and U2F9 by multiphase refinement of high-resolution neutron powder data. Journal of Solid State Chemistry. 1982-12, roč. 45, čís. 3, s. 396–398. Dostupné online [cit. 2023-12-29]. DOI 10.1016/0022-4596(82)90185-2. (anglicky)
- ↑ TAYLOR, J.C.; WAUGH, A.B. Neutron diffraction study of β-uranium pentafluoride between 77 and 403 K. Journal of Solid State Chemistry. 1980-11, roč. 35, čís. 2, s. 137–140. Dostupné online [cit. 2023-12-29]. DOI 10.1016/0022-4596(80)90485-5. (anglicky)
- ↑ ONOE, J.; NAKAMATSU, H.; MUKOYAMA, T. Structure and Bond Nature of the UF 5 Monomer. Inorganic Chemistry. 1997-04-01, roč. 36, čís. 9, s. 1934–1938. Dostupné online [cit. 2023-12-29]. ISSN 0020-1669. DOI 10.1021/ic961237s. PMID 11669800. (anglicky)
- ↑ ZEIT (ARCHIV), D. I. E. Billig-Brennstoff für Atomkraftwerke. Die Zeit. 1975-06-13. Dostupné online [cit. 2023-12-29]. ISSN 0044-2070. (německy)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluorid uraničný na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid uraničný na Wikimedia Commons



