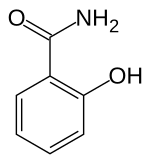
2-Hydroxybenzamid (auch Salicylamid) ist eine chemische Verbindung aus der Gruppe der substituierten Phenole.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 2-Hydroxybenzamid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H7NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer bis gelblicher Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 137,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,175 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
181 °C (19 hPa)[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Gewinnung und Darstellung
Bearbeiten2-Hydroxybenzamid kann durch Ammonolyse von Methylsalicylat gewonnen werden.[7] Eine Vorschrift zur Umsetzung bei geringem Überdruck, zum Beispiel im Praktikum, findet sich in der Literatur.[8]
Eigenschaften
Bearbeiten2-Hydroxybenzamid ist ein brennbarer, schwer entzündbarer, kristalliner, weißer bis gelblicher Feststoff.[2] Er besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15).[9] Bei hohem Druck sind auch noch andere Kristallstrukturen bekannt.[10]
Verwendung
Bearbeiten2-Hydroxybenzamid wird in Kombination mit Aspirin und Koffein in den rezeptfreien Schmerzmitteln eingesetzt. Es wird sowohl als Analgetikum als auch als Antipyretikum eingesetzt.[4][11] In Lösung in Ethanol dient es auch als Metallochromindikator in der Detektion von Eisen(III).[12] Es besitzt nur geringe antirheumatische Wirkung. Salicylamid wird im Organismus zu 20 % in Gentisinamid umgewandelt. 70 % des Salicylsäurederivats werden an Glucuronsäure gekoppelt im Urin ausgeschieden.[13] Als erstes Salicylamid-Präparat wurde 1949 Salicylamid Pharmazell von der Raublinger Firma Pharmazell zur Behandlung rheumatischer Erkrankungen in die Klinik eingeführt. Die Münchener Romigal-Arzneimittelgesellschaft bewarb 1953 eine in Tablettenform angebotene Salicylamid-Kombination Romigal (mit Phenacetin und Coffein) gegen Rheuma, Neuralgien, Ischias und Neuritiden, die Münchener Permicutan-Gesellschaft eine Kombination aus Benzocain und Salicylamid zur perkutanen Schmerzbekämpfung.[14]
Einzelnachweise
Bearbeiten- ↑ Eintrag zu SALICYLAMIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. September 2021.
- ↑ a b c d e f g h Eintrag zu 2-Hydroxybenzamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 316 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Datenblatt Salicylamide, 98% bei Alfa Aesar, abgerufen am 3. November 2018 (Seite nicht mehr abrufbar).
- ↑ Datenblatt Salicylamide, puriss., ≥99.0% bei Sigma-Aldrich, abgerufen am 25. Mai 2021 (PDF).
- ↑ basg.gv.at: Salicylamid, 17. April 2015, abgerufen am 6. Juli 2023
- ↑ Eintrag zu SALICYLAMIDE in der Hazardous Substances Data Bank (via PubChem), abgerufen am 3. November 2018.
- ↑ Eric Täuscher: Kleine Synthese-Ecke. In: Praktikum Biotechnische Chemie TU-Ilmenau, OC-1. Technische Universität Ilmenau, abgerufen am 11. Juni 2020.
- ↑ Yoshio Sasada, Tsunehiro Takano, Masao Kakudo: Crystal Structure of Salicylamide. In: Bulletin of the Chemical Society of Japan. 37, 1964, S. 940, doi:10.1246/bcsj.37.940.
- ↑ Russell D. L. Johnstone, Alistair R. Lennie u. a.: High-pressure polymorphism in salicylamide. In: CrystEngComm. 12, 2010, S. 1065, doi:10.1039/B921288D.
- ↑ Karl-Heinz Beyer: Biotransformation der Arzneimittel. Springer-Verlag, 2013, ISBN 978-3-642-74386-3, S. 493 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Townshend, D.T. Burns, Ryszard Lobinski, E.J. Newman, G. Guilbault, Z. Marczenko, H. Onishi: Dictionary of Analytical Reagents. CRC Press, 1993, ISBN 978-0-412-35150-1, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Lexikon der Biologie: Salicylamid, abgerufen am 3. November 2018.
- ↑ Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. XXX, XXXVII und LIII.