Sibutramin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| (R)-Form (oben) und (S)-Form (unten), 1:1-Stereoisomerengemisch | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sibutramin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H26ClN | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
193,6 °C (racemisches Hydrochlorid)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Sibutramin ist ein Arzneistoff, der als Appetitzügler (Anorektikum) zur Reduktion von starkem Übergewicht (Adipositas) verwendet wird. Der Hersteller des Originalpräparats war die deutsche Firma Knoll AG, die mittlerweile zum Pharmakonzern Abbott Laboratories in den USA gehört. Die Wirkung kommt über die indirekte Stimulierung des sympathischen Nervensystems zustande. Aufgrund starker Nebenwirkungen wurden Sibutramin-haltige Arzneimittel in allen Industrieländern mittlerweile vom Markt genommen.
Chemie
Sibutramin ist ein Amphetamin-Derivat. Als Arzneistoff eingesetzt wird das Hydrochlorid-Monohydrat des Sibutramins.[4]
Synthese
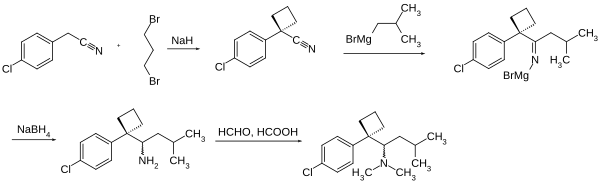
Die freie Base des Sibutramin kann in einer vierstufigen Synthese hergestellt werden.[4] Im ersten Reaktionsschritt wird ausgehend von (4-Chlorphenyl)-acetonitril durch Umsetzung mit 1,3-Dibrompropan mittels Natriumhydrid die Cyclobutanstruktur aufgebaut.[5] Durch Addition von 2-Methylpropylmagnesiumbromid an die Nitrilfunktion entsteht im zweiten Schritt eine Azomethinstruktur, die durch Reduktion mit Natriumborhydrid zunächst in ein primäres Amin überführt wird. Die N-Alkylierung erfolgt im vierten Reaktionsschritt mittels Formaldehyd und Ameisensäure. Die Synthesesequenz ergibt racemische Sibutramin-Base. Bei der Fällung mit Salzsäure entsteht das Hydrochlorid-Monohydrat.[4]
Stereoisomerie
Sibutramin besitzt ein stereogenes Zentrum. Es gibt also zwei Enantiomere, die (S)-Form und (R)-Form. Arzneilich wird das Racemat (1:1-Mischung der Enantiomeren) eingesetzt, wenngleich aus grundsätzlichen Überlegungen die Verwendung des besser bzw. nebenwirkungsärmer wirksamen Enantiomers zu bevorzugen wäre.[6]
Pharmakologie
Wirkmechanismus
Sibutramin ist ein indirektes Sympathomimetikum und kann oral verabreicht werden. Es hemmt die Wiederaufnahme der Neurotransmitter Noradrenalin und Serotonin in die Nervenzelle, wodurch deren Konzentration im synaptischen Spalt ansteigt, was wiederum die Erregung von Adrenozeptoren verstärkt und somit eine Appetitminderung zur Folge hat.[7]
Nebenwirkungen
Die Nebenwirkungen von Sibutramin sind erheblich und auch der Grund, warum die Anwendung des Wirkstoffs stark eingeschränkt ist. Sie umfassen zahlreiche Beschwerden von Kopfschmerzen, Mundtrockenheit, Übelkeit und Erbrechen bis hin zu Taubheitsgefühlen, Bluthochdruck und Herzrhythmusstörungen.[8]
Die Einnahme von Sibutramin ist kontraindiziert bei Schilddrüsenüberfunktion, Angina Pectoris, Schlafstörungen, Bluthochdruck, Epilepsie, Herzrhythmusstörungen und Störungen der Leber- und Nierenfunktion oder bei paralleler Einnahme von Antidepressiva und Neuroleptika.[8]
Nach Studien birgt Sibutramin vor allem für Herz-Kreislauf-Patienten ein deutlich erhöhtes Herzinfarkt-Risiko, eine US-Studie listet 34 Todesfälle durch den Arzneistoff auf.
Eine 3-jährige Studie mit Patienten, bei denen gleichzeitig eine Adipositas sowie eine koronare Herzkrankheit vorlagen, konnte eine Gewichtsreduktion von im Schnitt rund 3 Kilogramm belegen. Die Studie belegte aber keinen Überlebensvorteil durch Sibutramin, jedoch ein erhöhtes Risiko für kardiovaskuläre Ereignisse.[9]
Nutzen-Risiko-Bewertung und Auswirkung auf die Vermarktung
In Italien wurden Sibutramin-haltige Arzneimittel schon im Jahr 2002 auf Grund von zwei Todesfällen vom Markt genommen.[10] Um die Herz und Kreislauf betreffende Sicherheit und den potentiellen Nutzen einer Langzeiteinnahme zu untersuchen, wurde unter dem Namen Sibutramin Cardiovascular OUTcomes Trial (SCOUT) eine Studie in 16 Ländern mit annähernd 10.000 Probanden durchgeführt, die bis zu sechs Jahren Sibutramin einnahmen. Aufgrund des Studienergebnisses bewertete der Ausschuss für Humanarzneimittel der Europäischen Arzneimittelagentur im Januar 2010 das Nutzen-Risiko-Verhältnis negativ und empfahl umgehend, das Ruhen der Zulassung für Sibutramin-haltige Arzneimittel anzuordnen.[11] Der Hersteller des Originalpräparates hat daraufhin die Vermarktung in der EU ausgesetzt.[12] In Deutschland kam die Sistierung sofort zum Tragen, da ausschließlich Arzneimittel des Originalherstellers im Markt waren. Bereits zuvor waren in Deutschland Sibutramin-haltige Arzneimittel nur in stark begrenzten Dosierungen als Arzneimittel zugelassen.[13] In Polen wurde im März 2010 eine Sistierung der Zulassungen aller Präparate behördlich angeordnet,[14][15][16][17][18] ebenso in der Schweiz.[19]
Aufgrund des in der SCOUT-Studie festgestellten ungünstigen Nutzen-Risiko-Verhältnisses nahm Abbott, in Abstimmung mit der FDA, im Oktober 2010 auch in den USA das Medikament vom Markt.[20]
Handelsnamen
Monopräparate:
Reductil, Reduxade, Zelium (D, A, CH; außer Handel), Meridia (USA, außer Handel), LiDa (China)
Verbotener Handel und Gebrauch
Zur Reduktion des Körpergewichts, zur Steigerung der körperlichen Leistungsfähigkeit sowie zur Wirkungssteigerung von Kaffee werden Sibutramin-haltige Produkte illegal in den Handel gebracht.
Während im Jahr 2005 in Deutschland noch 125.000 illegal eingeführte Kapseln des chinesischen Medikaments LiDa beschlagnahmt wurden, überschritt diese Zahl im Jahr 2006 die Millionenmarke.[13] Zollbehörden vernichteten 2011 50.000 am Flughafen Frankfurt Main sichergestellte, in China hergestellte Sibutramin-haltige Schlankheitspillen.[21]
Das Hessische Verbraucherschutzministerium warnte am 2. Dezember 2011 vor dem Verzehr bestimmter Chargen des auch im Internet angebotenen Kaffees Slimming Coffee Leisure 18.[22] Zwei Chargen des Instantkaffees der Marke Vitaccino, in der Sibutramin nachweisbar war, wurden 2010 vom Markt genommen,[23][24] vor dem Konsum dieses Produkts wurde 2013 gewarnt, der Zoll hatte zuvor wegen desselben Inhaltsstoffes Lieferungen online bestellter Ware sichergestellt.[25] Auch in Folgejahren tauchten immer wieder Nahrungsergänzungsmittel und vermeintlich rein pflanzliche Lifestyle-Präparate zur Gewichtsreduktion auf, die Sibutramin enthielten.[26][27][28]
2006 wurde Sibutramin von der Welt-Anti-Doping-Agentur (WADA) als verbotener Wirkstoff namentlich in die Gruppe S6, Stimulanzien, aufgenommen.[29]
Weblinks
- Einträge im NIH-Studienregister
Einzelnachweise
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Sibutramin Hydrochlorid Monohydrat: CAS-Nr.: 125494-59-9, EG-Nr.: 603-075-3, ECHA-InfoCard: 100.120.203, PubChem: 64765, ChemSpider: 58299, Wikidata: Q27285644.
- ↑ P. R. Oliveira, H. K. Stulzer, L. S. Bernardi, S. H. M. Borgmann, S. G. Cardoso, M. A. S. Silva: Sibutramine hydrochloride monohydrate – Thermal behavior, decomposition kinetics and compatibility studies in J. Therm. Anal. Calorim. 100 (2010) 277–282, doi:10.1007/s10973-009-0200-7.
- ↑ a b Datenblatt Sibutramine hydrochloride monohydrate, ≥98% (HPLC), solid bei Sigma-Aldrich, abgerufen am 21. Dezember 2019 (PDF).
- ↑ a b c A. Kleemann, J. Engel, B. Kutscher D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications, 4. Auflage (2000), Thieme-Verlag Stuttgart, S. 1872–1873, ISBN 978-1-58890-031-9.
- ↑ Donald Eugene Butler, Joy C. Pollatz: Facile cycloalkylation of arylacetonitriles in dimethyl sulfoxide. In: J. Org. Chem. Band 36, Nr. 9, Mai 1971, S. 1308–1309, doi:10.1021/jo00808a035.
- ↑ E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology, European Journal of Clinical Pharmacology 26 (1984) 663–668. doi:10.1007/BF00541922.
- ↑ Lüllmann, Mohr, Hein: Taschenatlas Pharmakologie (5. Auflage). S. 95.
- ↑ a b Informationen über das Medikament Reduktil ( vom 1. Januar 2006 im Internet Archive). Auf: www.adipositas-online.de von 2005.
- ↑ W. Philip T. James, Ian D. Caterson, Walmir Coutinho, Nick Finer, Luc F. Van Gaal, Aldo P. Maggioni, Christian Torp-Pedersen, Arya M. Sharma, Gillian M. Shepherd, Richard A. Rode, Cheryl L. Renz: Effect of Sibutramine on Cardiovascular Outcomes in Overweight and Obese Subjects. In: The New England Journal of Medicine. 2010, 363, 10, S. 905–917, doi:10.1056/NEJMoa1003114.
- ↑ Appetithemmer Sibutramin: Forderung nach Marktrücknahme. Deutsches Ärzteblatt 99, Ausgabe 14 vom 5. April 2002, Seite A-897 / B-749 / C-701.
- ↑ Sibutraminhaltige Arzneimittel: Ruhen der Zulassung aufgrund eines erhöhten Risikos für kardiovaskuläre Ereignisse. BfArM, 25. Januar 2010, abgerufen am 3. Mai 2017.
- ↑ Ruhen der Marktzulassung für Reductil wegen der Beobachtung eines erhöhten kardiovaskulären Risikos im Rahmen der SCOUT-Studie (PDF; 334 kB) Rote Hand Brief vom 22. Januar 2010.
- ↑ a b Bundesministerium der Finanzen: Schlankheitspillen mit lebensgefährlichen Nebenwirkungen ( vom 10. Februar 2007 im Internet Archive). Auf: Zoll online am 2. Juni 2006.
- ↑ Sistierung von Meridia, Firma Abbott (PDF; 595 kB).
- ↑ Sistierung von Obesan, Firma Sandoz (PDF; 603 kB).
- ↑ Sistierung von Sibutramin 1A, Firma 1A Pharma (PDF; 615 kB).
- ↑ Sistierung von Afibron, Firma Teva (PDF; 585 kB).
- ↑ Sistierung von Zelixa, Firma Biofarm (PDF; 602 kB).
- ↑ Swissmedic sistiert Zulassung des Appetitzüglers Reductil in der Schweiz ( vom 5. Juni 2011 im Internet Archive), Swissmedic vom 29. März 2010, abgerufen am 31. März 2010.
- ↑ Offizielle Mitteilung der FDA vom 8. Oktober 2010, abgerufen am 12. Oktober 2010.
- ↑ Zollfahndung vernichtet Arznei- und Dopingmittel sowie gefälschte Markentextilien ( vom 12. Oktober 2013 im Webarchiv archive.today), Zollfahndungsamt Frankfurt am Main, 17. August 2011.
- ↑ www.hmuelv.hessen.de: Warnung vor Slimming Coffee Leisure 18 ( vom 23. Januar 2016 im Internet Archive) (MS Word; 115 kB).
- ↑ Pharma-Mittel in Instant-Kaffee. Imperia Elita ruft „Vitaccino“ zurück, Frankfurter Rundschau, 7. Oktober 2010
- ↑ Sibutramin im Kaffee: Firma ruft Instant-Produkt zurück ( vom 14. Oktober 2013 im Internet Archive) Deutsche Ärztezeitung, 10. Dezember 2010
- ↑ Verbotener Wirkstoff: Warnung vor Schlankheitskaffee „Vitaccino“ ( vom 2. Juni 2015 im Internet Archive), Landesuntersuchungsamt Rheinland-Pfalz, Koblenz 4. März 2013.
- ↑ Uwe Felten: Illegaler Appetitzügler: Dringende Warnung vor Kaffee und Tee mit Sibutramin. 30. Juni 2023, abgerufen am 5. Juli 2023.
- ↑ Cornelia Neth: Vorsicht Sibutramin – Warnung vor gesundheitsschädlichem Schlankheitstee. 29. März 2023, abgerufen am 5. Juli 2023.
- ↑ Apotheke Adhoc: „Molecule“ macht krank statt schlank. Abgerufen am 5. Juli 2023 (deutsch).
- ↑ The World Anti-Doping Code – The 2006 Prohibited List (PDF).