Peroxide

Peroxide, veraltet auch Peroxyde geschrieben, sind eine chemische Stoffgruppe, die das Peroxidanion O22− beziehungsweise eine Peroxygruppe –O–O– enthalten.[1] Im Gegensatz zum Oxidion, dem häufigsten Anion des Sauerstoffs, besitzen die Sauerstoffatome im Peroxidion die Oxidationsstufe −1.
Die Gruppe peroxidischer Verbindungen kann zunächst grob in anorganische und organische Peroxide unterteilt werden, wobei die anorganischen oftmals salzartigen Charakter besitzen, die organischen hingegen kovalent gebundene Peroxygruppen tragen. Die Sauerstoff-Sauerstoff-Bindung von Peroxiden ist labil und neigt zur homolytischen Spaltung unter Bildung reaktiver Radikale. Aus diesem Grund sind Peroxide in der Natur nur in geringen Mengen anzutreffen, unter anderem im Wasser und der Erdatmosphäre sowie in geringen Mengen in pflanzlichen, tierischen und menschlichen Organismen.
Industrielle Bedeutung erlangen Peroxide durch ihre Bleichwirkung gegenüber organischen Substanzen. So werden sie Waschmitteln beigemengt, unter anderem unter der Werbebezeichnung Aktivsauerstoff, oder in Haarfärbeprodukten eingesetzt. Zu den weiteren Anwendungsbereichen gehören die chemische Industrie, in der Peroxide zur Synthese eingesetzt werden oder als Zwischenprodukte auftreten, sowie die Medizin. Wasserstoffperoxid (H2O2) ist mit einem jährlichen Produktionsvolumen von über 2.000.000 Tonnen die wirtschaftlich bedeutendste peroxidische Verbindung.
Oft sind die Peroxide instabil, somit nicht lagerfähig und bisweilen gefährliche Substanzen. Deshalb werden sie oft vor Ort (in situ) hergestellt und sogleich umgesetzt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Als wahrscheinlich erste synthetisch hergestellte Peroxoverbindung erhielt Alexander v. Humboldt im Jahre 1799 bei Versuchen zur Zerlegung der Luft Bariumperoxid (BaO2). Erst 19 Jahre später erkannte Thénard, dass dieses Salz zur Herstellung einer bisher unbekannten Verbindung genutzt werden kann, die er als oxidiertes Wasser bezeichnete – heute als Wasserstoffperoxid bekannt.[2] Im Jahre 1811 stellten Thénard und Gay-Lussac erstmals Natriumperoxid (Na2O2) her. In anhaltenden Forschungsbemühungen der folgenden Jahrzehnte wurden Wasserstoffperoxid und seine Salze untersucht. Auf der Suche nach einer Verwendung wurde schon früh die bleichende Wirkung der Verbindung auf natürliche Farbstoffe erkannt. Ein industrieller Einsatz scheiterte jedoch zunächst daran, dass lediglich schwach konzentrierte und verunreinigte Bariumperoxidlösungen hergestellt werden konnten. Die erste industrielle Anlage zur Synthese von Wasserstoffperoxid entstand 1873 in Berlin. Erst nach der Entdeckung der Synthese von Wasserstoffperoxid durch Elektrolyse von Schwefelsäure konnten verbesserte Verfahren auf elektrochemischer Basis entwickelt werden. Die erste Fabrik, die nach diesem Verfahren arbeitete, wurde 1908 in Weißenstein in Kärnten errichtet. Das heute noch verwendete Anthrachinon-Verfahren wurde während der 1930er Jahre bei den I.G. Farben in Ludwigshafen entwickelt. Durch modernere Syntheseverfahren und die Erweiterung des Anwendungsgebiets stieg die Jahresproduktion von Wasserstoffperoxid stark von 35.000 t im Jahr 1950 über 100.000 t 1960 zu 300.000 t 1970 an. 1998 bestand eine weltweite Produktionskapazität von 2.700.000 t pro Jahr.[3]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]In der Umwelt
[Bearbeiten | Quelltext bearbeiten]
Peroxide sind meist sehr reaktiv, weshalb es nur geringe natürliche Vorkommen gibt. Hierzu gehören neben Wasserstoffperoxid wenige pflanzliche Naturstoffe wie beispielsweise ein peroxidisches Derivat des Prostaglandins sowie Ascaridol. Wasserstoffperoxid tritt natürlich in Oberflächenwasser, Grundwasser sowie in der Erdatmosphäre auf. Die Bildung erfolgt hier durch die Einwirkung von Licht oder natürlichen katalytisch wirksamen Substanzen aus Wasser. In Meerwasser sind 0,5–14 μg/l, in Süßwasser 1–30 μg/l, in Luft 0,1–1 ppb enthalten.[3]
Es sind zwei peroxidhaltige Minerale bekannt, Studtit und Metastudtit. Es handelt sich um Uranylperoxide mit unterschiedlichen Mengen Kristallwasser in der Struktur. Das instabile Peroxid entsteht dabei bei der Radiolyse von Wasser durch die Alphastrahlung des Urans. Außer in natürlichen Uranlagerstätten bilden sich diese Verbindungen auch auf der Oberfläche von radioaktiven Abfällen und könnten daher in ihrer Stabilität für die Endlagerung von Uranabfällen von Bedeutung sein.[4]
In biochemischen Prozessen
[Bearbeiten | Quelltext bearbeiten]Auch in menschlichen und tierischen Organismen wird Wasserstoffperoxid gebildet. Es tritt als kurzlebiges Produkt in biochemischen Prozessen auf und gehört zu den Zellgiften. Die Toxizität beruht auf Veränderungen von Proteinen, Membranlipiden und DNA durch oxidative Reaktionen der Peroxidionen.[5] Das Enzym Superoxiddismutase, das der Beseitigung gebildeter Superoxidionen dient, produziert durch Disproportionierung Wasserstoffperoxid in vivo. Diese wird dann durch das Enzym Katalase rasch zu Sauerstoff und Wasser zersetzt.[6]
- Bildung von Wasserstoffperoxid durch Superoxiddismutase (SOD).
- Abbau von Wasserstoffperoxid durch Katalase (CAT)
Peroxisomen sind Zellorganellen in eukaryotischen Zellen, die dem oxidativen Fettsäureabbau dienen. Während des Abbaus wird in ihnen Wasserstoffperoxid gemäß folgender Gleichung produziert:[7]
Entstandenes Wasserstoffperoxid wird anschließend wiederum durch Katalase umgesetzt.
Ein weiterer Entstehungsort von Wasserstoffperoxid ist der Abbau von Adenosinmonophosphat. In einer Abfolge biochemischer Reaktionen wird dieses zunächst zu Hypoxanthin umgesetzt. Dieses wird dann oxidativ zunächst zu Xanthin und anschließend zu Harnsäure katabolisiert. Diese Reaktion wird durch das Enzym Xanthinoxidase katalysiert und es entsteht ein Äquivalent Wasserstoffperoxid je Formelumsatz.[8]

Auch der Abbau von Guanosinmonophosphat läuft über Xanthin als Zwischenprodukt, welches dann auf gleichem Wege unter Bildung von Wasserstoffperoxid zu Harnsäure umgesetzt wird.[8]
In Eizellen von Seeigeln wird kurz nach der Befruchtung durch ein Spermium kurzzeitig Wasserstoffperoxid produziert. Dieses wird zu OH-Radikalen dissoziiert und dient als Initiator einer radikalischen Polymerisation, welche die Eizelle mit einer dichtenden polymeren Schutzschicht umgibt.[9]
Die Bombardierkäfer besitzen am Hinterleib einen Explosionsapparat, mit welchem sie zur eigenen Verteidigung ätzende und übelriechende Blasen auf Feinde zu schießen vermögen. Zum Hinausblasen einer Blase werden kurz zuvor Wasserstoffperoxid und Hydrochinon miteinander vermischt, die heftig miteinander reagieren und zum Abschuss des Chemikaliengemischs führen.[10][11]
Des Weiteren stellt Wasserstoffperoxid ein Signalmolekül bei der pflanzlichen Abwehr von Pathogenen dar.[12]
In Leuchtkäfern werden durch Oxidation von Luciferinen 1,2-Dioxetane gebildet. Diese Reaktion wird von Luciferasen katalysiert. Das entstandene Dioxetan ist labil und zerfällt spontan zu Kohlenstoffdioxid und einem angeregten Keton. Dieses relaxiert unter Abgabe eines Photons in den Grundzustand, wodurch das Leuchten dieser Spezies hervorgerufen wird.[13]

Bindung
[Bearbeiten | Quelltext bearbeiten]
Das Peroxidion ist aus zwei Sauerstoffatomen aufgebaut, welche über eine Einfachbindung miteinander verknüpft sind. Dies steht im Einklang mit dem MO-Diagramm des Peroxidions, das auf Grund der doppelt besetzten antibindenden π*-Molekülorbitale eine Bindungsordnung von 1 vorhersagt. Die Bindungslänge beträgt 149 pm und ist im Vergleich zum Sauerstoffmolekül (Triplett-Sauerstoff (3O2): 121 pm) durch die zunehmende Besetzung antibindender Orbitale verlängert. Dies drückt sich auch in der kleineren Kraftkonstante der Bindung (2,8 N/cm, 3O2: 11,4 N/cm) und der kleineren Frequenz der Molekülschwingung (770 cm−1, 3O2: 1555 cm−1) aus.[14]
Das Peroxidion ist im Vergleich zu den weiteren Sauerstoffmolekülionen (Hyperoxidion: O2− und Ozonidion O3−) sowie dem Sauerstoffmolekül als einziges kein Radikal und nicht paramagnetisch.[14]
Aufgrund der schwachen Bindung zwischen den Sauerstoffatomen kann leicht eine homolytische Spaltung induziert werden. Hierbei werden zwei radikalische Fragmente gebildet, die in den meisten Fällen eine hohe Reaktivität aufweisen.
Auslöser für die Spaltung können sowohl Temperatur (Thermolyse) als auch Lichtwellen (Photolyse) oder chemische Reaktionen sein.
Anorganische Peroxide
[Bearbeiten | Quelltext bearbeiten]
Die Gruppe der anorganischen Peroxide gliedert sich in die Klassen der ionischen Peroxidsalze und die der anorganischen Säureperoxide, die kovalent gebundene Peroxideinheiten tragen. Während von der ersten Klasse im Wesentlichen die Peroxide der Alkali- und Erdalkalimetalle von technischer Bedeutung sind, ist bei den kovalenten Wasserstoffperoxid der prominenteste Vertreter. Des Weiteren sind noch eine Reihe von Peroxiden von Mineralsäuren wie Carosche Säure und Perkohlensäure von Bedeutung. Im Gegensatz zum rein ionischen Charakter der Alkalimetallperoxide besitzen die Peroxide der Übergangsmetalle einen stärker kovalenten Charakter, was auf ihre höhere Elektronegativität zurückzuführen ist.[15]
Darstellung
[Bearbeiten | Quelltext bearbeiten]Synthese ionischer Peroxide
[Bearbeiten | Quelltext bearbeiten]Alkalimetallperoxide, mit Ausnahme von Lithiumperoxid, können direkt durch Oxidation der Elemente mit Sauerstoff unter Normaldruck dargestellt werden.[15]
- M = Alkalimetall.
Lithiumperoxid hingegen kann durch Umsetzung von Lithiumhydroxid mit Wasserstoffperoxid synthetisiert werden.[15]
Das historisch zur Wasserstoffperoxidherstellung genutzte Bariumperoxid kann durch Oxidation von Bariumoxid bei erhöhter Temperatur und erhöhtem Druck erhalten werden.[16]
Synthese kovalenter Peroxide
[Bearbeiten | Quelltext bearbeiten]
Das am weitesten verbreitete Verfahren zur Synthese von Wasserstoffperoxid ist das Anthrachinon-Verfahren. In diesem wird zunächst eingesetztes Anthrachinon katalysiert durch Palladium mit molekularem Wasserstoff hydriert. Aus dem entstandenen Anthrahydrochinon wird in einem zweiten Schritt durch Oxidation mit molekularem Sauerstoff Wasserstoffperoxid unter Rückbildung von Anthrachinon freigesetzt.[16] Die Bruttoreaktionsgleichung lautet somit:
Die direkte Synthese von Wasserstoffperoxid aus den Elementen ist derzeit im industriellen Maßstab nicht möglich, da es nur in geringem Maße gebildet wird.[16] Viele peroxidische Mineralsäuren lassen sich durch anodische Oxidation der zugrundeliegenden Säuren synthetisieren. So sind beispielsweise Peroxodisulfate[17] und Percarbonate[18] auf diesem Wege zugänglich.
Peroxodischwefelsäure diente historisch zur Herstellung von Wasserstoffperoxid in einem zu Beginn des 20. Jahrhunderts entwickelten Verfahren. Die oxidativ erhaltene Peroxodischwefelsäure wurde hierbei durch Hydrolyse in Wasserstoffperoxid und Schwefelsäure überführt.[3][16]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Für die Reaktionen von Peroxidsalzen sind wenige Reaktionen allgemein formulierbar. Bei allen Peroxidsalzen tritt bei Versatz mit einem Überschuss verdünnter Säuren die Freisetzung von Wasserstoffperoxid auf.[15]
- Saure Hydrolyse von Natriumperoxid zu Natronlauge und Wasserstoffperoxid.
Die Reaktion mit Wasser, ebenso die Thermolyse des Salzes, führt zur Bildung naszierenden Sauerstoffs.[15]
- Hydrolyse von Natriumperoxid zu Natronlauge und Sauerstoff.
- Thermolyse von Natriumperoxid zu Natriumoxid und Sauerstoff.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Peroxide sind starke Oxidationsmittel und können zur Oxidation weiterer Verbindungen eingesetzt werden.
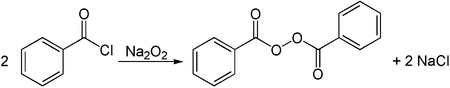
Alkalimetallperoxide können zur Synthese organischer Peroxide verwendet werden. Ein Beispiel ist die Umsetzung von Natriumperoxid mit Benzoylchlorid zu Dibenzoylperoxid.[19]
Viele anorganische Peroxide finden Verwendung als Bleichmittel in der Textilindustrie sowie in der Papierindustrie.[16] Durch die zunehmende Entwicklung umweltschonender Bleichverfahren ist die Verwendung peroxidhaltiger Verbindungen stark angestiegen und hat die älteren auf der Bleichwirkung chlorhaltiger Verbindungen basierende Herangehensweise in weiten Teilen verdrängt.[3] Zu den Hauptanwendungsgebieten im Haushalt gehören der Einsatz in Waschmitteln.[20] In der Vergangenheit wurden hierzu Perborate eingesetzt, welche auf Grund der ansteigenden Borkonzentrationen in der Umwelt weitgehend durch Percarbonate ersetzt wurden. Die Verwendung peroxidischer Verbindungen in Waschmitteln schlägt sich auch in deren Handelsbezeichnungen nieder. So setzt sich der Name des Waschmittels Persil aus den Worten Perborat und Silicat zusammen.
Durch Reaktion mit Kohlenstoffdioxid kann aus einigen peroxidischen Salzen Sauerstoff unter Bildung von Carbonatsalzen freigesetzt werden. Dies wird in Sauerstoffgeneratoren beispielsweise in Atemgeräten, U-Booten oder Raumkapseln ausgenutzt. Zur Generation von Sauerstoff wird hierbei das in der Atemluft unerwünschte Kohlenstoffdioxid, das als Stoffwechselprodukt in die Umgebung abgegeben wird, umgesetzt und benötigter Sauerstoff freigesetzt. In den meisten Fällen wird hierzu Natriumperoxid verwendet, in Raumkapseln jedoch Lithiumperoxid, da es eine geringere molare Masse besitzt und pro Gewichtseinheit verhältnismäßig ein größeres Volumen an Sauerstoff zu erzeugen vermag.[16]
- Reaktion von Natriumperoxid mit Kohlenstoffdioxid zu Natriumcarbonat und Sauerstoff.
Bariumperoxid wurde historisch zur Herstellung reinen Sauerstoffs aus Luft verwendet. Ausgenutzt wurde hierzu das temperaturabhängige Gleichgewicht zwischen Bariumoxid und -peroxid. Durch die Umsetzung von Bariumoxid mit Luft wurde zunächst bei 500 °C Bariumperoxid gebildet. Dieses setzt bei Temperaturen über 700 °C Sauerstoff unter Rückbildung von Bariumoxid frei.[16]
Calciumperoxid CaO2 wird als sauerstoffabgebendes Belüftungsmittel in Böden und Teichschlamm eingesetzt, in den USA auch als Lebensmittelzusatzstoff zur Teigauflockerung.[21]
Organische Peroxide
[Bearbeiten | Quelltext bearbeiten]Die Gruppe der organischen Peroxide teilt sich im Wesentlichen in zwei Verbindungsklassen auf, die Peroxycarbonsäuren und die organischen Peroxide beziehungsweise Hydroperoxide. Die erste Klasse leitet sich von den Carbonsäuren ab, die zweite formal von den Ethern beziehungsweise Alkoholen.
Unter Endoperoxiden versteht man cyclische organische Verbindungen mit einer Peroxidgruppe die zwei Atome eines Rings miteinander verbindet. Der Zusatz endo steht dafür, dass die Peroxidbrücke sich innerhalb des Rings befindet.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Synthese von Peroxiden und Hydroperoxiden
[Bearbeiten | Quelltext bearbeiten]Zur Synthese aliphatischer Peroxide sind mehrere Wege bekannt. So kann die Reaktion von Dialkylsulfaten mit alkalischer Wasserstoffperoxidlösung hierzu benutzt werden.[22][23] Das Alkylsulfat tritt hierbei als Donor der Alkylgruppe auf und das Sulfation reagiert im Sinne einer Abgangsgruppe.
Cyclische Peroxide hingegen können aus Alkylendisulfaten unter gleichen Bedingungen erhalten werden.[24] Die viergliedrigen Dioxetane lassen sich durch [2+2]-Cycloaddition von Sauerstoff an Alkene darstellen.[25]

Die gezielte Synthese von Hydroperoxiden kann durch radikalische Oxidation von Alkanen mit Sauerstoff durchgeführt werden. Das durch einen Radikalstarter gebildete Primärradikal reagiert hierbei mit Sauerstoff zu einem Hydroperoxylradikal. Dieses ist ein wenig reaktives Radikal, das mit hoher Selektivität aktivierte Wasserstoffatome zu abstrahieren vermag, wobei das Hydroperoxid unter Bildung eines neuen Radikals freigesetzt wird.[26] Diese Selektivität wird beispielsweise in der Hockschen Phenolsynthese großtechnisch ausgenutzt.[27]
Diese Reaktion läuft auch langsam durch Luftsauerstoff induziert bei Stoffen ab, die stabile Radikale bilden können. Beispiele hierfür sind die Autoxidation häufig eingesetzter Lösungsmitteln aus der Gruppe der Ether, wie beispielsweise Diethylether, Diisopropylether, Tetrahydrofuran oder 1,4-Dioxan. Hierbei entstehen explosive Etherhydroperoxide, die beim Erhitzen oder Konzentrieren schwere Explosionen verursachen können.[26]

Peroxide können in Organismen durch eine En-Reaktion oder Diels-Alder-Reaktion von Alkenen mit Sauerstoff gebildet werden. Als olefinische Substrate können hierbei ungesättigte Fettsäuren zur En-Reaktion oder ungesättigte Aminosäuren wie Histidin zur Diels-Alder-Cyclisierung dienen.[28] Auch das Ranzigwerden von Fetten wird teils durch die Bildung von Peroxiden verursacht. Hierbei laufen Oxidationen mit Luftsauerstoff wie die En-Reaktion oder Radikalreaktionen ab und bilden neben Peroxiden auch Alkohole, Aldehyde und Carbonsäure. Die Verdorbenheit eines Fettes oder Öls kann somit anhand der Peroxidzahl bestimmt werden, welche die Menge an Peroxiden pro Kilogramm Substanz angibt.[29]
Synthese von Peroxycarbonsäuren
[Bearbeiten | Quelltext bearbeiten]Die meisten Peroxycarbonsäuren sind durch die Reaktion von Wasserstoffperoxid mit der entsprechenden Carbonsäure zugänglich:
- R = Organischer Rest
Einen weiteren Syntheseweg stellt die Verwendung von Carbonsäurechloriden anstelle der freien Carbonsäure dar. Dieser Weg wird vor allem bei aromatischen Carbonsäuren gewählt und im basischen Milieu durchgeführt, um den entstehenden Chlorwasserstoff zu neutralisieren.
Auch aromatische Aldehyde gehen eine Autooxidation zu Peroxycarbonsäuren ein:
- Ar = Aryl
Diese reagieren jedoch mit weiterem Aldehyd zur Carbonsäure:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Peroxycarbonsäuren sind im Allgemeinen schwächere Säuren als die ihnen zu Grunde liegenden Carbonsäuren. Wie die meisten peroxidischen Verbindungen neigen sie in hoher Konzentration und bei höheren Temperaturen zu explosivem Verhalten.
In Gegenwart oxidierbarer Verbindungen können sie als Oxidationsmittel fungieren.[26]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Organische Persäuren können zur Synthese von Epoxiden dienen. Dies geschieht in der Prileschajew-Reaktion.[30] Die Baeyer-Villiger-Umlagerung zur Synthese von Lactonen aus cyclischen Ketonen stellt ein weiteres Anwendungsgebiet für organische Peroxide dar.[31] In beiden Fällen eignen sich besonders elektronenarme Peroxycarbonsäure zur Durchführung der Reaktion. Eine häufig verwendete Persäure stellt meta-Chlorperbenzoesäure (mCPBA) dar.


Das Hydroperoxid tert-Butylhydroperoxid dient in der Sharpless-Epoxidierung zur enantioselektiven Synthese von Epoxiden, für welche unter anderem 2001 der Nobelpreis für Chemie an Barry Sharpless verliehen wurde, als Oxidationsmittel.[32]
Peressigsäure findet als Desinfektionsmittel im medizinischen Bereich und der Lebensmittelindustrie Anwendung.[33] Es sind des Weiteren peroxidhaltige Lösungen zur Reinigung von Kontaktlinsen im Handel erhältlich.
Sowohl im Labor- als auch im industriellen Einsatz wird Dibenzoylperoxid als Radikalstarter verwendet. Die schwache peroxidische Bindung kann leicht homolytisch gespalten werden und bildet somit reaktive Benzoylradikale. Diese können im großtechnischen Maßstab zur Polymerisation zu Kunststoffen wie Polyethylen eingesetzt werden.[34][35]
Von industrieller Bedeutung ist die Synthese des zur Kunststoffherstellung benötigten ε-Caprolactams. Hierzu wird ε-Caprolacton durch eine Baeyer-Villiger-Umlagerung von Cyclohexanon mit Peressigsäure gebildet, welches anschließend mit Ammoniak zum Lactam umgesetzt wird.[36]
Industrielle Kunstharze auf Basis von Acryl- und/oder Methacrylsäureestern werden ausnahmslos durch radikalische Polymerisation mit organischen Peroxiden bei erhöhten Temperaturen hergestellt.[37] Durch geeignete Wahl von Temperatur und Typ des Peroxids[38] lässt sich die Polymerisationsrate einstellen.
Es konnten wenige peroxidische Wirkstoffe hergestellt werden. Zu ihnen gehören beispielsweise Artesunat und Artemisinin. Ihre Wirkungsweise basiert auf der Bildung von Radikalen an gewünschten Stellen im Organismus.
Auf Grund der explosiven Wirkung vieler Peroxide wurden auch Initialsprengstoffe auf Peroxidbasis entwickelt und eingesetzt. Zu den bekanntesten hiervon zählen Acetonperoxid (APEX) und Hexamethylentriperoxiddiamin (HMTD).
Nachweis
[Bearbeiten | Quelltext bearbeiten]Zur qualitativen und quantitativen Bestimmung von Peroxiden sind viele Analysemethoden in der Literatur beschrieben.[39] Als einfacher qualitativer Nachweis für Peroxide gilt die Iod-Stärke-Reaktion.[40] Hierbei oxidieren anwesende Peroxide, Hydroperoxide oder Persäuren das zugesetzte Kaliumiodid zu Iod, welches in Anwesenheit von Stärke tiefblaue Einlagerungskomplexe bildet. Diese Methode eignet sich auch zur quantitativen Bestimmung, unterscheidet jedoch nicht zwischen den verschiedenen Arten peroxidischer Verbindungen. Zur Unterscheidung zwischen Peroxiden und Persäuren kann die Entfärbung einer Indigolösung untersucht werden, die bei Anwesenheit von Persäuren sofort eintritt.[41] Die Blaufärbung, die bei Anwesenheit von Peroxiden mit Leuko-Methylenblau auftritt, ist hingegen spezifisch für Peroxide.[42] Im Handel sind Iod-Stärke-Papiere erhältlich, die als schneller Indikator auf die Anwesenheit von Peroxiden verwendet werden können.
Zur quantitativen Bestimmung von Hydroperoxiden eignet sich die potentiometrische Titration mit Lithiumaluminiumhydrid.[43] Eine Möglichkeit, den Gehalt an Persäuren und Peroxiden quantitativ zu bestimmen, ist die volumetrische Titration mit Alkoholaten wie Natriumethanolat.[44]
Sicherheitsmaßnahmen
[Bearbeiten | Quelltext bearbeiten]Peroxide sind labile Verbindungen und können besonders in höheren Konzentrationen und bei erhöhter Temperatur explosives Verhalten zeigen. Des Weiteren sind sie brandfördernd und können mit oxidierbaren Stoffen (auch Watte und Zellstoff) unter Feuerentwicklung reagieren.[45] Aus diesem Grund sind bei Arbeiten mit Peroxiden eine Reihe von Sicherheitsmaßnahmen zu beachten:
- Die Zersetzung von Peroxiden unter Bildung von Radikalen wird durch erhöhte Temperatur und Lichteinfall begünstigt. Peroxidische Verbindungen sollten aus diesem Grund kühl in lichtundurchlässigen Gefäßen aufbewahrt werden.
- Substanzen, die zur Bildung von Peroxiden durch Autooxidation neigen, beispielsweise Diethylether oder Tetrahydrofuran (THF), sollten in dunklen oder lichtundurchlässigen Flaschen über Natriumhydroxid aufbewahrt werden.
- Bei Verdacht auf Anwesenheit von Peroxiden sollte vor dem Erhitzen oder Einengen einer Reaktionslösung auf die Anwesenheit von Peroxiden geprüft werden.
- Geringe Mengen an Peroxiden, die aus Aufbewahrungs- oder Reaktionsgefäßen austreten, sollten durch Versatz mit Reduktionsmitteln wie Eisen(II)-sulfat vernichtet werden. Erst dann kann die Verunreinigung gefahrlos mit Papier aufgenommen werden.
Die sichere industrielle Handhabung von Peroxiden erfordert umfangreiche Sicherheitsmaßnahmen. Organische Peroxide werden industriell in Zellenbauten hergestellt (Explosionsschutz). Der apparative Aufbau befindet sich meist in Betonzellen mit Folienfenstern zur Druckentlastung bei etwaiger Explosion. Weitere Sicherheitsmaßnahmen sind mit Wasser gefüllte Gräben vor den Produktionszellen, die mit der Reaktionslösung im Falle von thermischem Durchgehen geflutet werden können. Nach der Herstellung und Abfüllung in Kleingebinde müssen peroxidische Verbindungen zügig in gekühlte Lager verbracht werden.
Ausführliche Unfallverhütungsvorschriften sind im Rahmen der berufsgenossenschaftlichen Vorschrift DGUV Vorschrift 13 verankert.[46]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Information und Liste von Stoffklassen, die zur Peroxidbildung neigen (PDF-Datei; 59 kB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu peroxides. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04510 – Version: 2.3.3.
- ↑ L. W. Gilbert (Hrsg.): Der tropfbar flüssige Sauerstoff, oder das oxygenierte Wasser, in: Ann. der Physik 1820, S. 3, Leipzig (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d H. Offermanns, G. Dittrich, N. Steiner: Wasserstoffperoxid in Umweltschutz und Synthese, in: Chemie in unserer Zeit 2000, 34, 150–159.
- ↑ Karrie-Ann Hughes Kubatko, Katheryn B. Helean, Alexandra Navrotsky, Peter C. Burns: Stability of Peroxide-Containing Uranyl Minerals. In: Science. 302, 2003, S. 1191–1193, doi:10.1126/science.1090259.
- ↑ G. Löffler, P. E. Petrides: Physiologische Chemie. 4. Auflage, S. 288, Springer, Berlin 1988, ISBN 3-540-18163-6.
- ↑ G. Löffler, P. E. Petrides: Physiologische Chemie. 4. Auflage, S. 321–322, Springer, Berlin 1988, ISBN 3-540-18163-6.
- ↑ Lehninger: Biochemie. 3. Auflage, S. 663–664, Springer, 2001, ISBN 3-540-41813-X.
- ↑ a b Lehninger: Biochemie. 3. Auflage, S. 932, Springer, 2001, ISBN 3-540-41813-X.
- ↑ M. Kröger: Chronik, in: Chemie in unserer Zeit 1989, 23, 34–35; doi:10.1002/ciuz.19890230106.
- ↑ H. Schildknecht, K. Holoubek: Die Bombardierkäfer und ihre Explosionschemie, in: Angew. Chem. 1961, 73, 1–7; doi:10.1002/ange.19610730102.
- ↑ Werner Nachtigall, A. Wisser: Biologisches Design, Springer-Verlag Berlin, 1. Auflage, 2005, ISBN 978-3-540-22789-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Helmholtz-Institut für Biochemische Pflanzenpathologie: Wie Pflanzen sich schützen ( vom 3. April 2008 im Internet Archive).
- ↑ A. Gossauer: Struktur und Reaktivität der Biomoleküle: Eine Einführung in die Organische Chemie, 1. Auflage, S. 306–307, Wiley-VCH/Helvetica Chimica Acta, 2006, ISBN 978-3-906390-29-1.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 504–509.
- ↑ a b c d e I. I. Vol'nov: Peroxides, Superoxides and Ozonides of Alkali and Alkaline Earth Metals, 1. Auflage, S. 21–51, Plenum Press, New York, 1966, keine ISBN.
- ↑ a b c d e f g A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 531–538.
- ↑ Jander, Blasius, Strähle: Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. 311–312, Hirzel Verlag, Stuttgart 1995, ISBN 978-3-7776-0672-9.
- ↑ E. H. Riesenfeld, B. Reinhold: Die Existenz echter Percarbonate und ihre Unterscheidung von Carbonaten mit Krystall-Wasserstoffsuperoxyd, in: Berichte Dtsch. Chem. Ges. 1909, 42, 4377–4383; doi:10.1002/cber.19090420428.
- ↑ S. Gambarjan: Diphenylamin und Acylperoxyde, in: Chem. Ber., 1909, 42, 4003–4013; doi:10.1002/cber.190904203164.
- ↑ Ullmann’s Encyclopedia of Industrial Chemistry, Bd. A 19, 5. Aufl., S. 177–197, VCH, Weinheim, 1991, ISBN 3-527-20138-6.
- ↑ Informationen über umweltverträgliche Produkte zur Sedimentoxidation und Phosphatbindung, FirmenschriftPDF-Datei
- ↑ S. S. Medwedew, E. N. Alexejewa: Organische Peroxyde, II. Mitteil.: Über die Reaktion zwischen Benzoyl-hydroperoxyd bzw. Benzoylperoxyd und Triphenyl-methyl, in: Chem. Ber. 1932, 65, 137–142; doi:10.1002/cber.19320650204.
- ↑ Patent du Pont de Nemours and Co. US 2357298, 1942.
- ↑ R. Criegee, G. Müller: 1,2-Dioxan, in: Chem. Ber. 1956, 89, 238–240; doi:10.1002/cber.19560890209.
- ↑ Autorenkollektiv: Organikum. 21. Auflage, S. 323, Wiley-VCH, 2001, ISBN 3-527-29985-8.
- ↑ a b c Autorenkollektiv: Organikum. 21. Auflage, S. 206–207, Wiley-VCH, 2001, ISBN 3-527-29985-8.
- ↑ R. Brückner: Reaktionsmechanismen. 3. Auflage, S. 41–42, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- ↑ A. P. Autor (Hrsg.): Pathology of Oxygen, 1. Auflage, S. 25–26, Academic Press, New York 1982, ISBN 0-12-068620-1.
- ↑ Georg Abel: Hagers Handbuch der pharmazeutischen Praxis. Springer DE, 1998, ISBN 3-540-52688-9, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Beyer-Walter: Lehrbuch der Organischen Chemie, 23. Auflage, S. 76–77, S. Hirzel Verlag, Stuttgart · Leipzig 1998. ISBN 3-7776-0808-4.
- ↑ K. P. C. Vollhardt und N. E. Schore: Organische Chemie 3. Auflage, S. 818–819, Wiley-VCH, 2000, ISBN 3-527-29819-3.
- ↑ J. Bülle, A. Hüttermann: Das Basiswissen der Organischen Chemie, 1. Auflage, S. 308–309, Wiley-VCH Weinheim, 2000, ISBN 978-3-527-30847-7.
- ↑ S. S. Block: Disinfection, Sterilization and Preservation, 5. Aufl., Lippincott, Williams & Wilki, Philadelphia, 2000, ISBN 978-0-683-30740-5.
- ↑ W. G. Frankenburg: Advances in Catalysis and Related Subjects, Band 2, 1. Auflage, S. 24–26, 1950, Academic Press, ISBN 978-0-12-007802-8.
- ↑ Z. W. Wicks, F. N. Jones, S. P. Pappas, D. A. Wicks: Organic Coatings, 3. Auflage, S. 17–26, 2007, Wiley, New York, ISBN 978-0-470-07906-5.
- ↑ H.–J. Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, 6. Auflage, S. 284–285, Wiley-VCH Weinheim, 2007, ISBN 978-3-527-31540-6.
- ↑ Thomas Brock, Michael Groteklaes, Peter Mischke – Lehrbuch der Lacktechnologie
- ↑ Fa. Pergan: Organische Peroxide für die Polymerisation ( vom 29. Juni 2016 im Internet Archive) (PDF; 2,1 MB).
- ↑ L. Légrádi, J. Lestyán: Nachweis von Peroxiden, Hydroperoxiden und Persäuren, in: Microchimica Acta 1970, 58, 119–122; doi:10.1007/BF01218105.
- ↑ C. H. Lea: The Effect of Light on the Oxidation of Fats, in: Proc. Royal Soc. London 1931, 108, 175–189; doi:10.1098/rspb.1931.0030.
- ↑ S. Veibel: Analytik organischer Verbindungen, 1. Auflage, Akademie-Verlag, Berlin, 1960, S. 262.
- ↑ M. I. Eiss, P. Gieseeke: Colorimetric Determination of Organic Peroxides, in: Anal. Chem. 1959, 31, 1558–1560; doi:10.1021/ac60153a038.
- ↑ T. Higuchi, D. A. Zuek: Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups1, in: J. Am. Chem. Soc. 1951, 73, 2676–2679; doi:10.1021/ja01150a073.
- ↑ A. J. Martin: Potentiometric Titration of Hydroperoxides and Peracids in Anhydrous Ethylenediamine, in: Anal. Chem. 1957, 29, 79–81; doi:10.1021/ac60121a022.
- ↑ Autorenkollektiv: Organikum. 21. Auflage, S. 741–762, Wiley-VCH, 2001, ISBN 3-527-29985-8.
- ↑ DGUV Vorschrift 13, Website der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 2. Dezember 2016.



















