Alanina
Alanina (Ala o A) es uno de los aminoácidos que forman las proteínas de los seres vivos. Es codificada por los codones GCU, GCC, GCA y GCG. Es el aminoácido más pequeño después de la glicina y se clasifica como hidrofóbico.
| Alanina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido 2-aminopropanoico | ||
| General | ||
| Símbolo químico | Ala, A | |
| Fórmula estructural |
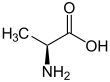 | |
| Fórmula molecular | C3H7NO2 | |
| Identificadores | ||
| Número CAS | 56-41-7[1] | |
| ChEBI | 57972 16977, 57972 | |
| ChEMBL | CHEMBL279597 | |
| ChemSpider | 5735 | |
| DrugBank | DB00160 | |
| PubChem | 5950 | |
| UNII | OF5P57N2ZX | |
| KEGG | C00041 D00012, C00041 | |
|
CC(N)C(O)=O
| ||
| Propiedades físicas | ||
| Densidad | 1424 kg/m³; 1,424 g/cm³ | |
| Masa molar | 8909 g/mol | |
| Punto de fusión | 531,15 K (258 °C) | |
| Propiedades químicas | ||
| Acidez | 2,33; 9,71 pKa | |
| Solubilidad en agua | 166,5 g/l | |
| Familia | Aminoácido | |
| Esencial | No | |
| Codón | GCU, GCC, GCA, GCG | |
| Punto isoeléctrico (pH) | 6,11 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La alanina es un aminoácido no esencial para el ser humano, pero es de gran importancia. Existe en dos distintos enantiómeros L-alanina y D-alanina. La L-alanina es uno de los 20 aminoácidos más ampliamente usados en biosíntesis de proteína, detrás de la leucina, encontrándose en un 7,8 % de las estructuras primarias, en una muestra de 1150 proteínas.[2] La D-alanina está en las paredes celulares bacteriales y en algunos péptidos antibióticos. Se encuentra tanto en el interior como en el exterior de las proteínas globulares.
Historia
editarLa alanina fue aislada por primera vez en 1850 por el químico alemán Adolph Strecker.[3][4] El nombre fue acuñado en alemán como alanina a partir del aldehído (con el infijo -an- para facilitar la pronunciación).[5]
Estructura
editarEl átomo de carbono α de la alanina está enlazado con un grupo metil (-CH3), siendo por tanto clasificada como un aminoácido alifático.
Biosíntesis
editarLa alanina es muy común por transferir su grupo amino al piruvato. Debido a las reacciones de transaminación a través de la enzima alanina transaminasa (EC 2.6.1.2), la cual es rápidamente reversible, la alanina puede fácilmente biosintetizarse del piruvato, por lo que está presente en los ciclos metabólicos de la glicólisis, gluconeogénesis, y en el ciclo del ácido cítrico.
Alternativamente, las bacterias obtienen alanina por descarboxilación del carbono 4 del aspartato, por acción de la enzima aspartato 4-descarboxilasa (EC 4.1.1.12), llevándose a cabo la siguiente reacción:
HOOC-CH2-CH(NH2)-COOH → CO2 + CH3-CH(NH2)-COOH
Síntesis
editarLa alanina racémica puede ser sintetizada por la condensación del acetaldehído con cloruro de amonio en la presencia de cianuro de sodio a través de una síntesis de Strecker, o por amonólisis del, ácido 2-bromopropiónico:[6]
Función
editarEl grupo metil de la alanina es muy poco reactivo, por lo que no es común verlo en la función proteica. Sin embargo, puede desempeñar un papel en el reconocimiento del sustrato o especificidad, particularmente en interacciones con otros átomos no reactivos como el carbono. Interviene en el metabolismo de la glucosa.
Fuentes de alanina
editarEn general, las proteínas de la carne de vacuno, cerdo, pescado, huevos y productos lácteos son ricas en alanina.
Referencias
editar- ↑ Número CAS
- ↑ Doolittle RF (1989). "Redundancias en secuencias de proteínas" en Predicción de estructuras proteicas y los principios de la conformación de proteínas'. (Fasman GD, ed.), pp 599-623, Plenum Press, New York.
- ↑ «alanine». Encyclopaedia Britannica Online. Consultado el 6 de diciembre de 2015.
- ↑ «Alanine».
- ↑ «alanine». Oxford Dictionaries. Archivado desde el original el 4 de marzo de 2016. Consultado el 6 de diciembre de 2015.
- ↑ (1929) "dl-Alanine". Org. Synth. 9: 4; Coll. Vol. 1: 21. .