Volatilidad Relativa
Volatilidad Relativa
Cargado por
Ana Milena Castañeda VillamarinCopyright:
Formatos disponibles
Volatilidad Relativa
Volatilidad Relativa
Cargado por
Ana Milena Castañeda VillamarinTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Volatilidad Relativa
Volatilidad Relativa
Cargado por
Ana Milena Castañeda VillamarinCopyright:
Formatos disponibles
La destilacin es probablemente el proceso de separacin y purificacin ms importante usado en la industria qumica, y son necesarios datos (ELV) confiables para
estimar el nmero de etapas tericas requeridas para una operacin dada. Es difcil, por no decir imposible repasar el tpico de ELV en una pequea cantidad de espacio. As mismo, es difcil discutir sobre destilacin sin conocer algo de las implicancias del ELV sobre el diseo. 2.1.1. Valores K y Volatilidad Relativa
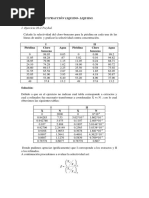
Fraccin molar del componente i en la fase vapor Fraccin molar del componente i en la fase liquida
Ki =
= yi/xi
(2.1)
El valor K es una medida de la tendencia del componente i a vaporizarse. Si el valor K es alto, el componente tiende a concentrarse en el vapor; si es bajo, tiende a concentrarse en el liquido. Si el valor K es la unidad, el componente se dividir igualmente entre el vapor y el liquido. El valor K es una funcin de la temperatura, presin y composicin. En el equilibrio, si se fijan dos de estas tres variables, se fija la tercera. Entonces el valor K puede considerarse como una funcin de la presin y composicin, o temperatura y composicin (o temperatura y presin) La volatilidad relativa de componentes i, j se define como:
ij =
Valor K del componente i Valor K del componente j
(2.2)
Convencionalmente, la volatilidad relativa es definida como la razn de los valores K del componente ms voltil al menos voltil, por lo cual la volatilidad relativa siempre ser mayor o igual a la unidad La destilacin es una tcnica de separar componentes de acuerdo a su volatilidad relativa, la cual es una medida de la facilidad de separacin y est dada por la razn entre la tendencia a vaporizar de dos componentes. Si la volatilidad relativa es alta, un componente tiene una tendencia mucho mayor a vaporizar (es ms voltil) que el otro, y ser fcil separarlos uno del otro mediante la vaporizacin de uno (destilacin). De otro lado cuando la tendencia a vaporizar de los componentes es similar, la volatilidad relativa se acercar a la unidad y ser difcil separar los componentes por destilacin. Si la volatilidad relativa es la unidad, cada componente es tan voltil como el otro, y no pueden separarse por destilacin Para un sistema binario, y2 = (1 y1) , (2.2) se tiene: x2 = (1 x1), adems de las Ec. (2.1) y
La Ec. (2.4) expresa la fraccin molar del componente ms voltil (CMV) en el vapor como una funcin de la fraccin molar del CMV en el liquido y la volatilidad relativa. Esta relacin se grafica en la Fig. 2.1 La Fig. 2.1a es una grfica llamada diagrama x y. Los ejes x e y muestran la concentracin del CMV en el liquido y en el vapor respectivamente. La diagonal de 45 representa puntos a los cuales las composiciones del vapor y el liquido son las mismas. La curva de la Fig. 2.1a es una relacin de equilibrio. La Fig. 2.1a muestra como el CMV se concentra en el vapor. Una mezcla liquida conteniendo una fraccin molar x1 de CMV (x1 = 0,45 en la Fig. 2.1a) est en equilibrio con un vapor conteniendo una fraccin molar y1 de CMV (y1 = 0,71 en Fig. 2.1a) si este vapor es recogido y condensado se obtiene una mezcla en la cual la fraccin molar de CMV se ha enriquecido de 0,45 a 0,71 La Fig. 2.1b ilustra el efecto de la volatilidad relativa sobre la tendencia del CMV para concentrarse en el vapor. Cuando la volatilidad es alta, el enriquecimiento es grande. Por ejemplo cuando la volatilidad relativa es 10, una mezcla liquida conteniendo una fraccin molar de 0,45 de CMV est en equilibrio con vapor conteniendo una fraccin molar de 0,88 de CMV; esto deber requerir solo unas cuantas etapas para convertir la mezcla liquida en componentes puros. Contrariamente, cuando la volatilidad relativa es muy baja tal como 1,1 una mezcla liquida conteniendo una fraccin molar de 0,45 del CMV est en equilibrio con vapor conteniendo una fraccin molar de 0,47 del CMV. Bajo estas condiciones, se necesita un nmero grande de etapas para separar la mezcla en los componentes puros.
Fig. 2.1 Concepto de volatilidad relativa. (a) concentracin del componente ms voltil CMV en el vapor. (b) efecto de la volatilidad relativa sobre la concentracin del CMV en el vapor 2.1.2. Sistemas Ideales y No ideales Un sistema ideal es aquel donde el vapor obedece la ley del gas ideal y el liquido obedece la ley de Raoult. Una mezcla ideal de gases obedece la ley de Dalton: pi = yiP (2.5)
Una solucin ideal obedece la ley de Raoult, la cual establece que la presin parcial de un componente en la solucin es igual al producto de su fraccin molar y la presin de vapor del componente puro, luego:
A partir de las Ecs. (2.5) y (2.6), y la definicin de los valores K, se obtiene
Para sistemas no ideales, la fugacidad del componente i en el vapor y en el liquido juegan el mismo rol que la presin parcial del componente en el vapor y la presin de vapor del componente en el liquido. La fugacidad puede ser considerada como una presin termodinmica. En el equilibrio, la fugacidad del vapor es igual a la fugacidad del liquido
La fugacidad del vapor puede definirse como una presin parcial corregida, dada por la ecuacin
Igualmente, la fugacidad del liquido puede definirse como una presin de vapor corregida, dada por
= Coeficiente de fugacidad del vapor. Explica el efecto de la no-idealidad del vapor sobre la fugacidad del mismo. Es usualmente estimado a partir de una ecuacin de estado y est basado en la temperatura, presin y fraccin molar del sistema. = Coeficiente de fugacidad del liquido. Explica el efecto de la no-idealidad del vapor sobre la fugacidad del liquido. Este coeficiente es estimado de manera similar al coeficiente de fugacidad del vapor, pero est basado en la temperatura del sistema y en la presin de vapor del componente puro. = Factor de correccin de Poyting. Explica el efecto de la presin sobre la fugacidad del liquido. Como es evaluado a la presin de vapor del componente puro, es usado para corregir la diferencia entre la presin de vapor del componente puro y la presin de la mezcla. Este efecto es pequeo y puede ser despreciado a bajas presiones, pero es importante a presiones altas.
i = Coeficiente de actividad del liquido. Corrige la fugacidad del liquido para los
efectos de composicin. Este valor depende de cuan similar sean los componentes. Para dos componentes similares, tal como una mezcla de i-butano y n-butano, el coeficiente de actividad del liquido es cercano a la unidad. Si los componentes son diferentes, el coeficiente de actividad se desva de la unidad. Combinando las Ecs. (2.1), (2.8), (2.9) y (2.10) se tiene:
CAMPBEL Muchas operaciones de produccin/procesamiento involucran el control de las fases presentes. Los componentes seleccionados deben ser vaporizados o condensados para alcanzar las metas especificadas. Para una composicin del fluido de mezcla dada la envolvente de fase define las regiones de vapor, liquido y dos fases. La determinacin de las curvas del punto de burbuja y de rocio fija el alcance de (la extensin de) la regin de dos fases. Esto ultimo implica el concepto de equilibrio. El equilibrio es la palabra utilizada para describir un estado en donde el paso de ms tiempo no tendr ningn efecto en el comportamiento del sistema. En un sistema de flujo la tasa es independiente del tiempo. En el contexto del comportamiento de fases, la composicin del vapor y el liquido en contacto permanecern constantes con el tiempo. Toma tiempo para que dos fases alcancen el equilibrio. En un sistema de Hc tpico se requiren muchos minutos de contacto. Ya que un separador bien diseado tendr un tiempo de contacto vapor-liquido de esta magnitus se asume normalmente que un separador debera ser calculado como un proceso de equilibrio. En los clculos de absorcin y fraccionamiento no existe un equilibrio verdadero ya que el vapor y el liquido no estan en contacto el tiempo suficiente para alcanzar esto. La suposicin de equilibrio (hecha por conveniencia) deberia ser corregida por un factor de eficiencia. El concepto de equilibrio en un sistema de dos fases no significa que el sistema es estatico. Existe aun una transferencia continua de molculas entre fases. La tasa de vaporizacin y condensacin de todas las especies moleculares es igual. por lo tanto, no se produce ningn cambio neto en la composicin. Es conveniente representar el equilibrio con una relacin de vaporizacin de equilibrio, K.
Graficas del valor K El valor K de cualquier componente depende de la presion, temperatura y la composicin del fluido total involucrado. Aplicaciones de los K valores Se requieren tres diferentes clculos para los clculos del comportamiento de fase vapor-liquido: 1) Un calculo del punto de burbuja para definir esta parte de la envolvete de fase 2) Un calculo del punto de rocio, para la para la parte de la envolvente que falta 3) Calculos flash en cualquier P y T dentro de la envolvente de fase Determinacion del punto de burbuja El punto de burbuja se puede definir como esa condicin en la cual el sistema es todo liquido con una (infinitesimalmente pequea) burbuja de vapor presente. La cantidad de vapor se especifica como una cuestin de conveniencia de modo que la composicin del liquido es esencialmente igual a la composicin del sistema total. Por definicin, la
suma de la fraccin molar de todos los componentes debe sumar la unidad tanto en vapor como en liquido.
Donde KiXi= K values times x the mol fraction for each component in the mixture. El procedimiento es como sigue para un sistema de composicion conocida: 1. Asumir una temperatura para la presion conocida (o asumir presion si la temperatura es conocida) 2. Encontrar Ki a la presion y temperatura conocida y asumida 3. Multiplicar Ki desde el paso 2 para el x correspondiente 4) Si la suma de valores de la etapa 3 es 1, usted asumi la presion y temperatura corecta. Si no de repite las etapas de la 1-3 hasta que la sumatoria sea 1. Determinacion del punto de rocio El punto de rocio esta definido como todo un sistema de vapor excepto por una pequea gota de liquido. En este caso, la composicin del sistema, zi, es igual que la del vapor, yi. Entonces:
También podría gustarte
- Balance de materia orientado a procesosDe EverandBalance de materia orientado a procesosAún no hay calificaciones
- Ejercicios Destilación MulticomponenteDocumento29 páginasEjercicios Destilación MulticomponenteUlises Ramírez Mathey100% (1)
- Primer Serie de ProblemasDocumento17 páginasPrimer Serie de ProblemasRuth Hueyopa100% (1)
- Tarea Reacciones P6Documento10 páginasTarea Reacciones P6Cristian Condori JaraAún no hay calificaciones
- Absorcion: Antonio Valiente Barderas 2010 Facultad de Química Unam, C.U. México D.FDocumento267 páginasAbsorcion: Antonio Valiente Barderas 2010 Facultad de Química Unam, C.U. México D.Fjose luis sosa lopez100% (2)
- Tarea 2 MezaDocumento10 páginasTarea 2 MezaJosé Luis100% (1)
- Resumen - Procesos de Separación Vapor LíquidoDocumento11 páginasResumen - Procesos de Separación Vapor LíquidoIris Bustamante Pájaro50% (2)
- McCabe 19.3docxDocumento4 páginasMcCabe 19.3docxMarioAún no hay calificaciones
- Trabajo de Ponchon Savarit y Macabe ThieleDocumento27 páginasTrabajo de Ponchon Savarit y Macabe ThieleErwin Viloria Ospino100% (3)
- Ejercicios Diagrama de ProcesoDocumento12 páginasEjercicios Diagrama de ProcesoMagda Veraza0% (1)
- Pts MotosierraDocumento9 páginasPts MotosierraAnonymous BFM6zwH50% (2)
- Manual Enraf 854 - Castellano PDFDocumento66 páginasManual Enraf 854 - Castellano PDFWilliams MedinaAún no hay calificaciones
- Flujo de fluidos e intercambio de calorDe EverandFlujo de fluidos e intercambio de calorCalificación: 1 de 5 estrellas1/5 (1)
- Calculo de Una Torre EmpaquetadaDocumento67 páginasCalculo de Una Torre Empaquetadasegundo vasquez100% (1)
- Destilacion MC CabeDocumento76 páginasDestilacion MC Cabemaria0% (2)
- Ejercicio ExtracciónDocumento3 páginasEjercicio ExtracciónLorena BarajasAún no hay calificaciones
- Tablas GeankoplisDocumento12 páginasTablas GeankoplisJosé López VelásquezAún no hay calificaciones
- Volatilidad RelativaDocumento2 páginasVolatilidad RelativaCelsa Núñez75% (4)
- Kremser EjercicioDocumento9 páginasKremser EjercicioAbril AlejandraAún no hay calificaciones
- Sistemas Ternarios - Datos de Equilibrio2Documento22 páginasSistemas Ternarios - Datos de Equilibrio2Annery Lee PowAún no hay calificaciones
- Cloruro de AliloDocumento11 páginasCloruro de AlilomiriamAún no hay calificaciones
- Parcial RXDocumento1 páginaParcial RXatahualpa martinez100% (1)
- Desti Laci OnDocumento45 páginasDesti Laci OnLalin Nw100% (1)
- Docsity Ejercicios 3 7 y 4 3 Treybal MasaDocumento7 páginasDocsity Ejercicios 3 7 y 4 3 Treybal MasaMariaAún no hay calificaciones
- Ejercicio MC Cabe ThieleDocumento13 páginasEjercicio MC Cabe ThieleLizbeth Rivera ValdovinosAún no hay calificaciones
- Ejemplo 9Documento17 páginasEjemplo 9MERYAún no hay calificaciones
- Sintesis IIDocumento4 páginasSintesis IIchicharo50% (2)
- Operaciones de SeparaciónDocumento33 páginasOperaciones de SeparaciónanaAún no hay calificaciones
- Extracción Sólido - LíquidoDocumento6 páginasExtracción Sólido - LíquidoLuis InciarteAún no hay calificaciones
- Heurísticas Del Diseño de ProcesosDocumento3 páginasHeurísticas Del Diseño de ProcesosAvenamar Méndez RodríguezAún no hay calificaciones
- Practica No 1 Propiedades Molares ParcialesDocumento11 páginasPractica No 1 Propiedades Molares ParcialesArturo Dominguez AdriaoAún no hay calificaciones
- 7.6 Problemas de CelestinoDocumento6 páginas7.6 Problemas de CelestinoCelestino Celestino Montalvo100% (2)
- Cuestionario Evaporacion Multiple 1Documento2 páginasCuestionario Evaporacion Multiple 1juan pablo macias leonAún no hay calificaciones
- Taller Economia Vanegas Rodriguez MateoDocumento16 páginasTaller Economia Vanegas Rodriguez MateoMateo VanegasAún no hay calificaciones
- Ejercicio Destilacion Rayleigh Sist. Benceno ToluenoDocumento10 páginasEjercicio Destilacion Rayleigh Sist. Benceno ToluenoJoseph Garcíe CAún no hay calificaciones
- Doble Efecto Lab IIIDocumento11 páginasDoble Efecto Lab IIIPatto Flores100% (2)
- Razón de Reflujo Total Mínimo Según El Método de McCabe-ThieleDocumento14 páginasRazón de Reflujo Total Mínimo Según El Método de McCabe-Thielejhon peralta abad100% (1)
- Problema Exm2 Plataformaresuelto 1Documento8 páginasProblema Exm2 Plataformaresuelto 1Jean Paul E Mendez Cota50% (2)
- Problema para Examen 2Documento11 páginasProblema para Examen 2Gaby HuamaniAún no hay calificaciones
- Reporte Torre EmpacadaDocumento17 páginasReporte Torre Empacada___ASCEAún no hay calificaciones
- Problema 2.1 Libro JimenezDocumento2 páginasProblema 2.1 Libro JimenezEmmanuel OsorioAún no hay calificaciones
- 10.3 Henley 1Documento2 páginas10.3 Henley 1Anonymous slHQIpo7Aún no hay calificaciones
- Marco Teorico Practica 4Documento9 páginasMarco Teorico Practica 4Osvaldo Cacha BritoAún no hay calificaciones
- Problemas Sieder LimpioDocumento12 páginasProblemas Sieder LimpioGerardo Mejia100% (1)
- Apuntes OP3-Esxtracción y HumidificaciónDocumento32 páginasApuntes OP3-Esxtracción y HumidificaciónbeatrizAún no hay calificaciones
- Bloque 2Documento11 páginasBloque 2keniaAún no hay calificaciones
- Guía Ejercicios Resueltos Reactores (2015) PDFDocumento40 páginasGuía Ejercicios Resueltos Reactores (2015) PDFSaraid FigueroaAún no hay calificaciones
- Problema 7.10 KERNDocumento6 páginasProblema 7.10 KERNJurgen Corpi Gómez100% (1)
- Reactor PFRDocumento9 páginasReactor PFRJeisonAún no hay calificaciones
- Practica Evaporador de Doble EfectoDocumento9 páginasPractica Evaporador de Doble EfectoNayeli BecerrilAún no hay calificaciones
- Extracción en Etapas MúltiplesDocumento6 páginasExtracción en Etapas MúltiplesJharol Quilo OrtegaAún no hay calificaciones
- Fabricacion de FenolDocumento14 páginasFabricacion de FenolEfraìn AnayaAún no hay calificaciones
- La Toma de Decisiones y La Adaptación en El Entorno-Pérez Vargas Nallely SheccidDocumento10 páginasLa Toma de Decisiones y La Adaptación en El Entorno-Pérez Vargas Nallely SheccidSheccid VargasAún no hay calificaciones
- Destilación - Ejercicios ResueltosDocumento39 páginasDestilación - Ejercicios Resueltosjavier gago100% (2)
- Problema para Producción de FormaldehídoDocumento3 páginasProblema para Producción de FormaldehídoJesús Francisco Vidaňa DuronAún no hay calificaciones
- Aplicacion de Reactores HeterogeneosDocumento6 páginasAplicacion de Reactores HeterogeneosGuadalupe HermenegildoAún no hay calificaciones
- Metodo Del Punto de PliegueDocumento4 páginasMetodo Del Punto de PliegueJonathan Anuar Ramos Diaz100% (1)
- Método FUG 2Documento2 páginasMétodo FUG 2Jose Antonio Romero BermudezAún no hay calificaciones
- Equilibrio de fases: Un enfoque basado en competenciasDe EverandEquilibrio de fases: Un enfoque basado en competenciasAún no hay calificaciones
- Destilación Binaria Con ExcelDocumento12 páginasDestilación Binaria Con Excelcarlostk16Aún no hay calificaciones
- Equilibrio Liquido-VaporDocumento10 páginasEquilibrio Liquido-VaporMiguelAún no hay calificaciones
- Practica 4Documento22 páginasPractica 4adrielAún no hay calificaciones
- Correlaciones de FlujoDocumento8 páginasCorrelaciones de FlujoAna Milena Castañeda VillamarinAún no hay calificaciones
- HIDRATOSDocumento7 páginasHIDRATOSAna Milena Castañeda VillamarinAún no hay calificaciones
- TrabajoDocumento19 páginasTrabajoAna Milena Castañeda VillamarinAún no hay calificaciones
- Correlaciones de Flujo MultifasicoDocumento40 páginasCorrelaciones de Flujo MultifasicoAna Milena Castañeda Villamarin100% (1)
- Diseño ReactorDocumento79 páginasDiseño ReactorAna Milena Castañeda VillamarinAún no hay calificaciones
- Mezcla Asfaltica Con Caña de AzucarDocumento80 páginasMezcla Asfaltica Con Caña de Azucaringmdtz_1Aún no hay calificaciones
- Alistamiento para Cobro Judicial - ADocumento1 páginaAlistamiento para Cobro Judicial - ACamilo PorrasAún no hay calificaciones
- Resumen Capitulo 6-7Documento4 páginasResumen Capitulo 6-7Sergio GuillénAún no hay calificaciones
- Calculo de Poste Electrico PDFDocumento36 páginasCalculo de Poste Electrico PDFReynerIvanSantiagoMendozaAún no hay calificaciones
- Actividad 9 GestionDocumento4 páginasActividad 9 GestionStefani AlmoraAún no hay calificaciones
- CAOLÍNDocumento17 páginasCAOLÍNalexis20Aún no hay calificaciones
- Termómetros y Escala de Temperatura CelsiusDocumento2 páginasTermómetros y Escala de Temperatura CelsiusTomas Gallegos VelaAún no hay calificaciones
- Proyecto de Transformador ReductorDocumento23 páginasProyecto de Transformador ReductorMathiasAún no hay calificaciones
- Carta HuarpeDocumento48 páginasCarta HuarpeAngelito GarcíaAún no hay calificaciones
- Ensayos No DestructivosDocumento6 páginasEnsayos No DestructivosJUAN PERES75% (4)
- Maquinaria para La Elaboracion de EmbutidosDocumento6 páginasMaquinaria para La Elaboracion de EmbutidosYAnethAún no hay calificaciones
- Ficha de Actualización de Información de Centros Escolares 2020Documento2 páginasFicha de Actualización de Información de Centros Escolares 2020Alfredo Erasmo RamosAún no hay calificaciones
- Servicios Tecnológicos Cristián Maqueira Rivas EirlDocumento4 páginasServicios Tecnológicos Cristián Maqueira Rivas EirlCristián Andrés Maqueira RivasAún no hay calificaciones
- 28 Agosto-1997 Bijker - Construcción Social de La Baquelita PDFDocumento27 páginas28 Agosto-1997 Bijker - Construcción Social de La Baquelita PDFSasha EspinosaAún no hay calificaciones
- Calculo Tamaño de Muestra - V2Documento4 páginasCalculo Tamaño de Muestra - V2Sdc SacAún no hay calificaciones
- Planeamiento EstocasticoDocumento9 páginasPlaneamiento EstocasticoRonald Juan Condori Laquita100% (1)
- Foro 2Documento1 páginaForo 2Jenny Milagros Palomino ContrerasAún no hay calificaciones
- Examen Historia de La Ciencia MédicaDocumento18 páginasExamen Historia de La Ciencia MédicaJesús Los ArcosAún no hay calificaciones
- S72ESDocumento20 páginasS72EScgavernetAún no hay calificaciones
- Plan de Trabajo #136-2023-Verificación - Ollusca (R)Documento4 páginasPlan de Trabajo #136-2023-Verificación - Ollusca (R)Ruger Antezana CuadrosAún no hay calificaciones
- Matematicas OriginalDocumento8 páginasMatematicas OriginalCarolinaAún no hay calificaciones
- Rehabilitacion Casa ComunalDocumento53 páginasRehabilitacion Casa Comunalyeizabetmireles100% (1)
- DISEÑO CONSTRUCCION Y MANTENIMIENTO DE PUENTES EGIfMDSDocumento8 páginasDISEÑO CONSTRUCCION Y MANTENIMIENTO DE PUENTES EGIfMDSRaul Cordova AlvaradoAún no hay calificaciones
- Tesis TextilDocumento102 páginasTesis TextilEnshell50% (2)
- UNIDAD II Combustibles Gaseosos PDFDocumento23 páginasUNIDAD II Combustibles Gaseosos PDFLuis Lisandro MayAún no hay calificaciones
- Alucobond - Product - Info - Es FACHADAS PDFDocumento27 páginasAlucobond - Product - Info - Es FACHADAS PDFReparacion De Pcs DeseretronicsAún no hay calificaciones
- Losa Colaborante - Steel DeckDocumento10 páginasLosa Colaborante - Steel DeckIsandrea SpositoAún no hay calificaciones