Semana 06 2017 I
Semana 06 2017 I
Cargado por
ANACopyright:
Formatos disponibles
Semana 06 2017 I
Semana 06 2017 I
Cargado por
ANADescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Semana 06 2017 I
Semana 06 2017 I
Cargado por
ANACopyright:
Formatos disponibles
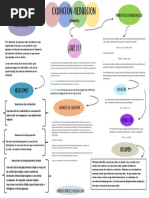
REACCIONES REDOX BALANCE DE REACCIONES En el producto las La forma oxidada: La forma reducida:
sustancias que se Fe3+ Cl-
Son cambios ocurridos por la transferencia de e- entre sustancias . es
oxidantes y reductoras. Son procesos Si Si
simultneos
OXIDACIN. El nmero de electrones ganados y perdidos son iguales
Fenmeno de prdida electrnica de un elemento, con aumento
algebraico en su (E.O). BALANCE DE REACCIONES
REDUCCIN. Proceso de igualar el nmero de tomos de cada elemento en ambos
lados de la reaccin (Ley de Conservacin de la Masa)
Fenmeno de ganancia electrnica de un elemento, con disminucin
algebraica en su (E:O). METODOS:
1. METODO DEL TANTEO: Consiste en tantear los coeficientes de la
TIPOS DE REACCIONES REDOX ecuacin y se realiza en ecuaciones sencillas. Se sigue el siguiente
orden
a
Oxidada Elemento Metal
No
H O
metal
reducida
Orden 1er. 2do. 3er. 4to.
2. METODO REDOX: Se basa en el cambio del estado de oxidacin
3 2 2 2 0(E.O) 4 2 algunos elementos. Es decir consiste en
que experimentan
Fe2 O3 + CO Fe + CO
determinar los elementos que se reducen y se oxidan.
Se asigna a todos
2 los elementos su estado de oxidacin
SeOxida
Ver quines ganan o pierden electrones, determine cuntos
electrones pierden o ganan
Se Reduce Luego se aslan a los elementos que han sufrido cambio en su
nmero de oxidacin; procediendo a balancear cada una de
ellos.
Reaccin redox intermolecular. El elemento que se oxida y el Se multiplican las semireacciones por ciertos nmeros enteros
elemento que se reduce se encuentran en sustancias diferentes.
apropiados, tal que el nmero de e- ganados y perdidos sean
iguales.
Completar la ecuacin por tanteo.
3. MTODO DEL ION ELECTRON: Es aplicable a la reaccin REDOX
donde el agente oxidante y reductor se encuentran en soluciones y
la reaccin se produce segn el medio en que se encuentran ya
sea: acido, bsico.
Se sigue los mismos pasos del mtodo Redox descritos
b Reaccin Redox intramolecular. El elemento que se oxida y
ele elemento que se reduce se encuentra en el mismo compuesto, anteriormente.
por lo tanto el agente oxidante y el agente reductor es la misma El balance de H y O se realiza segn el medio donde se
sustancia. efecta el proceso.
En Medio cido (H+)
5 2 1 0
KClO3 KCl + O2 Para balancear tonos de oxgeno, en el miembro donde falta
Se Oxida oxgenos se agrega una molcula de agua por cada tomo de
oxgeno que falte.
Se Reduce Para balancear tomos de hidrogeno. En el miembro donde
falta hidrgenos se agrega 1 iones H+ por cada hidrogeno que
falte.
En Medio Bsico o Alcalino (OH-)
Para balancear tonos de oxgeno, en el miembro donde falta
c Reacciones redox de dismutacin o desproporcin. Es oxgenos se agrega dos iones OH- por cada tomo de oxgeno
aquella donde un mismo elemento se oxida y se reduce. requerido y al otro lado de la misma agregar una molcula de
2 3 1/ 2 agua.
P2 H4 PH3 + P4 H2 Si en el sub paso anterior los hidrgenos no estn
Se Oxida balanceados, en el miembro donde falta hidrgenos se agrega
1 molcula de agua por cada hidrgeno requerido y en el otro
Se Reduce lado se agrega un in OH-. Luego se cancela las especies
qumicas idnticas.
Para asegurarse que la ecuacin est correctamente
balanceada tanto en masa como en carga se debe chequear de
que la suma de las cargas totales en ambos lados de la
ecuacin sean iguales.
PRACTICA
Cuadro Comparativo entre los procesos de Oxidacin y
Reduccin 1. Sobre las reacciones Redox, seale la alternativa correcta:
CARACTERSTICA a) El nmero total de electrones ganados en la oxidacin debe
OXIDACIN REDUCCIN ser igual al nmero de electrones perdidos en la reduccin.
S
Estado de Aumenta su E.O. Disminuye su E.O. b) La sustancia que pierde electrones se denomina agente
oxidante y la sustancia que gana se denomina agente
oxidacin
reductor.
Transferencia de Por prdida Por ganancia: c) La reduccin es un cambio qumico por lo cual el tomo o
electrones Fe0 Fe3++ 3e- Cl2 + 2e 2Cl- grupo de tomos gana electrones.
d) Los metales formando parte de molculas tiene E.O.
El reactante que Agente reductor: Agente oxidante: Cl2 negativos.
sufre Fe e) Todas las relaciones de descomposicin son Redox.
Lic. ROBERTO N. IRIGOIN SANCHEZ
2. La reduccin de un sustancia implica por lo tanto su 8. En la reaccin: Sn+2+2Fe+3Sn+4+2Fe+2. El agente reductor:
estado de oxidacin y en la Oxidacin por lo
que su estado de oxidacin .. a) Fe+2 b) Fe+3 c) Sn+2
d) Sn+4 e) Fe0
a) perdida de electrones - disminuye; gana electrones
aumenta 9. Determinar el coeficiente del oxgeno en la combustin
b) ganancia de electrones - disminuye; pierde electrones
disminuye C4H10 + O2 CO2 + H2O
c) perdida de electrones - aumenta ; gana electrones
disminuye a) 12 b) 15 c) 13 d) 35 e) 26
d) ganancia de electrones - aumenta; pierde electrones
no cambia 10. Luego de balancear la siguiente reaccin qumica, por mtodo
e) ganancia de electrones disminuye; pierde electrones - redox, indique verdadero (V) o falso (F) segn corresponda:
aumenta
3. Qu reacciones no son de reduccin oxidacin (REDOX)? HNO3 PbO NO PbO2 H 2O
I 2H2 + O2 2H2O
II Na2CO3 + 2HCl 2NaCl+ CO2 + H2O I. Se transfiere 6 electrones ( )
III CaCO3 CaO + CO2 II. El agente oxidante es HNO3 ( )
IV 2KClO3 2KCl + 3O2 III. El Pb02 es la forma reducida ( )
V N2 + 3H2 2NH3 IV. El coeficiente del agua es 2 ( )
a) I y II b) II y III c) I, III, IV y V a) VVFF b) FVFF c) VVVF d) FVFV e) FFFV
d) IV, V e) II y IV
11. Balancear la siguiente ecuacin qumica:
4. Cuntas de las siguientes semirreacciones son de reduccin y
cuntas de oxidacin? (en ese orden): NaClO + AgNO3 NaNO3 + AgClO3 + AgCl
( ) Bi Bi+3 Determinar la relacin E: E= Suma total de
( ) P4 P+5 coeficientes/Coeficiente forma reducida
( ) Zn+2 Zn
( ) SO3-2 SO4-2 a) 3 b) 6 c) 8 d) 12 e) 24
( ) Cl -1 Cl2
( ) NO3- NH3 12. Despus de balancear la siguiente ecuacin:
a) 3, 3 b) 1, 5 c) 4, 2 d) 2, 4 e) 6, 0
I2 + HNO3 HIO3 + NO2 + H2O
5. La semireaccin: SO4-2 S8 es una ____________ y en ella se
transfieren ___________ electrones.
S
a) Reduccin, 24 b) Oxidacin, 30 c) Reduccin, 48
Calcule el valor de E = ; en donde S corresponde a la
d) Reduccin, 92 e) Oxidacin, 48
suma de los coeficientes de los productos.
6. Clasificar a las siguientes reacciones segn el tipo de reacciones
a) 4 b) 6 c) 3 d) 1 e) 2
Redox
13. Luego de balancear la siguiente ecuacin qumica por el
I. HNO3 + l2 HlO3 + NO+ H2O
mtodo redox, indicar verdadero ( V ) o falso ( F ) segn
corresponda:
II. H2PO3 H3PO4 + PH3
K2SO3 + KI + HC KC + S + I2 + H2O
III. CH4 + O2 CO2 + H2O
( ) El agente oxidante es K2SO3
IV. (NH4)2 Cr2O7 N2 + Cr2O3 +
( ) La forma reducida es I2
H2O
( ) El coeficiente del reductor es 4
( ) El coeficiente del HC es 5
a) Intermolecular Intramolecular Dismutacin
Intermolecular
a) VVFF b) FVFV c) FFFV
b) Intramolecular Dismutacin Intermolecular -
d) VFVF e) VFFF
Intramolecular
c) Intermolecular Desproporcin Intermolecular -
14. Hallar la suma de los coeficientes de las sustancias reactantes
Intramolecular
y de los productos respectivamente al balancear:
d) Intramolecular Desproporcin Intramolecular
Intermolecular
LiMnO4 + LiCl + H2TeO4 MnTeO4 + Li2TeO4 + Cl2+ H2O
e) Intermolecular Dismutacin Intermolecular
Desproporcin
a) 20 y 20 b) 21 y 21 c) 21 y 20
d) 20 y 21 e) 18 y 21
7. La siguiente reaccin redox: HNO 2 HNO3 + NO ;
15. Al balancear la siguiente ecuacin redox Cul es la sumatoria
pertenece al tipo de reaccin:
de sus coeficientes?
a) Intermolecular b) Intramolecular c) De
K2Cr2O7 + C2H6O + H2SO4 Cr2(SO4)3 + K2SO4 + C2H4O + H2O
dismutacin
d) De adicin e) Exotrmica
a) 22 b) 18 c) 21 d) 20 e) 19
Lic. ROBERTO N. IRIGOIN SANCHEZ
Despus balancear la ecuacin determine el valor de Q:
16. Indique la suma de los coeficientes de los productos:
Q=AB+CD /E Siendo:
Zn + NaNO3 + NaOH Na2ZnO2 + NH3 + H2O A= Coeficiente del agente reductor
B= Coeficiente del agente oxidante.
a) 3 b) 5 c) 7 d) 8 e) 10 C= Coeficiente de la especie reducida
D= Coeficiente del agua.
17. Indique la suma de los coeficientes de los reactantes. E= Coeficiente de los iones hidronio.
KMnO4 + H2SO4 + H2O2 MnSO4 + O2 + K2SO4 + H2O a) 8/3 b) 7/6 c) 1/8 d) 2/5 e) 3/7
a) 4 b) 7 c) 12 d) 10 e) 15 25. Indique la suma de los coeficientes estequiomtricos, luego de
balancear la siguiente ecuacin redox en medio bsico:
18. Para la reaccin qumica:
Sb4 SbH3 + H2SbO2-
Na2C2O4 + KMnO4 +H2SO4K2SO4+ Na2SO4+H2O + MnSO4 +CO2 a) 11 b) 10 c) 9 d) 12 e) 13
La alternativa incorrecta despus de balancear es:
26. Cuantas moles de OH- son necesarias por cada 5 mol de
a) El aceite de vitriolo tiene igual coeficiente que agente oxidante
el agua
+ Cr2 O2
b) La suma de todos los coeficientes es 41 +3
c) Los coeficientes del agente oxidante y del 7 Cr + Br 2
d)
agente reductor suman 7
Se transfieren 10 electrones
Br
e) El producto de los coeficientes de las especies
oxidada y reducida es 24
a) 50 b) 60 c) 70 d) 80 e) 90
19. En la reaccin:
27. Balancee la siguiente ecuacin qumica en medio cido e
indique el coeficiente del agua y del agente oxidante.
MnO 2 PbO 2 HNO 3 Pb(NO 3 ) 2 HMnO 4 H 2 O
C2O42- + MnO4- CO2 + Mn2+
La opcin incorrecta es:
a) 4 y 5 b) 8 y 2 c) 6 y 5
d) 10 y 2 e) 5 y 8
a) El coeficiente del agente reductor es 2
b) El coeficiente de la especie oxidada es 2
28. Balancear en medio alcalino la siguiente ecuacin inica e
c) El coeficiente de la especie reducida es 3
indique la suma de coeficientes de los reactantes
d) El coeficiente del agente oxidante es 3
e) El coeficiente del agua es 3
CoC2 + CO Co(OH)3 + C
20. El coeficiente de la sustancia que se oxida al balancear la
reaccin es: a) 5 b) 10 c) 8 d) 12 e) 3
C 12 H 22 O 11 H 2 SO 4 CO 2 SO 2 H 2 O 29. Dada la reaccin qumica en medio cido:
BiO3 + Mn2 Bi3 + MnO4
a) 1 b) 24 c) 12 d) 35 e) 2
21. Luego de balancear la ecuacin indicada, da la suma de los
coeficientes y seala el agente oxidante Cul de las siguientes proposiciones es falsa?
Cu + HNO3 Cu(NO3)2 + NO + H2O Los coeficientes de los reactantes suman 21
Los coeficientes de lo productos suman 14
a) 20, HNO3 b) 12, Cu c) 15, NO El agua tiene coeficiente 7
d) 18, HNO3 e) 7, Cu BiO3
22. Balancee el siguiente proceso xido-reduccin y dar la relacin 5 moles del radical requiere de 16 iones
molar agente oxidante/agente reductor: hidronio
El agente oxidante tiene coeficiente 5
As2S3 + HNO3 H3AsO4 + SO2 + NO2 + H2O
30. Balancee en medio bsico:
a) 20 b) 18 c) 22 d) 24 e) 26
N2H4(ac) + Cu(OH)2(s) N2(g) + Cu(s
23. Al balancear en medio cido: De cmo respuesta la relacin molar oxidante/reductor
I NO IO NO ; 1 1 1 2 2
2 3 3 2
el coeficiente del agua es:
4 2 1 2 1
a) b) c) d) e)
a) 12 b) 10 c) 8 d) 6 e) 4
31. Balancear la siguiente ecuacin redox por el mtodo ion
24. La reaccin que se seala, se desarrolla en medio acido: electrn en medio bsico e indique el coeficiente del agua
Zn + As203 AsH3 + Zn+2
Lic. ROBERTO N. IRIGOIN SANCHEZ
Br2 BrO3- + Br
S2O3-2 + ClO-1 SO4-2 + Cl-1 y determinar la relacin de
a) 3 b) 6 c) 9 d) 10 e) 12 sus coeficientes en:
32. Balancear la reaccin en medio cido y determinar el X = (Coef. agente oxidante + Coef. H 2O) / [3 Coef.(OH-1) +
coeficiente del H+1 Coef. Forma reducida]
2 a) 0,5 b) 0,25 c) 5 d) 2 e) 1,5
Cr2O7 + I Cr3 + I 2
35. Balancear la siguiente ecuacin en medio bsico, e indicar la
proposicin incorrecta:
a) 10 b) 11 c) 12 d) 6 e) 14
HgS + NO-3 + C- HgC4-2 + SO4-2 + NO
33. Balancear la ecuacin y determinar la suma de coeficientes de
la ecuacin en medio cido. a) Se transfieren 24 moles de electrones.
b) El reductor tiene coeficiente 3.
IO 3-1 + I-1 I2 c) La forma oxidada es SO4-2.
a) 16 b) 20 c) 18 d) 12 d) El coeficiente del in cloruro es 4.
e) 10 e) La sumatoria de coeficientes de los productos es 22.
34. Balancear la siguiente reaccin en medio bsico:
Lic. ROBERTO N. IRIGOIN SANCHEZ
También podría gustarte
- Variedades de Papa en El PerúDocumento3 páginasVariedades de Papa en El PerúANA50% (2)
- Reacciones Redox Balance de PDFDocumento7 páginasReacciones Redox Balance de PDFLuis Marco Dávila GuzmánAún no hay calificaciones
- Redox - Poster PDFDocumento2 páginasRedox - Poster PDFVictoria Vizcaíno GarcíaAún no hay calificaciones
- Ejercicios Tipos de Reacciones QuímicasDocumento4 páginasEjercicios Tipos de Reacciones QuímicasJOSE ENRIQUE AGUILAR VALDIVIAAún no hay calificaciones
- Resumen Reacciones Redox IDocumento3 páginasResumen Reacciones Redox Irocrosdu100% (1)
- 7K - Sem 11 - Química - PRDocumento4 páginas7K - Sem 11 - Química - PRJeshu YTAún no hay calificaciones
- Práctica de Reacción Redox 04 - 05 - 15Documento4 páginasPráctica de Reacción Redox 04 - 05 - 15Jhony Becerra SanchezAún no hay calificaciones
- REDOXDocumento11 páginasREDOXYailen LlantoAún no hay calificaciones
- Clase 26. Diapositivas - Igualación Ecuaciones REDOXDocumento20 páginasClase 26. Diapositivas - Igualación Ecuaciones REDOXcristianAún no hay calificaciones
- Igualacion Redox-TanteoDocumento13 páginasIgualacion Redox-TanteoMarizol SajamaAún no hay calificaciones
- REDOXDocumento2 páginasREDOXMariel Ángeles Cruz MirandaAún no hay calificaciones
- Diagrama Redox-Cholula Mayorga Héctor TonatiuhDocumento3 páginasDiagrama Redox-Cholula Mayorga Héctor Tonatiuhangelriosvazquez08Aún no hay calificaciones
- Semana 5Documento5 páginasSemana 5waleska MoralesAún no hay calificaciones
- 13 Balance de Ecuaciones REDOXDocumento4 páginas13 Balance de Ecuaciones REDOXlucianamiaticaAún no hay calificaciones
- Balanceo RedoxDocumento1 páginaBalanceo RedoxLuis Angel Galicia100% (1)
- REDOXDocumento1 páginaREDOXPaulina Garrido BenitezAún no hay calificaciones
- REDOX-Sagrero Tiznado Rosa ZuleykaDocumento1 páginaREDOX-Sagrero Tiznado Rosa Zuleykaangelriosvazquez08Aún no hay calificaciones
- Resumen Tema REDOXDocumento3 páginasResumen Tema REDOXPablo FerrisAún no hay calificaciones
- Qui Elec III M Unidad 1 III Ab DF Clase Semana 1 y 2 2020Documento19 páginasQui Elec III M Unidad 1 III Ab DF Clase Semana 1 y 2 2020Cynthia AlvaradoAún no hay calificaciones
- Balanceo Ion ElectronDocumento4 páginasBalanceo Ion ElectronJoelAnguianoAún no hay calificaciones
- Guia de Repaso de 2 BguDocumento19 páginasGuia de Repaso de 2 BgucarteAún no hay calificaciones
- La Magia Del Redox - DannaTolosa - 1006Documento7 páginasLa Magia Del Redox - DannaTolosa - 1006angelAún no hay calificaciones
- Oxidacion - ReduccionDocumento13 páginasOxidacion - Reduccionjose luis moncayoAún no hay calificaciones
- Vdocuments - MX Guia de Quimica II Resuelta para Examen Extraordinario Ipn Nivel Medio SuperiorDocumento12 páginasVdocuments - MX Guia de Quimica II Resuelta para Examen Extraordinario Ipn Nivel Medio SuperiorMaria MedinaAún no hay calificaciones
- Taller de Balanceo Por Óxido-ReducciónDocumento1 páginaTaller de Balanceo Por Óxido-ReducciónDiego Fernando Ardila ArizaAún no hay calificaciones
- PH en La AgriculturaDocumento10 páginasPH en La AgriculturaVictor ManuelitoAún no hay calificaciones
- Clase 09 Reacciones Óxido-Reducción I PDFDocumento19 páginasClase 09 Reacciones Óxido-Reducción I PDFJustin JohnsonAún no hay calificaciones
- BALANCEODocumento5 páginasBALANCEOEddy PaceñitoAún no hay calificaciones
- Redox Q6NDocumento32 páginasRedox Q6NemilcegarciaAún no hay calificaciones
- Reacciones RedoxDocumento4 páginasReacciones RedoxivanfalleauAún no hay calificaciones
- TEMA 13 - Equilibrios y Volumetrias Redox - Moles (Imprimir)Documento9 páginasTEMA 13 - Equilibrios y Volumetrias Redox - Moles (Imprimir)Alexandra MarkovichAún no hay calificaciones
- Análisis Químico E Instrumental: Semana 06Documento21 páginasAnálisis Químico E Instrumental: Semana 06Genaro HuarcayaAún no hay calificaciones
- Guia de Aprendizaje. - Segundo de BachilleratoDocumento7 páginasGuia de Aprendizaje. - Segundo de BachilleratoRoque EStradaAún no hay calificaciones
- 21balance RedoxDocumento48 páginas21balance RedoxFabricio Gonzalo Soria BernalesAún no hay calificaciones
- Quimica - Semana 4Documento6 páginasQuimica - Semana 4Wilson Uturunco Rafael100% (1)
- Mapa Conceptual Practica 11Documento1 páginaMapa Conceptual Practica 11Laura Valentina Rueda GarzonAún no hay calificaciones
- Presentación de PowerPointDocumento15 páginasPresentación de PowerPointKade CadeAún no hay calificaciones
- U1 S1 2.reacciones Quimicas REDOXDocumento22 páginasU1 S1 2.reacciones Quimicas REDOXGIANCARLO ALANIZAún no hay calificaciones
- Soporte de Reacciones Químicas 2° Cuatrimestre - NormalDocumento11 páginasSoporte de Reacciones Químicas 2° Cuatrimestre - Normalantomza1661Aún no hay calificaciones
- Informe Ii Reacciones RedoxDocumento37 páginasInforme Ii Reacciones RedoxAbrahan CabrilesAún no hay calificaciones
- Guia 14 Quimica DecimoDocumento4 páginasGuia 14 Quimica DecimoCamilo FuentesAún no hay calificaciones
- Mapa RedoxDocumento1 páginaMapa RedoxDavid CastiblancoAún no hay calificaciones
- Clase 2 RedoxDocumento5 páginasClase 2 RedoxFernando Clemente GarciaAún no hay calificaciones
- Método de Balanceo Ecuaciones - REDOXDocumento2 páginasMétodo de Balanceo Ecuaciones - REDOXDENNYS MARIN LOPEZAún no hay calificaciones
- Diapositivas Redox Primera ParteDocumento25 páginasDiapositivas Redox Primera ParteSol PolitanoAún no hay calificaciones
- Apuntes Del Tema 5 (Reacciones de Transferencia de Electrones)Documento10 páginasApuntes Del Tema 5 (Reacciones de Transferencia de Electrones)Rafa VilchezAún no hay calificaciones
- Reacciones RedoxDocumento16 páginasReacciones RedoxRosales Jorge RaúlAún no hay calificaciones
- Regla para Tanteo y Redox y Número de Oxidación PDFDocumento6 páginasRegla para Tanteo y Redox y Número de Oxidación PDFWilliam Hancco JarataAún no hay calificaciones
- RedoxDocumento4 páginasRedoxCARLOS ANDRES CLAUSEN ALIAún no hay calificaciones
- Redox GANA O PERDIO HGG ABRIL 201Documento23 páginasRedox GANA O PERDIO HGG ABRIL 201Alb CruzAún no hay calificaciones
- REDOXDocumento12 páginasREDOXedgar3009Aún no hay calificaciones
- Formulación de Compuestos - 032055Documento10 páginasFormulación de Compuestos - 032055paulasantos191107Aún no hay calificaciones
- Relaciones Cuantitativas en Reacciones Redox PDFDocumento1 páginaRelaciones Cuantitativas en Reacciones Redox PDFYoel A UmañaAún no hay calificaciones
- Balanceo de EcuacionesDocumento8 páginasBalanceo de EcuacionesROMINA PADILLA MAMANIAún no hay calificaciones
- Guia 1 - Balanceo de Ecuaciones Por Tanteo y RedoxDocumento2 páginasGuia 1 - Balanceo de Ecuaciones Por Tanteo y RedoxJeisson GalvisAún no hay calificaciones
- Tema 6 REDOX 2022Documento26 páginasTema 6 REDOX 2022Claudia SimónAún no hay calificaciones
- Wuolah Free Reacciones Redox FormularioDocumento4 páginasWuolah Free Reacciones Redox FormularioFrases SadAún no hay calificaciones
- Reacciones RedoxDocumento23 páginasReacciones RedoxYesenia GarciaAún no hay calificaciones
- UnidadVIII Clase1Documento10 páginasUnidadVIII Clase1Maria Fernanda Ortiz AndradeAún no hay calificaciones
- 1 PBDocumento3 páginas1 PBANAAún no hay calificaciones
- Texto 2Documento2 páginasTexto 2ANAAún no hay calificaciones
- Actividades y Programas en LudotecasDocumento3 páginasActividades y Programas en LudotecasANAAún no hay calificaciones
- Acta #7.508Documento19 páginasActa #7.508Luis SajamaAún no hay calificaciones
- Principios Del TaylorismoDocumento12 páginasPrincipios Del TaylorismoRonny Silvester Tiul PerezAún no hay calificaciones
- Formato 1 - Formato de PonenciaDocumento10 páginasFormato 1 - Formato de Ponenciaenggi100% (1)
- Plan Operativo LocalDocumento3 páginasPlan Operativo LocalOscar Josue Rios ZeaAún no hay calificaciones
- Parcial Semana 4 2do IntentoDocumento11 páginasParcial Semana 4 2do IntentoMario Restrepo100% (2)
- La PropiedadDocumento26 páginasLa PropiedadDarwin RamosAún no hay calificaciones
- I Examen Resumen BiomedicaDocumento40 páginasI Examen Resumen BiomedicaSebastián BarrantesAún no hay calificaciones
- Evolución Mecánica de Los Instrumentos de Teclado y Desarrollo de Su Técnica de Ejecución TERMINADODocumento78 páginasEvolución Mecánica de Los Instrumentos de Teclado y Desarrollo de Su Técnica de Ejecución TERMINADOAraceli IratchetAún no hay calificaciones
- El Presente ContinuoDocumento3 páginasEl Presente ContinuoHugo AlonzoAún no hay calificaciones
- Proyecto Oficios y Profesiones de Mi ComunidadDocumento6 páginasProyecto Oficios y Profesiones de Mi ComunidadilianasvAún no hay calificaciones
- EJERCICIOS VARIANZA EstadisticaDocumento11 páginasEJERCICIOS VARIANZA EstadisticaCamilo BedoyaAún no hay calificaciones
- Tarea Semana 14 - Recursos Humanos La Selección de Candidatos (Util)Documento10 páginasTarea Semana 14 - Recursos Humanos La Selección de Candidatos (Util)Cesar R. Ore AcuñaAún no hay calificaciones
- DIA 2-2do EQUIVALENCIADocumento7 páginasDIA 2-2do EQUIVALENCIANahomi Martel CondezoAún no hay calificaciones
- Guzman 2Documento14 páginasGuzman 2Carlos A. Rivera0% (1)
- Conformados de La Religion o Transformados A Su PresenciaDocumento3 páginasConformados de La Religion o Transformados A Su Presenciaderame15Aún no hay calificaciones
- Laboratorio de QuímicaDocumento5 páginasLaboratorio de QuímicaMilytzel NuñezAún no hay calificaciones
- La Atraccion Del Abismo Rafael ArgullolDocumento3 páginasLa Atraccion Del Abismo Rafael ArgullolMaira EnriquezAún no hay calificaciones
- Normas CIRADocumento8 páginasNormas CIRAjuaki777Aún no hay calificaciones
- Analisis Toc TocDocumento2 páginasAnalisis Toc Tocsebastian jimenezAún no hay calificaciones
- Semana 06 2017 IDocumento4 páginasSemana 06 2017 IANAAún no hay calificaciones
- Guia Enseñar HistoriaDocumento59 páginasGuia Enseñar Historiaelenamohorade100% (4)
- El Párrafo - FinalDocumento41 páginasEl Párrafo - FinalAlonso Novoa HidalgoAún no hay calificaciones
- Mapa Mental Derechos HDocumento2 páginasMapa Mental Derechos Hmdnv5rmf7pAún no hay calificaciones
- Concurso Fotografico: Ciudad Cultura e IdentidadDocumento170 páginasConcurso Fotografico: Ciudad Cultura e IdentidadEscuela Técnica de Arquitectura Universidad San JorgeAún no hay calificaciones
- Sistema de Vigilancia EpidemiológicaDocumento8 páginasSistema de Vigilancia EpidemiológicaMuñekiithaPriinssAún no hay calificaciones
- Prueba 1 Lenguaje - Vocales y Comprensión de TextoDocumento7 páginasPrueba 1 Lenguaje - Vocales y Comprensión de TextoAna OrtizAún no hay calificaciones
- 122328043Documento131 páginas122328043Juan CarlosAún no hay calificaciones
- La Relación Del Antiguo Paso Del Cristo de La Vera-Cruz de Pilas y SevillaDocumento5 páginasLa Relación Del Antiguo Paso Del Cristo de La Vera-Cruz de Pilas y SevillaHdaddebelenAún no hay calificaciones
- 3er Grado Mayo - Inglés (2023-2024)Documento32 páginas3er Grado Mayo - Inglés (2023-2024)Dara Elisa Alvarez GarciaAún no hay calificaciones
- Filosofia de La Historia VoltaireDocumento330 páginasFilosofia de La Historia VoltaireNadieLe92% (13)