QUIMICA
QUIMICA
Cargado por
FA Jesús JesusCopyright:
Formatos disponibles
QUIMICA
QUIMICA
Cargado por
FA Jesús JesusDescripción original:
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
QUIMICA
QUIMICA
Cargado por
FA Jesús JesusCopyright:
Formatos disponibles
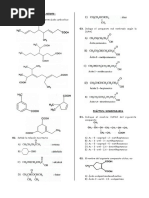
EJERCICIOS DE APLICACIÓN 2: a) 20 b) 31 c) 33
40
1. Los elementos 20Ca y 68Ba159 determinan con la d) 34 e) 35
media aritmética de sus Z, el Z de un nuevo
7. La suma del número de masa y número atómico de
elemento “x”; si el A está en relación 2/1 con el
un elemento es 180. Calcular el número de
número de protones de “x”. ¿Cuál es el número de
neutrones, sabiendo que en su cuarto nivel tiene 14
neutrones de “x”?.
electrones.
a) 35 b) 37 c) 38
a) 47 b) 68 c) 89
d) 42 e) N.A.
d) 56 e) 92
2. Cuántos electrones tiene un átomo en los
8. La suma de los números de neutrones de tres
subniveles “s”, si en su configuración electrónica
isótopos es 26, además sabemos que la suma de los
posee 8 orbitales “p” apareados. Dar la suma de
números de masa dividido entre 10,4 resulta 6, 25.
electrones de “s” y el total de electrones.
Hallar el número de electrones apareados de un
a) 39 b) 43 c) 42 isótopo.
d) 40 e) N.A. a) 12 b) 10 c) 6
3. Se tiene un átomo cuyo número de masa es 78 y su d) 25 e) 17
número de neutrones excede en 10 al número e
9. Si se sabe que el número de masa es 40 y que la
protones. ¿Cuántos electrones tiene el átomo en la
designación de su último electrón es n = 4; l = 0 ; m
cuarta capa?.
= 0; s = -1/2.
a) 2 b) 4 c) 6
Calcular el número de neutrones.
d) 8 e) 10
a) 18 b) 20 c) 36
4. De lo siguiente:
d) 23 e) 54
24 25 21 25 26
X; Y Z M B
12 16 ; 8 ; 12 ; 16 10. Si sabemos que los números cuánticos del último
electrón en llenarse tiene los siguientes posibles
(I) (II) (III) (IV) (V)
valores: n = 4 ; l = 2 ; m = - 1 ; s = +1/2. Hallar el
a) I y IV son isótipos total de orbitales apareados que tiene el átomo.
b) II y IV son hílidos a) 23 b) 19 c) 21
c) I y IV son isóbaros d) 28 e) 33
d) I y III son isótonos 11. Determinar la configuración electrónica (C.E.) del
elemento cobre (Z = 29) y predecir lo correcto:
e) II y V son isótopos
a) Termina en 3d9
5. Para el último electrón configurado de un átomo se
tiene: n = 3 ; l = 2 ; m = 0 ; s = -1/2. ¿Cuántos b) Es paramagnético
orbitales apareados tiene el átomo?.
c) Presenta 11 orbitales llenos
a) 10 b) 11 c) 13
d) Es diamagnético
d) 14 e) 15
e) En el último nivel existe 3 electrones.
6. El número de masa de un ión tripositivo es 57. Si en
su tercera capa presenta 3 orbitales desapareados
y 4 apareados; determinar su número de 12. Indique la alternativa en donde 4 números
neutrones. cuánticos estén bien escritos:
a) n = 1 , l = 0 , m = 1, s = 1/2 19. Si un elemento tiene en su cuarto nivel energético
10 electrones y su número de neutrones es el
b) n = 2 , l = 2, m = -1 , s = 1/2
número de protones mas el 10% de éste número.
c) n = 5, l = 0 , m = 5/2 , s = 1/2 Hallar el número de masa.
d) n = 3 , l = 2, m = -.3 , s = 1/2 a) 44 b) 80 c) 40
e) n = 4, l = 3, m = -3 , s = 1/2 d) 88 e) 84
13. Los números cuánticos del electrón ganado por el 20. Hallar el valor de “E” si E = D + Y donde:
cloro, para formar el ión Cl -1, son:
D = Número máximo de electrones de un átomo que
a) 2, 1, -1, +1/2 solamente posee 3 subniveles “p”.
b) 3, 1, +1 , -1/2 Y = Número mínimo de electrones de un átomo que
solamente posee 1 subnivel “difuso” lleno.
c) 3, -1, +3, -1/2
a) 77 b) 80 c) 68
d) 3, 0, +1 , -1/2
d) 78 e) N.A.
e) 3, -1, 0, +1/2
14. Un átomo que posee 33 electrones, sabiendo que n,
l, m, y s son los números cuánticos.
6 n l s
E
Hallar: m
a) 1 b) 2 c) 3
d) 4 e) 5
15. En cuál de los siguientes niveles existe mayor
energía.
a) P b) K c) M
d) Q e) L
16. Hallar el valor mínimo de electrones que tiene un
átomo si contiene 5 sub niveles “s”.
a) 31 b) 32 c) 35
d) 37 e) 39
17. Un átomo posee 47 electrones su configuración
electrónica termina en:
a) 5p4 b) 5s1 c) 4d10
d) 4d9 e) N.A.
18. ¿Cuál de las siguientes especies sería
paramagnética?.
+4
a) 22Tc b) 26Fe+2 c) 21Sc+3
d) 12Mg e) 12Mg+2
También podría gustarte
- Análisis de La Música de La Banda Sonora Película CocoDocumento1 páginaAnálisis de La Música de La Banda Sonora Película CocoFA Jesús JesusAún no hay calificaciones
- Álgebra - UNICIENCIAS PDFDocumento1056 páginasÁlgebra - UNICIENCIAS PDFHugoMontoro100% (4)
- SaamaDocumento158 páginasSaamaMariela Hernandez Armas100% (11)
- Configuracion ElectrónicaDocumento2 páginasConfiguracion ElectrónicaMichael Slater Ocaña PuiconAún no hay calificaciones
- Formato 2001 - I Pre Química (3) 15-09-00Documento2 páginasFormato 2001 - I Pre Química (3) 15-09-00Michael Slater Ocaña PuiconAún no hay calificaciones
- Repaso 4toDocumento2 páginasRepaso 4toEdson Luis Egusquiza Cordova0% (1)
- Estructura Atomica Ii - Quim Ejercicios de AplicacionDocumento3 páginasEstructura Atomica Ii - Quim Ejercicios de AplicacionZuriel Umiña Celis50% (2)
- Química Nube Electronica LunesDocumento2 páginasQuímica Nube Electronica LunesEdson Luis Egusquiza CordovaAún no hay calificaciones
- Estructura ElectrónicaDocumento2 páginasEstructura ElectrónicamaritzaAún no hay calificaciones
- Tipo de Nuclidos para Tercero de SecundariaDocumento1 páginaTipo de Nuclidos para Tercero de SecundariaLuis Alva MarquinaAún no hay calificaciones
- Practica Quimica Estrcutura AtomoDocumento2 páginasPractica Quimica Estrcutura AtomoSilvia Esmeralda Atoche MirandaAún no hay calificaciones
- ESTRUCTURA ATÓMICADocumento1 páginaESTRUCTURA ATÓMICAGabriela Santa María VeraAún no hay calificaciones
- NuclidosDocumento5 páginasNuclidoselvis pedrazaAún no hay calificaciones
- QuimicaDocumento2 páginasQuimicaMichael Slater Ocaña PuiconAún no hay calificaciones
- Taller Atomos en Clase-1-1-1Documento14 páginasTaller Atomos en Clase-1-1-1Camila Morales Cavagneri100% (1)
- Tarea Domiciliaria de Química: Tema: Átomo - IDocumento2 páginasTarea Domiciliaria de Química: Tema: Átomo - IEL PROFE KARLAún no hay calificaciones
- Academia Formato 2002 - I Química (04) 05-09-2001Documento2 páginasAcademia Formato 2002 - I Química (04) 05-09-2001Michael Slater Ocaña PuiconAún no hay calificaciones
- Examen Parcial 1 - Química - 4º Sec - BDocumento3 páginasExamen Parcial 1 - Química - 4º Sec - BNilton AlegriaAún no hay calificaciones
- Ejercicios de AplicaciónDocumento5 páginasEjercicios de Aplicaciónelvis pedrazaAún no hay calificaciones
- Academiasemestral Abril - Agosto 2002 - II Química (07) 30Documento2 páginasAcademiasemestral Abril - Agosto 2002 - II Química (07) 30Michael Slater Ocaña PuiconAún no hay calificaciones
- Q Delta 3Documento4 páginasQ Delta 3MIGUEL ANGEL SILVA RAMIREZAún no hay calificaciones
- Atomo MedicinaDocumento2 páginasAtomo MedicinaRoy J. YshtayAún no hay calificaciones
- QUIMICA Preguntas 15 06 24Documento2 páginasQUIMICA Preguntas 15 06 24cjimenezt.espgAún no hay calificaciones
- EL ÁTOMO Nuevos ProblemasDocumento3 páginasEL ÁTOMO Nuevos ProblemasSandra Atoche100% (1)
- Q Postulantes 3Documento4 páginasQ Postulantes 3MIGUEL ANGEL SILVA RAMIREZAún no hay calificaciones
- 2° Quimica Tema 1Documento2 páginas2° Quimica Tema 1Neyder AyalaAún no hay calificaciones
- Estructura Atómica IDocumento5 páginasEstructura Atómica IBenji Pineda CoronelAún no hay calificaciones
- PRACTICA mecánica cuántica y conf. electrónicaDocumento10 páginasPRACTICA mecánica cuántica y conf. electrónicajhaircasal2022Aún no hay calificaciones
- Semana 4 Química Marquitos 2Documento4 páginasSemana 4 Química Marquitos 2juniorcuellarjanampa965Aún no hay calificaciones
- Configuracion Elctronica3Documento2 páginasConfiguracion Elctronica3Michael Slater Ocaña PuiconAún no hay calificaciones
- SV-QU-EJ02 - ESTUDIO DEL ÁTOMO (Configuración Electrónica) - Prof Carolina AlmercoDocumento2 páginasSV-QU-EJ02 - ESTUDIO DEL ÁTOMO (Configuración Electrónica) - Prof Carolina AlmercoJorge Guarníz100% (1)
- Q Alfa 3Documento4 páginasQ Alfa 3MIGUEL ANGEL SILVA RAMIREZAún no hay calificaciones
- El AtomoDocumento2 páginasEl AtomoMARIAM ANTHUANET PLAZO GELDRESAún no hay calificaciones
- Atomo PODocumento3 páginasAtomo POFranklin Muñoz HilaresAún no hay calificaciones
- Semana 03-Estructura Atomica-Intermedio.Documento2 páginasSemana 03-Estructura Atomica-Intermedio.0502023018Aún no hay calificaciones
- SEMANA 03-ESTRUCTURA ATOMICA-INTERMEDIO. DesarrolloDocumento2 páginasSEMANA 03-ESTRUCTURA ATOMICA-INTERMEDIO. Desarrollojhon riscoAún no hay calificaciones
- Sem 02 4to 5toDocumento3 páginasSem 02 4to 5toRoy J. YshtayAún no hay calificaciones
- 2ccnn de Parcial2Documento3 páginas2ccnn de Parcial2IsaíasGermánRomeroQuicioAún no hay calificaciones
- 3a 10 RepasoDocumento1 página3a 10 RepasoARTURO ARUHUANCAAún no hay calificaciones
- Configuracion Electronica 5TODocumento3 páginasConfiguracion Electronica 5TOFreddy Cardenas HuaytaAún no hay calificaciones
- 3-Ce Pre Basico 2022Documento2 páginas3-Ce Pre Basico 2022William RMAún no hay calificaciones
- Semana 03Documento4 páginasSemana 03Fisher SuxeAún no hay calificaciones
- Atomo RaimondiDocumento3 páginasAtomo RaimondiRoy J. YshtayAún no hay calificaciones
- AtomoDocumento1 páginaAtomoKimberly Bermudo VenturaAún no hay calificaciones
- Miscelanea de Quimica 01Documento2 páginasMiscelanea de Quimica 01Billy Deybi Niño Morales100% (1)
- Ficha 04 Estructura Atomica 2022 3eroDocumento2 páginasFicha 04 Estructura Atomica 2022 3eroPaolo GuerreroAún no hay calificaciones
- Ejercicios 2Documento3 páginasEjercicios 2JUAN MIGUEL SORALUZ FIESTASAún no hay calificaciones
- Guia de Ejercicios 1Documento2 páginasGuia de Ejercicios 1Nallar Sepulveda HenriquezAún no hay calificaciones
- Guia 01 QuimicaDocumento3 páginasGuia 01 QuimicaFisher SuxeAún no hay calificaciones
- EXAMEN I BIMESTRE-4to QUÍMICADocumento1 páginaEXAMEN I BIMESTRE-4to QUÍMICAmalillanycortezfallaAún no hay calificaciones
- 3rapractica4toy5to 130209114619 Phpapp02Documento2 páginas3rapractica4toy5to 130209114619 Phpapp02Jans CabrejosAún no hay calificaciones
- Números Cuánticos y Configuración ElectrónicaDocumento3 páginasNúmeros Cuánticos y Configuración ElectrónicaFranzavaAún no hay calificaciones
- TEMA 2. QUÍMICA - Estructura AtómicaDocumento2 páginasTEMA 2. QUÍMICA - Estructura Atómicajeremy ortizAún no hay calificaciones
- Práctica Círculo de Avanzada Química2Documento2 páginasPráctica Círculo de Avanzada Química2Efraín José Ávila RojasAún no hay calificaciones
- Estructura Atomica IIDocumento3 páginasEstructura Atomica IIDueñas JmdAún no hay calificaciones
- Números Cuánticos y Conf. Electrónica - Semana 2Documento4 páginasNúmeros Cuánticos y Conf. Electrónica - Semana 2Yonathan Chávez De La CruzAún no hay calificaciones
- Semana N°03 QuímicaDocumento3 páginasSemana N°03 QuímicaSegundo FernandezAún no hay calificaciones
- Academia Intensivo 2002 - I Química (09) 23-01-2002Documento2 páginasAcademia Intensivo 2002 - I Química (09) 23-01-2002Michael Slater Ocaña PuiconAún no hay calificaciones
- C7Q04 - IDocumento14 páginasC7Q04 - IMarco Antonio Chuco MachacuayAún no hay calificaciones
- Configuración ElectrónicaDocumento2 páginasConfiguración ElectrónicaJosue Ramos MenendezAún no hay calificaciones
- Qui S2Documento7 páginasQui S2Walsen Helian Evangelista VidalAún no hay calificaciones
- Estructura Atomica EjerciciosDocumento1 páginaEstructura Atomica EjerciciosYuri Wilder Salazar TorresAún no hay calificaciones
- Razon Logic Mod 4 PDFDocumento2 páginasRazon Logic Mod 4 PDFFA Jesús JesusAún no hay calificaciones
- Karla Figueroa CastilloDocumento1 páginaKarla Figueroa CastilloFA Jesús JesusAún no hay calificaciones
- Semana #01 Teoria de Exponentes - Ecuaciones ExponencialesDocumento9 páginasSemana #01 Teoria de Exponentes - Ecuaciones ExponencialesFA Jesús Jesus100% (1)
- Informatica 3 AñosDocumento2 páginasInformatica 3 AñosFA Jesús JesusAún no hay calificaciones
- Aprendo Desde CasaDocumento4 páginasAprendo Desde CasaFA Jesús Jesus100% (1)
- Sem8 Razonamiento MatematicoDocumento2 páginasSem8 Razonamiento MatematicoFA Jesús JesusAún no hay calificaciones
- Areas Integradas Inicial 3 Años-1Documento2 páginasAreas Integradas Inicial 3 Años-1FA Jesús JesusAún no hay calificaciones
- Areas Integradas Inicial 3 Años-1 PDFDocumento2 páginasAreas Integradas Inicial 3 Años-1 PDFFA Jesús JesusAún no hay calificaciones
- Guia de SucesionesDocumento4 páginasGuia de SucesionesFA Jesús Jesus100% (1)
- AcidosDocumento5 páginasAcidosFA Jesús JesusAún no hay calificaciones
- Comunicación PasivaDocumento3 páginasComunicación PasivaFA Jesús JesusAún no hay calificaciones
- Sucesiones Ejercicios PracticosDocumento4 páginasSucesiones Ejercicios PracticosFA Jesús Jesus100% (1)
- Fisica ElementalDocumento4 páginasFisica ElementalFA Jesús JesusAún no hay calificaciones
- Prisma y ParalelepipedoDocumento3 páginasPrisma y ParalelepipedoFA Jesús JesusAún no hay calificaciones
- Promedio 2do de SecDocumento7 páginasPromedio 2do de SecFA Jesús JesusAún no hay calificaciones
- Fisica ElementalDocumento4 páginasFisica ElementalFA Jesús JesusAún no hay calificaciones
- Ejercicios de Configuración ElectronicaDocumento2 páginasEjercicios de Configuración ElectronicaKATHERINE LISSETTE MEDRANO ROJASAún no hay calificaciones
- TQ04-A02 Numeros CuánticosDocumento2 páginasTQ04-A02 Numeros Cuánticossagredo simplicioAún no hay calificaciones
- Química Inorgánica - Semana VDocumento4 páginasQuímica Inorgánica - Semana VWilman IshpilcoAún no hay calificaciones
- Devenir y OntologíaDocumento11 páginasDevenir y OntologíaVictor J HerreraAún no hay calificaciones
- ElectronegatividadDocumento3 páginasElectronegatividadLina Mosquera GuzmanAún no hay calificaciones
- Examen de Avance III de Quimica 2doDocumento4 páginasExamen de Avance III de Quimica 2doHéctor CanoAún no hay calificaciones
- 7 Modelos Atomicos y Cada Uno Con Su ImagenDocumento3 páginas7 Modelos Atomicos y Cada Uno Con Su ImagenNestor Exequiel100% (3)
- Resumen Modelo Atomico de BohrDocumento1 páginaResumen Modelo Atomico de BohrNaomi SevastianukAún no hay calificaciones
- F CAPRA Pensamiento SistémicoDocumento6 páginasF CAPRA Pensamiento SistémicoJuan Alberto Vivanco SuarezAún no hay calificaciones
- Sesion 8-Teoria CuanticaDocumento20 páginasSesion 8-Teoria CuanticaCristian Ccaso MamaniAún no hay calificaciones
- Guia 2 de Clase de Quimica 9 Grado 4pDocumento5 páginasGuia 2 de Clase de Quimica 9 Grado 4pYina GonzalezAún no hay calificaciones
- Física Cúantica - Tarea 4Documento9 páginasFísica Cúantica - Tarea 4geovannyAún no hay calificaciones
- Romero Sierra Roberto Josué, Unidad 2. Actividad 1. Entregable.Documento2 páginasRomero Sierra Roberto Josué, Unidad 2. Actividad 1. Entregable.roberto josue romero sierraAún no hay calificaciones
- Bateria CuanticaDocumento6 páginasBateria Cuanticakevin ramosAún no hay calificaciones
- Amit, Goswami - La Fisica Del AlmaDocumento332 páginasAmit, Goswami - La Fisica Del AlmaJoaquin Alberto Marquez MunozAún no hay calificaciones
- Historia de La LuzDocumento11 páginasHistoria de La LuzMiguel Canahuire MamaniAún no hay calificaciones
- Informe Constante de PlanckDocumento4 páginasInforme Constante de PlanckJairo PerezAún no hay calificaciones
- Formulacion Artesanal de La EstrategiaDocumento4 páginasFormulacion Artesanal de La EstrategiaJuanRafaelGomezAquinoAún no hay calificaciones
- Biocomunicacion y Medicina EnergeticaDocumento6 páginasBiocomunicacion y Medicina EnergeticaaozonicsAún no hay calificaciones
- Ejercicios Propiedades PeriodicasDocumento5 páginasEjercicios Propiedades PeriodicasPedro100% (2)
- CONOCEMOS A GRANDES CIENTÍFICOS Y SUS APORTES - PDDocumento8 páginasCONOCEMOS A GRANDES CIENTÍFICOS Y SUS APORTES - PDMoises MaZaAún no hay calificaciones
- Los Problemas Del MilenioDocumento6 páginasLos Problemas Del MilenioNel MachAún no hay calificaciones
- Formación de Orbitales Híbridos sp2 y sp3Documento5 páginasFormación de Orbitales Híbridos sp2 y sp3chachitunAún no hay calificaciones
- Equivalencia Entre Masa y EnergiaDocumento18 páginasEquivalencia Entre Masa y EnergiaCentro de Eventos EspacioAún no hay calificaciones
- GrafenoDocumento15 páginasGrafenoblancaAún no hay calificaciones
- Principales Teorías Atómicas.Documento5 páginasPrincipales Teorías Atómicas.brianadmz73% (11)
- Teoría BCSDocumento8 páginasTeoría BCSKevin Mauricio VelasquezAún no hay calificaciones
- Presentación Números CuánticosDocumento49 páginasPresentación Números CuánticosAlexis WongAún no hay calificaciones