Calorimetría-SECUNDARIA 2
Calorimetría-SECUNDARIA 2
Cargado por
ChristianHansVillanuevaZuloetaCopyright:
Formatos disponibles
Calorimetría-SECUNDARIA 2
Calorimetría-SECUNDARIA 2
Cargado por
ChristianHansVillanuevaZuloetaDerechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Calorimetría-SECUNDARIA 2
Calorimetría-SECUNDARIA 2
Cargado por
ChristianHansVillanuevaZuloetaCopyright:
Formatos disponibles
CALORIMETRÍA
En nuestra vida es muy común hablar de calor y de Propagación del calor
cambios de estado; generalmente relacionamos al A. Por conducción
calor en forma directa con la temperatura. El calor puede viajar dentro de un cuerpo o de
un cuerpo a otro por contacto, mediante el fenó-
meno de la agitación molecular, de una zona de
alta temperatura hacia otra de baja temperatura.
Esto se da principalmente en los sólidos, siendo
los metales los que mejor conducen el calor. Entre
los malos conductores de calor podemos citar: el
aire, la lana, la madera, el agua, etc.
B. Por convección
Debido a que una elevación de temperatura dis-
minuye la densidad, especialmente de líquidos
En el presente capítulo se estudian los aspectos y gases, entonces las masas calientes suben y las
físicos de un cuerpo cuando es sometido al calor. frías bajan, generándose movimientos cíclicos
De la misma manera desarrollaremos la teoría del que llamaremos convección. Este efecto se apre-
equilibrio térmico, en el cual se explica cómo se cia al hervir agua, y en la atmósfera es la causa de
obtiene una temperatura final luego de mezclar varios los vientos.
cuerpo a diferentes temperaturas.
C. Por radiación
Conceptos Previos Por experiencia sabemos que al acercarnos a una
Calor: fogata sentimos el calor que proviene del fuego;
Es una forma de energía que se transmite desde un algo similar sucede con el calor que nos llega des-
cuerpo de alta temperatura hacia un cuerpo de baja de el Sol cruzando el espacio vacío. Así, el calor
temperatura. puede viajar por radiación a través de ondas elec-
tromagnéticas y en el vacío.
T1 Escalas termométricas:
Así como para medir una unidad de longitud se utiliza
T2 > T1 el metro, de igual manera se procede en las temperaturas
y las unidades de medida mas utilizadas son: la escala
T2 Celsius, la escala Kelvin y la escala Fahrenheit.
◗ Escala Celsius (ºC)
Generalmente estamos acostumbrados a decir que
un cuerpo puede ganar o perder calor, lo cual es Esta escala anteriormente llamada centígrada, a
1 atm de presión el agua con hielo se encuentra
totalmente incorrecto, puestos el calor es energía en
0°C y el agua hirviendo a 100°C (temperatura de
tránsito y no acumulable.
ebullición).
Solo por fines prácticos mencionaremos que un
cuerpo ha ganado o perdido calor, si este a su vez ha ◗ Escala Kelvin (K)
ganado o perdido energía calorífica en forma de calor La escala absoluta de Kelvin es una escala cuyo
respectivamente. cero coincide con el cero absoluto (cuando las
moléculas de un cuerpo dejan de fluir teórica-
mente).
◗ Escala Fahrenheit (ºF) Las relaciones entre estas unidades son:
Aquí el agua se congela 32º F y hierve a 212º F. 1kg = 1000 g
Esta escala se usa menos.
°C K °F 1J = 0,24cal
100 373 212 1cal = 4,18J
0 273 32
–273 0 –460
La fórmula que sirve para hacer transformaciones es Capacidad calorífica de un cuerpo (C )
Es la cantidad de calor que gana o pierde un cuerpo
la siguiente:
por cada grado de variación en su temperatura:
Entre grados Celsius y Kelvin:
C=
T
K = ºC + 273
Entre grados Celsius y grados Fahrenheit: Además, se comprueba:
C = m.Ce
9 Donde:
ºF= º C + 32
m = masa Ce: Calor específico
En el sistema internacional (SI) la unidad de medida Equilibrio térmico (ley cero de la termodinámica)
de la temperatura es el kelvin(K). Supón que tenemos dos cuerpos con distinta
temperatura, uno en contacto con el otro, podría
Cantidad de calor (Q) comprobarse que el cuerpo más caliente se iría
Magnitud física escalar que nos mide cuanta energía enfriando, mientras que el cuerpo más frío se iría
calorífica ha ganado o perdido un cuerpo mediante el calentando, después de cierto tiempo (empleando el
calor producido. tacto) se notaría que los dos cuerpos alcanzan una
misma temperatura, esta situación final se denomina
T Q equilibrio térmico.
Graficando la mezcla de dos cuerpos líquidos a
diferentes temperaturas:
Q = Ce.m.T
T1 T2
Donde las magnitudes y sus respectivas unidades en
el SI son:
Q : Cantidad de calor (J)
m: Masa (kg)
T: Variación de la temperatura (K) = Tf – Ti
Ce: calor especifico (J/kg. K)
En el presente tema las unidades con que se va a Teq
trabajar son: Se cumple estrictamente:
Q: Cantidad de calor (caloria,cal) T1 < Teq < T2
m: Masa(g)
T: Variación de la temperatura (ºC)
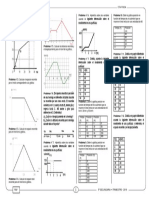
Para un mejor análisis del problema, definimos la Aplicando la ley de la conservación de la energía se
regla térmica, la cual es una forma de representar las cumple:
transferencias de calor mediante una recta de Qganado + Qperdido = 0
temperatura, colocando para ello el valor de las
temperaturas de los cuerpos presentes en una mezcla En general la suma de las cantidades de calor en una
y la temperatura de equilibrio. mezcla de «n» cuerpos, siempre debe ser igual a cero.
Por ejemplo, utilizando los datos de la última grafica Qganado + Qperdido = 0
de mezclas, se tiene:
A esta ecuación se le conoce como la ley cero de la
Qganado Qperdido termodinámica.
T1 Teq T2
Integral de calor. ¿Cuál será la temperatura de dicho blo-
1. ¿Cuánto calor (en cal) será necesario propor- que (en ºC), luego de ser calentado? (Considera
cionar a un trozo de hierro de 50 g para elevarlo que para la plata Ce = 0,6 cal/gºC)
su temperatura desde los 10º C hasta los 110ºC?
Considera que para el hierro Ce = 0,12 cal/gºC.
6. A cierto bloque de oro de 2 kg que se encuentra a
8º C se le calienta absorbiendo 240 calorías. ¿Cuál
será la temperatura (en ºC) de dicho bloque, lue-
2. ¿Cuánto calor (en cal) será necesario go de ser calentado? (Considere que para el oro
proporcionar a un trozo de aluminio de 100 g para Ce=0,03 cal/g°C).
elevar su temperatura desde los 10º C hasta los
60º C? (Considera que para el aluminio Ce = 0,3 7. A un cuerpo de 100 g y Ce = 0,5 cal/gºC se le en-
cal/gºC) trega 400 calorías: ¿En cuánto elevará su tempera-
tura en ºC ?
3. ¿Cuánto calor (en cal) será necesario proporcio-
nar a un trozo de cobre de 500 g para elevar su 8. Un bloque de aluminio a 120º C, se sumerge en
temperatura desde los 20º C hasta los 90º C (con- 900 g de agua a 10º C, si la temperatura de equi-
sidera que para el cobre Ce = 0,1 cal/gºC). librio es 20º C, calcula la masa del bloque de alu-
minio (en g)(Considere que para el aluminio Ce
4. Calcula la masa (en g) de un bloque de plomo, si = 0,9cal/gºC)
al ganar 200 cal aumentó su temperatura de 60º C
a 100º C. (Ce plomo = 0,25 cal/g°C).
5. A cierto bloque de plata de 0,5 kg que se encuen-
tra a 17º C se le calienta absorbiendo 600 calorías
9. Un bloque de aluminio a 80ºC, se sumerge en
180 g de agua a 60ºC, si la temperatura de equi-
librio es 20ºC, determina la masa del bloque de
aluminio (en g). (Considere que para el aluminio
Ce = 0,9 cal/gºC) 13. En un recipiente de capacidad calorífica despre-
ciable que contiene 100 g de agua a 20º C se vier-
10. En un recipiente térmicamente aislado que con- ten 500 g de agua a 80º C. Determina la tempera-
tiene 1,5 kg de agua a 20,0 ºC, se introduce un tura de equilibrio en ºC.
metal de 3,00 kg a 130º C. Si la temperatura de
equilibrio es de 40,0º C. ¿Cuál es el calor específi- 14. Un recipiente de aluminio (Ce = 0,22 Cal/gºC) de
co del metal? (Cagua = 1,00 cal/g°C) 0,5 kg contiene 110 g de agua a 20º C. Si se intro-
UNMSM 2009-II duce un bloque de fierro de 200 g cuyo Ce = 0,11
Cal/gºC a 75º C. Calcula la temperatura final de
11. Determina cuántos kilogramos de agua a una tem- equilibrio en ºC.
peratura de 5º C deben mezclarse con 20 kg de agua
a 75º C para obtener agua a 30º C . El calor específi- 15. Un cuerpo está compuesto por una aleación de
co del agua es 1 cal/gº C. 200 g de cobre, 150 g de estaño y 80 g de aluminio.
UNMSM 2006-II Calcula su capacidad calorífica Cal/ºC y el calor,
en cal, necesario para elevar su temperatura 50º C.
(Los calores específicos del cobre, del estaño y del
UNI
aluminio, en cal/gºC, respectivamente son: 0,094;
12. Se mezclan100 g de agua a 10º C con 300 g de 0,055 y 0,212).
agua a 90º C. ¿A qué temperatura terminará la UNI 2012-II
mezcla?
También podría gustarte
- Manual Instalaciones EléctricasDocumento69 páginasManual Instalaciones EléctricasLuis Eduardo Mercado97% (31)
- Mru AvanzadoDocumento3 páginasMru AvanzadoChristianHansVillanuevaZuloetaAún no hay calificaciones
- Movimiento Parabólico - Ejercicios Propuestos PDFDocumento2 páginasMovimiento Parabólico - Ejercicios Propuestos PDFDGCant67% (3)
- 23 Dinamica Circular PDFDocumento13 páginas23 Dinamica Circular PDFVane DíazAún no hay calificaciones
- Ejercicios de Calorimetría para Cuarto de SecundariaDocumento4 páginasEjercicios de Calorimetría para Cuarto de SecundariaVanessa Guizelly OLVEA ZAPANAAún no hay calificaciones
- Electrostatica 2 - Semana 3Documento6 páginasElectrostatica 2 - Semana 3Angie Chavez100% (1)
- Examen de Trabajo Mecanico F, E, G, CDocumento2 páginasExamen de Trabajo Mecanico F, E, G, CWilfredo Alegre100% (1)
- 12 Ejercicios de Termometría 9 DDocumento9 páginas12 Ejercicios de Termometría 9 DAlex Mgw100% (1)
- 2° de Secundaria Tarea 1 PDFDocumento8 páginas2° de Secundaria Tarea 1 PDFCarlos Andrés Clausen Alí100% (1)
- El Calor y Los Cambios de EstadoDocumento4 páginasEl Calor y Los Cambios de EstadoAnita Paola LoDeAún no hay calificaciones
- Movimiento Rectilineo Uniforme MRU-para-Cuarto-de-SecundariaDocumento5 páginasMovimiento Rectilineo Uniforme MRU-para-Cuarto-de-SecundariaPaOo VarGasAún no hay calificaciones
- Actividad Temperatura y Equilibrio Termico 5toDocumento3 páginasActividad Temperatura y Equilibrio Termico 5toDeysi Aliaga100% (1)
- Guía 3 - Calor Sensible y Cambio de FaseDocumento6 páginasGuía 3 - Calor Sensible y Cambio de FaseFelix MoralesAún no hay calificaciones
- Física - Ficha 1 - Tercer Grado Secundaria - Método CientíficoDocumento2 páginasFísica - Ficha 1 - Tercer Grado Secundaria - Método CientíficoCarlos Q50% (2)
- RP-CTA5-K03 - Ficha 3 - Una Idea Completa de Las Magnitudes Escalares y VectorialesDocumento12 páginasRP-CTA5-K03 - Ficha 3 - Una Idea Completa de Las Magnitudes Escalares y VectorialesJuanCarbajal100% (1)
- Cambios de Temperatura para Primer Grado de Secundaria PDFDocumento3 páginasCambios de Temperatura para Primer Grado de Secundaria PDFAlonso Anwar Vargas Saavedra100% (1)
- Mru Grafica FichaDocumento1 páginaMru Grafica FichaFrankling Aguilar Martinez100% (1)
- 5to Año - Gases Ideales - Ejercicios y Ecuación GeneralDocumento15 páginas5to Año - Gases Ideales - Ejercicios y Ecuación GeneralMarce RodriguezAún no hay calificaciones
- Escalas Termométricas para Primer Grado de SecundariaDocumento2 páginasEscalas Termométricas para Primer Grado de SecundariaRoder Arnol Torre SalvadorAún no hay calificaciones
- Ejercicios de Movimientos de ProyectilesDocumento9 páginasEjercicios de Movimientos de ProyectilesAngel SantosAún no hay calificaciones
- Equilibrio Termico Ejercicios PDFDocumento1 páginaEquilibrio Termico Ejercicios PDFJoakin BahamondesAún no hay calificaciones
- Examen de Fisica Cuarto SecundariaDocumento2 páginasExamen de Fisica Cuarto Secundariafoker01100% (1)
- Examen de Quinto Cta Dinamica CircularDocumento2 páginasExamen de Quinto Cta Dinamica CircularFrankling AguilarAún no hay calificaciones
- Calor ResueltosDocumento11 páginasCalor ResueltosSCARLETT CAMILA CABRERAAún no hay calificaciones
- Por Que El Spin Es FracciónDocumento4 páginasPor Que El Spin Es FracciónJose Garcia100% (2)
- Cinetica Quimica para Quinto de SecundariaDocumento10 páginasCinetica Quimica para Quinto de SecundariaAdelmo Jose Herazo Vergara0% (1)
- Primera Condición de Equilibrio - Cuestionario Previo - UpnDocumento2 páginasPrimera Condición de Equilibrio - Cuestionario Previo - UpnJulio MT100% (1)
- Examen FisicaDocumento11 páginasExamen FisicaMARIA DE LA LUZ VEGA MART�NEZAún no hay calificaciones
- Ficha 4 Fuerzas GravitatoriasDocumento2 páginasFicha 4 Fuerzas Gravitatoriaslandm1941Aún no hay calificaciones
- Materia y Energía - Práctica 3Documento7 páginasMateria y Energía - Práctica 3DiegoAún no hay calificaciones
- Ejercicios de Vectores Metodo Del PoligonoDocumento1 páginaEjercicios de Vectores Metodo Del PoligonoDanyeri ACAún no hay calificaciones
- Ejercicios Resueltos y Problemas de Temperatura PDFDocumento3 páginasEjercicios Resueltos y Problemas de Temperatura PDFVanessa Guizelly Olvea Zapana100% (1)
- Guía 13. Espejos EsféricosDocumento4 páginasGuía 13. Espejos EsféricosKarolyn Acosta100% (2)
- Estructura Del Átomo Nube ElectrónicaDocumento2 páginasEstructura Del Átomo Nube ElectrónicaCESAR AUGUSTO RAMIREZ GALVEZ100% (2)
- Ejercicios de Método Del Paralelogramo para Segundo Grado de SecundariaDocumento3 páginasEjercicios de Método Del Paralelogramo para Segundo Grado de SecundariaAlonso Anwar Vargas SaavedraAún no hay calificaciones
- Física Vectores Tema 5Documento10 páginasFísica Vectores Tema 5santiago trochezAún no hay calificaciones
- Ejercicios Escalas TermometricasDocumento2 páginasEjercicios Escalas Termometricasmontserrat rodriguez100% (1)
- Criterios de Evaluación de Física y QuímicaDocumento5 páginasCriterios de Evaluación de Física y QuímicamanuelpAún no hay calificaciones
- Cuestionario de 20 PreguntasDocumento3 páginasCuestionario de 20 PreguntasJavierAún no hay calificaciones
- Valencia y Estado de Oxidación para Cuarto Grado de SecundariaDocumento4 páginasValencia y Estado de Oxidación para Cuarto Grado de Secundariaelizabeth marsigliaAún no hay calificaciones
- Ejercicios de Termodinámica para Cuarto Grado de SecundariaDocumento4 páginasEjercicios de Termodinámica para Cuarto Grado de Secundariajose almonacidAún no hay calificaciones
- Dinamica Circular-1Documento4 páginasDinamica Circular-1mararafaAún no hay calificaciones
- Taller Escalas TermometricasDocumento3 páginasTaller Escalas TermometricasJhon CaceresAún no hay calificaciones
- MOVIMIENTO RECTILINEO UNIFORME Tiempo de Alcance, Tiempo de EncuentroDocumento1 páginaMOVIMIENTO RECTILINEO UNIFORME Tiempo de Alcance, Tiempo de EncuentroAylin García100% (1)
- Actividad Pelicula Interestelar SalvadorDocumento3 páginasActividad Pelicula Interestelar SalvadorCatherine NicoleAún no hay calificaciones
- Cta 5Documento302 páginasCta 5Tatiana Doraliza Tirado VarelaAún no hay calificaciones
- Trabajo PotenciaDocumento6 páginasTrabajo PotenciaWilbert Amanca Cordova100% (1)
- Lectura Movimiento de Los CuerposDocumento3 páginasLectura Movimiento de Los Cuerpostizzo100% (1)
- Problemas Resueltos Corriente Electrica 1Documento3 páginasProblemas Resueltos Corriente Electrica 1benyholly50% (2)
- Segunda Condición de EquilibrioDocumento4 páginasSegunda Condición de EquilibrioBLAS CCORAHUA CARPIOAún no hay calificaciones
- Examen de Fisica - Momento de FuerzaDocumento2 páginasExamen de Fisica - Momento de Fuerzacarlos vasquezAún no hay calificaciones
- Indagación 1 Calor y TemperaturaDocumento2 páginasIndagación 1 Calor y TemperaturaKath TamaraAún no hay calificaciones
- Magnitudes Fisicas y Analisis Dimensional para Quinto Grado de SecundariaDocumento4 páginasMagnitudes Fisicas y Analisis Dimensional para Quinto Grado de SecundariaFreddy Quispe condoriAún no hay calificaciones
- Ejercicios Resueltos de Calor y TemperaturaDocumento2 páginasEjercicios Resueltos de Calor y TemperaturaCecilia Laime50% (2)
- Resistencia EléctricaDocumento17 páginasResistencia EléctricaEDWIN CONDORI CHUMEAún no hay calificaciones
- (PDF) 5° SEC. EDA 6 SEMANA 5 CYT Diseña 2023 Diseñamos Una Vivienda Antisísmica (Maqueta)Documento8 páginas(PDF) 5° SEC. EDA 6 SEMANA 5 CYT Diseña 2023 Diseñamos Una Vivienda Antisísmica (Maqueta)Jose Luis Canales CanalesAún no hay calificaciones
- Ejercicios Resuelto Onda y SonidoDocumento3 páginasEjercicios Resuelto Onda y SonidoRoberto SantanaAún no hay calificaciones
- FISICA 5to DINAMICADocumento3 páginasFISICA 5to DINAMICAMishel Choque50% (2)
- P 04 Tabla Periodica y EnlacesDocumento11 páginasP 04 Tabla Periodica y EnlacesaronAún no hay calificaciones
- Práctica de Laboratorio MruDocumento3 páginasPráctica de Laboratorio MruJesús Arturo Coronado PortaAún no hay calificaciones
- Ejercicios Resueltos Momentos de FuerzasDocumento8 páginasEjercicios Resueltos Momentos de FuerzasBetty CosmeAún no hay calificaciones
- CALORIMETRÍADocumento5 páginasCALORIMETRÍAJoaquín Panta VillegasAún no hay calificaciones
- Evaluación Diaria de Aptitudes Y Conocimientos: I.E.P Thales de Mileto SchoolDocumento2 páginasEvaluación Diaria de Aptitudes Y Conocimientos: I.E.P Thales de Mileto SchoolChristianHansVillanuevaZuloetaAún no hay calificaciones
- Horario 2023 CirculoDocumento1 páginaHorario 2023 CirculoChristianHansVillanuevaZuloetaAún no hay calificaciones
- Fisica 4to Prim I Bim 2023 VirtDocumento19 páginasFisica 4to Prim I Bim 2023 VirtChristianHansVillanuevaZuloetaAún no hay calificaciones
- Evaluación Diaria de Aptitudes Y Conocimientos: I.E.P Thales de Mileto SchoolDocumento2 páginasEvaluación Diaria de Aptitudes Y Conocimientos: I.E.P Thales de Mileto SchoolChristianHansVillanuevaZuloetaAún no hay calificaciones
- Repaso 5to - 6toDocumento2 páginasRepaso 5to - 6toChristianHansVillanuevaZuloetaAún no hay calificaciones
- GUÍA - 3.° Año - SEM5 - ECO - II BIMDocumento2 páginasGUÍA - 3.° Año - SEM5 - ECO - II BIMChristianHansVillanuevaZuloetaAún no hay calificaciones
- GUÍA - 3.° Año - SEM4 - ECO - II BIMDocumento3 páginasGUÍA - 3.° Año - SEM4 - ECO - II BIMChristianHansVillanuevaZuloetaAún no hay calificaciones
- UntitledDocumento58 páginasUntitledChristianHansVillanuevaZuloetaAún no hay calificaciones
- GUÍA - 3.° Año - SEM3 - ECO - II BIMDocumento3 páginasGUÍA - 3.° Año - SEM3 - ECO - II BIMChristianHansVillanuevaZuloetaAún no hay calificaciones
- GUÍA - 3.° Año - SEM1 - ECO - II BIMDocumento3 páginasGUÍA - 3.° Año - SEM1 - ECO - II BIMChristianHansVillanuevaZuloetaAún no hay calificaciones
- Orientaciones para Ingresar Al Aula VirtualDocumento1 páginaOrientaciones para Ingresar Al Aula VirtualChristianHansVillanuevaZuloetaAún no hay calificaciones
- Carga-Eléctrica 3Documento2 páginasCarga-Eléctrica 3ChristianHansVillanuevaZuloetaAún no hay calificaciones
- Aprendizaje Por DebateDocumento2 páginasAprendizaje Por DebateChristianHansVillanuevaZuloetaAún no hay calificaciones
- HOJA DE RESUMEN 1° Sec CALORIMETRÍADocumento2 páginasHOJA DE RESUMEN 1° Sec CALORIMETRÍAChristianHansVillanuevaZuloetaAún no hay calificaciones
- Física 5 - IVB - 2021Documento53 páginasFísica 5 - IVB - 2021ChristianHansVillanuevaZuloetaAún no hay calificaciones
- Física 3 - IVB - 2021Documento49 páginasFísica 3 - IVB - 2021ChristianHansVillanuevaZuloetaAún no hay calificaciones
- Bases Trigonometria 2021Documento3 páginasBases Trigonometria 2021ChristianHansVillanuevaZuloetaAún no hay calificaciones
- INFORME Nº1 - 2021 - 3er Grado - Informes de Progreso II BimestreDocumento1 páginaINFORME Nº1 - 2021 - 3er Grado - Informes de Progreso II BimestreChristianHansVillanuevaZuloetaAún no hay calificaciones
- 5to SecDocumento12 páginas5to SecChristianHansVillanuevaZuloetaAún no hay calificaciones
- Formato de Proyectos - EquiposDocumento2 páginasFormato de Proyectos - EquiposChristianHansVillanuevaZuloetaAún no hay calificaciones
- ENFOQUEEEDocumento2 páginasENFOQUEEEChristianHansVillanuevaZuloetaAún no hay calificaciones
- Transmisor de 2 Hilos Con Protocolo HARTDocumento2 páginasTransmisor de 2 Hilos Con Protocolo HARTANGEL FLORESAún no hay calificaciones
- ZZcier ANEXOSDocumento14 páginasZZcier ANEXOSEddy NaulaAún no hay calificaciones
- Más Cerca de Entender Qué Es La Materia OscuraDocumento2 páginasMás Cerca de Entender Qué Es La Materia Oscurawilfredo torresAún no hay calificaciones
- SerranoPrac6 8Documento16 páginasSerranoPrac6 8Juan AndrésAún no hay calificaciones
- Examen Final C4 Dinamica PDFDocumento2 páginasExamen Final C4 Dinamica PDFFelipeLopezAún no hay calificaciones
- Descarga de SolidosDocumento5 páginasDescarga de SolidosJâviiêr OrtizzAún no hay calificaciones
- Discusión de Problemas 5 (Parte 3) - Física II PDFDocumento12 páginasDiscusión de Problemas 5 (Parte 3) - Física II PDFAnonymous Q3jNXMUBAún no hay calificaciones
- Diseño de TuberíasDocumento52 páginasDiseño de Tuberíaspatricio2406Aún no hay calificaciones
- Tarea ReaccionesDocumento6 páginasTarea ReaccionesNaysha LicuonaAún no hay calificaciones
- Propiedades Mecánicas MEMSDocumento9 páginasPropiedades Mecánicas MEMSmi.ni.pe.Aún no hay calificaciones
- Practica #13 - KATHERINE BURMESTERDocumento6 páginasPractica #13 - KATHERINE BURMESTERkatherine burmester100% (1)
- Practica 9a F El Diodo Laser Agosto 2020Documento14 páginasPractica 9a F El Diodo Laser Agosto 2020Ignacio OrtizAún no hay calificaciones
- UNIDAD 4 ResumenDocumento36 páginasUNIDAD 4 ResumendamianAún no hay calificaciones
- Condensadores Clase "X-Y" y Varistores o Condensadores de Alto VoltajeDocumento8 páginasCondensadores Clase "X-Y" y Varistores o Condensadores de Alto VoltajeIlco AmbarinoAún no hay calificaciones
- Ensayo - Energia SustentableDocumento3 páginasEnsayo - Energia SustentableMaria LopezAún no hay calificaciones
- Ejemplos de DistribucionDocumento26 páginasEjemplos de DistribucionJeison Chavez TantaricoAún no hay calificaciones
- Historia Del Sistema Métrico DecimalDocumento4 páginasHistoria Del Sistema Métrico DecimalDany GonzalezAún no hay calificaciones
- LAB. No 1 - Primera y Segunda Condicion de EquilibrioDocumento7 páginasLAB. No 1 - Primera y Segunda Condicion de EquilibriojosephAún no hay calificaciones
- Fuerza VariableDocumento8 páginasFuerza VariableCarmen Quiroz CotrinaAún no hay calificaciones
- Practica 05 Fuerzas Hidrostaticas Sobre SuperficiesDocumento18 páginasPractica 05 Fuerzas Hidrostaticas Sobre SuperficiesALEX QUICAÑO HUAMANAún no hay calificaciones
- Metodologia de La Investigación 8 PMDocumento16 páginasMetodologia de La Investigación 8 PMSebastián Quispe ChipanaAún no hay calificaciones
- Libro Teoria Electromagnetica 2014 1 Jllaury PDFDocumento169 páginasLibro Teoria Electromagnetica 2014 1 Jllaury PDFismael1518Aún no hay calificaciones
- TAREA 3 - DERIVADAS - CorregidaDocumento7 páginasTAREA 3 - DERIVADAS - Corregidamartha rinconAún no hay calificaciones
- Trabajo de Maquinas Electricas (Formato Apa)Documento27 páginasTrabajo de Maquinas Electricas (Formato Apa)manuelAún no hay calificaciones
- Corriente Electrica y ResistenciasDocumento4 páginasCorriente Electrica y ResistenciasSebastian SotoAún no hay calificaciones
- Hector Medina Practica de EnergiaDocumento10 páginasHector Medina Practica de EnergiaMedina Elias HéctorAún no hay calificaciones
- FGL 029 Guia 1. de Trabajo Practico - Experimental-Campo Eleìctrico de Un ConductorDocumento13 páginasFGL 029 Guia 1. de Trabajo Practico - Experimental-Campo Eleìctrico de Un Conductorestebox1691Aún no hay calificaciones
- Trabajo de Investigación Grupos de Balances - de - Materia-Para Tarea 2021Documento3 páginasTrabajo de Investigación Grupos de Balances - de - Materia-Para Tarea 2021Mauricio Albert Cortez ZelayaAún no hay calificaciones
- Maquinas Electricas Variadores de FrecuenciaDocumento17 páginasMaquinas Electricas Variadores de FrecuenciaAlex Fabricio Navarrete TorresAún no hay calificaciones