Amina
En el ámbito de la química orgánica, las aminas [1][2] son compuestos orgánicos y grupos funcionales que contienen un átomo de nitrógeno básico con un par solitario. Las aminas son formalmente derivados del amoníaco (NH
3), donde uno o más átomos de hidrógenos de la molécula de amoníaco son reemplazados por otros sustituyentes o radicales tales como un grupo alquilo o arilo[3] (estos pueden llamarse respectivamente alquilaminas y arilaminas; las aminas en las que ambos tipos de sustituyentes están unidos a un átomo de nitrógeno pueden llamarse alquilarilaminas). Las aminas importantes incluyen aminoácidos, amina biogénicas, trimetilamina y anilina; consulte Categoría:Aminas para obtener una lista de aminas. Los inorgánicos derivados del amoníaco también se denominan aminas, como la monocloramina (NClH
2).[4]
El sustituyente −NH
2 se denomina grupo amino.[5]
Los compuestos con un átomo de nitrógeno unido a un grupo carbonilo, por lo que tienen la estructura R−CO−NR′R″, se denominan amida y tienen diferentes propiedades químicas. propiedades de las aminas.
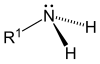
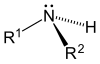
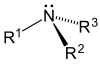
Según se sustituyen uno, dos o tres hidrógenos, las aminas son primarias, secundarias o terciarias, respectivamente.
| Amoniaco | Amina primaria | Amina secundaria | Amina terciaria |
|---|---|---|---|
 |
 |
 |
|
Clasificación de las aminas
[editar]Las aminas se pueden clasificar según la naturaleza y el número de sustituyentes en el nitrógeno. Las aminas alifáticas contienen sólo sustituyentes H y alquilo. Las aminas aromáticas tienen el átomo de nitrógeno conectado a un anillo de aromático.
Las aminas, alquilo y arilo por igual, se organizan en tres subcategorías (ver tabla) según el número de átomos de carbono adyacentes al nitrógeno (cuántos átomos de hidrógeno de la molécula de amoníaco son reemplazados por grupos hidrocarbonados[6]):[5]
- Aminas primarias (1°): las aminas primarias surgen cuando uno de los tres átomos de hidrógeno en el amoníaco se reemplaza por un grupo alquilo o aromático. Las aminas alquílicas primarias importantes incluyen metilamina, la mayoría de los aminoácidos y el agente amortiguador tris, mientras que las aminas aromáticas primarias incluyen anilina.
- Aminas secundarias (2°): las aminas secundarias tienen dos sustituyentes orgánicos (alquilo, arilo o ambos) unidos al nitrógeno junto con un hidrógeno. Algunos representantes importantes son la dimetilamina, mientras que un ejemplo de amina aromática sería la difenilamina.
- Aminas terciarias (3°)-En las aminas terciarias, el nitrógeno tiene tres sustituyentes orgánicos. Algunos ejemplos son la trimetilamina, que tiene un olor distintivo a pescado, y el EDTA.
Una cuarta subcategoría viene determinada por la conectividad de los sustituyentes unidos al nitrógeno:
- Aminas cíclicas-Aminas cíclicas son aminas secundarias o terciarias. Ejemplos de aminas clicas incluyen el anillo de 3 miembros aziridina y el anillo de seis miembros piperidina. La N-metilpiperidina y la N-fenilpiperidina son ejemplos de aminas terciarias clicas.
También es posible tener cuatro sustituyentes orgánicos en el nitrógeno. Estas especies no son aminas sino que son catión de amonio cuaternarios y tienen un centro de nitrógeno cargado. Existen ventas de amonio cuaternario con muchos tipos de aniones.
Las aminas son simples cuando los grupos alquilo son iguales y mixtas si estos son diferentes.
Las aminas son compuestos muy polares. Las aminas primarias y secundarias pueden formar enlaces de hidrógeno. Las aminas terciarias puras no pueden formar enlaces de hidrógeno, sin embargo pueden aceptar enlaces de hidrógeno con moléculas que tengan enlaces O-H o N-H. Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N-H es menos polar que el enlace O-H. Por lo tanto, las aminas forman enlaces de hidrógeno más débiles que los alcoholes de pesos moleculares semejantes.
Las aminas primarias y secundarias tienen puntos de ebullición menores que los de los alcoholes, pero mayores que los de los éteres de peso molecular semejante. Las aminas terciarias, sin enlaces de hidrógeno, tienen puntos de ebullición más bajos que las aminas primarias y secundarias de pesos moleculares semejantes.
Nomenclatura de las aminas
[editar]Las aminas se clasifican de acuerdo con el número de átomos de hidrógeno del amoniaco que se sustituyen por grupos orgánicos. Las que tienen un solo grupo se llaman aminas primarias, las que tienen dos se llaman aminas secundarias y las que tienen tres, aminas terciarias.
Las aminas sencillas se nombran enumerando los grupos que sustituyen a los átomos de hidrógeno del amoniaco y terminando con amina. Si hay varios grupos o radicales sustituyentes iguales se usan los prefijos di o tri. Cuando se trata de grupos diferentes estos se nombran por orden alfabético (etil antes que metil, o butil antes que propil, prescindiendo del tamaño) y terminando con la terminación amina.
Ejemplos:
| Compuesto | Nombres |
|---|---|
| CH3-NH2 | Metilamina |
| CH3-NH-CH3 | Dimetilamina |
| CH3-CH2-NH-CH2-CH2-CH3 | Etilpropilamina |
| CH3 | N-CH3 | CH3 |
Trimetilamina |
| CH3 | N-CH2-CH2-CH3 | CH2-CH3 |
Etilmetilpropilamina |
Reglas para nombrar aminas
[editar]
- 1.1. Se identifica la cadena principal que tenga el grupo amino y se enumera por el carbono al cual se encuentra unido el grupo amino. Si existen dos o más grupos amino se nombran desde el extremo que dé lugar a los menores prefijos localizadores (posición) de los sustituyentes y se nombran en orden alfabético con la palabra amina.

- 1.2. Cuando hay radicales complejos (que no sean radicales alquilo) sustituyendo al hidrógeno del grupo amino, se utiliza la letra N (mayúscula) por cada sustituyente y se procede a nombrar al compuesto.

- 1.3. Si el grupo amino se encuentra como sustituyente junto a otro grupo funcional más importante y en el caso de existir varios en una cadena se utiliza los prefijos como (amino, metilamino, aminometil). El grupo amino debe quedar en la menor posición.

- 1.4. Cuando varios átomos de nitrógeno formen parte de la cadena principal se enumera normalmente viendo que su posición sea la más baja posible y nombra con el vocablo aza
Estructura
[editar]Las aminas de alquilo
[editar]
Las aminas alquílicas se caracterizan por tener centros de nitrógeno tetraédricos. Los ángulos C-N-C y C-N-H se aproximan al ángulo idealizado de 109°. Las distancias C-N son ligeramente más cortas que las distancias C-C. La barrera energética para la inversión del nitrógeno del estereocentro es de aproximadamente 7 kcal/mol para una trialquilamina. La interconversión se ha comparado con la inversión de un paraguas abierto en un viento fuerte.
Las aminas del tipo NHRR' y NRR′R″ son chirales: el centro de nitrógeno lleva cuatro sustituyentes contando el par solitario. Debido a la baja barrera de inversión, las aminas del tipo NHRR' no pueden obtenerse con pureza óptica. En el caso de las aminas terciarias quirales, la NRR′R″ sólo puede resolverse cuando los grupos R, R' y R″ están limitados en estructuras cíclicas como las aziridinas sustituidas por N (sales de amonio cuaternario son resolubles).
Aminas aromáticas
[editar]En las aminas aromáticas ("anilinas"), el nitrógeno suele ser casi planar debido a la conjugación del par solitario con el sustituyente arilo. La distancia C-N es correspondientemente más corta. En la anilina, la distancia C-N es la misma que las distancias C-C.[7]
Propiedades físicas y fisiológicas
[editar]Las aminas alifáticas, como la monometilamina, la dimetilamina y la trimetilamina, así como la etilamina, son gaseosas a temperatura ambiente. Muchos otros compuestos homólogos son líquidos y algunas aminas homólogas incluso superiores, como la decilamina son sólidas a temperatura ambiente.
La amina aromática más sencilla anilina es líquida. Muchas anilinas sustituidas y otras aminas aromáticas con múltiples sistemas de anillos aromáticos, como la naftilaminas, son sólidas.
Debido a su polaridad y basicidad, las aminas son más solubles en agua que los hidrocarburos con el mismo número de átomos de C. La solubilidad de las aminas alifáticas en el agua disminuye al aumentar la longitud de las cadenas alquílicas. Las aminas aromáticas no son solubles en agua. Las aminas primarias y secundarias alifáticas y aromáticas líquidas se asocian mediante enlaces de hidrógeno. Esto hace que, al igual que los alcoholess, los puntos de ebullición sean más altos que los de los hidrocarburos análogos.
Las aminas alifáticas gaseosas irritan las mucosas de los ojos y las vías respiratorias. Mojar la piel con alquilaminas líquidas también provoca quemaduras. La intoxicación por inhalación de concentraciones más altas puede provocar un aumento de la presión arterial y convulsiones de corta duración. Las aminas aromáticas no son irritantes debido a su menor basicidad y volatilidad, pero son significativamente más tóxicas que las aminas alifáticas, como la anilina.
Las aminas alifáticas gaseosas tienen un olor similar al del amoníaco pero con un olor adicional "a pescado, pútrido". Los homólogos superiores y las aminas aromáticas o heterocíclicas también tienen olores que son percibidos como desagradables por el ser humano, por ejemplo, a heces (indol, skatole), o a carne en descomposición (cadaverina, putrescina), a orina o a pescado viejo (metil, etilo y trimetilamina). Estos compuestos pueden aparecer como productos intermedios o finales durante el proceso anaeróbico. degradación de material biológico, especialmente proteínas, o por descarboxilación de aminoácidos. El olor característico de la espermina se debe a la espermina -una poliamina lineal- con dos grupos amino primarios y dos secundarios.
Por otro lado, muchas drogas también pertenecen al grupo de las aminas, especialmente a menudo al subgrupo de las aminas heterocíclicas, como la atropina, la anfetamina, la quinina, la codeína y la cafeína, pero también drogas como la metanfetamina, la cocaína, la nicotina.
Detección de aminas
[editar]- Para detectar nitrógeno en un compuesto orgánico, se puede realizar una digestión de sodio de la sustancia a examinar. En la solución de digestión neutralizada, el nitrógeno se puede detectar como cianuro con la prueba de Lassaigne como azul de Prusia o, si la sustancia también contenía azufre, como tiocianato con Cloruro ferroso. Sin embargo, esta evidencia no es específica para las aminas, sino que solo indica que la sustancia de análisis contenía nitrógeno.
- Las aminas a menudo se pueden identificar por su característico olor acre o desagradable (como amoníaco a pescado). Pero eso no es suficiente como prueba.
- Para determinar el grado de sustitución de la amina, es decir, si está presente una amina primaria, secundaria o terciaria, se lleva a cabo la separación de Hinsberg. Aquí, la amina se convierte en p-amida de ácido toluenosulfónico:
Las aminas terciarias y las sales de amonio cuaternario no forman sulfonamidas,
Las aminas secundarias forman sulfonamidas que no son solubles en álcali
Las aminas primarias forman sulfonamidas que son solubles en álcali.
- Una amina desconocida se identifica claramente ya sea espectrometría de masas o mediante un derivado adecuado cuyo punto de fusión característico se determina:
- Aminas primarias y secundarias: La sulfonamida ya obtenida a partir de la separación de Hinsberg es adecuada como derivado (ver arriba).
- Aminas terciarias: Aquí se recomienda la precipitación de picrato.
Las aminas primarias, secundarias y terciarias pueden separarse cromatográficamente sin derivación mediante HPLC. La detección y cuantificación se realiza con un detector selectivo de masas (HPLC/MS). Para la determinación inequívoca de aminas de la misma masa molar (por ejemplo, dietilamina y butilamina), se recomienda el uso de sustancias estándar para la calibración.
Actividad biológica
[editar]Las aminas son omnipresentes en la biología. La descomposición de los aminoácidos libera aminas, como es el caso del pescado en descomposición, que huele a trimetilamina. Muchos neurotransmisores son aminas, como la epinefrina, la norepinefrina, la dopamina, la serotonina y la histamina. Protonada Los grupos aminos (-NH
3) son los elementos con carga positiva más comunes en las proteínas, concretamente en el aminoácido lisina.[8] El polímero aniónico ADN suele estar unido a varias proteínas ricas en aminas.[9] Además, el amonio primario con carga terminal de la lisina forma puentes salinos con los grupos carboxilato de otros aminoácidos en los polipéptidos, lo que constituye una de las principales influencias en las estructuras tridimensionales de las proteínas.[10]
Uso
[editar]Las aminas aromáticas se utilizan para fabricar tintes azoicos. Las aminas son componentes básicos de productos agroquímicos y farmacéuticos, así como de tensioactivos, revestimientos y lubricantes. En el campo de la tecnología de la fundición, las aminas se utilizan como catalizadores para acelerar el proceso de curado de los aglutinantes en la arena de moldeo durante la producción de machos mediante el proceso de caja fría. Las aminas y las diaminas también se utilizan como catalizadores para la producción y la reticulación de los poliuretanos. Su efecto amortiguador se aprovecha cuando se utilizan como inhibidores de la corrosión en sistemas acuosos. Otro importante campo de aplicación de las aminas es la depuración de gases en refinerías y centrales eléctricas.
Referencias
[editar]- ↑ Amine definition and meaning -Collins English Dictionary. Archivado desde el original el 23 de febrero de 2015. Consultado el 28 de marzo de 2017.
- ↑ «amine – definition of amine in English». Oxford Dictionaries. Archivado desde el original el 23 de febrero de 2015. Consultado el 28 de marzo de 2017.
- ↑ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ↑ Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). Amines, Aliphatic. ISBN 3527306730. doi:10.1002/14356007.a02_001.
- ↑ a b Smith, Janice Gorzynski (2011). Organic chemistry (en inglés) (3rd edición). New York, NY: McGraw-Hill. pp. 949-993. ISBN 978-0-07-337562-5. Archivado desde el original el 28 de junio de 2018. Consultado el 26 de junio de 2018.
- ↑ «3.11 Basic properties of amines». Chemistry LibreTexts (en inglés). 28 de septiembre de 2015. Archivado desde 11_Basic_properties_of_amines el original el 23 de mayo de 2021. Consultado el 23 de mayo de 2021.
- ↑ G. M. Wójcik "Structural Chemistry of Anilines" en Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. 2007, Wiley-VCH, Weinheim. doi= 10.1002/9780470682531.pat0385
- ↑ Andrade, Miguel A.; O'Donoghue, Seán I.; Rost, Burkhard (1998). «Adaptación de las superficies de las proteínas a la localización subcelular». Journal of Molecular Biology 276 (2): 517-25. PMID 9512720. doi:10.1006/jmbi.1997.1498.
- ↑ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (3rd edición). New York: Worth Publishing. ISBN 1-57259-153-6.
- ↑ Dill, Ken A. (1990). «Fuerzas dominantes en el plegamiento de proteínas». Biochemistry 29 (31): 7133-55. PMID 2207096. doi:10.1021/bi00483a001.
Bibliografía
[editar]- «Amines | Introduction to Chemistry». courses.lumenlearning.com. Consultado el 22 de julio de 2021.
- Flick, Ernest W. (1993). Epoxy resins, curing agents, compounds, and modifiers : an industrial guide. Park Ridge, NJ. ISBN 978-0-8155-1708-5. OCLC 915134542.
Véase también
[editar]Enlaces externos
[editar] Wikimedia Commons alberga una galería multimedia sobre Amina.
Wikimedia Commons alberga una galería multimedia sobre Amina.
