Giberelinas
Las giberelinas (GAs) son fitohormonas que regulan varios procesos de desarrollo en plantas, como la regulación del crecimiento longitudinal del tallo, la germinación, la interrupción del período de dormancia de las semillas, la floración, el desarrollo floral, la inducción del desarrollo de yemas y frutos y la senescencia vegetal, así como también la elongación de órganos axiales como pecíolos, pedúnculos, etc.[1][2]
Historia
[editar]
La investigación sobre giberelinas tiene su origen en Japón en el siglo XIX.[2] Una enfermedad del arroz generada por un hongo llamado Gibberella fujikuroi (de donde proviene el nombre «giberelinas», hongo ahora reclasificado como Fusarium fujikuroi), producía un crecimiento anormal en las plantas. Se observó que esta sustancia provocaba un fuerte alargamiento de los tallos y hojas del arroz y, finalmente, hacía que se volcaran.[3][4]
El aumento de la comunicación entre Japón y Occidente después de la Segunda Guerra Mundial aumentó el interés por esa sustancia que habían denominado "giberelina" en el Reino Unido y los Estados Unidos (EE. UU.).[2] Los trabajadores de Imperial Chemical Industries en el Reino Unido[5] y el Departamento de Agricultura de los EE. UU. aislaron de forma independiente el ácido giberélico[4] (los estadounidenses se referían originalmente a la sustancia química como giberelina A3 o GA3).[2]
El profundo efecto de las giberelinas en el crecimiento y desarrollo de las plantas, en particular la recuperación del crecimiento en mutantes enanos y la inducción de la brotación y la floración en algunas especies de rosetas, provocó la especulación de que estos metabolitos fúngicos eran reguladores endógenos del crecimiento de las plantas y esto se confirmó mediante caracterización química a fines de la década de 1950.[2] Hoy se conoce que las giberelinas están presentes en las plantas vasculares y en algunas especies de hongos y bacterias. La biosíntesis de giberelinas en plantas y hongos se ha resuelto en gran medida en referencia a las vías de síntesis, las enzimas y genes involucrados y su regulación. La propuesta de que las giberelinas actúan en las plantas eliminando la limitación del crecimiento se confirmó con la demostración de que inducen la degradación de las proteínas DELLA inhibidoras del crecimiento. El mecanismo por el cual esto se logra se aclaró con la identificación del receptor de giberelina del arroz en el año 2005.[2]
El conocimiento de las giberelinas se extendió por todo el mundo a medida que se hacía más evidente el potencial de su uso en varias plantas de importancia comercial. Así se llegó a desarrollar un conocido inhibidor de la biosíntesis de giberelinas: el paclobutrazol (PBZ), que a su vez inhibe el crecimiento e induce la fructificación temprana y la formación de semillas.
Por su parte, Margaret Radley demostró que el cultivar de trigo enano japonés Norin-10 y las líneas enanas relacionadas no respondían a la aplicación de ácido giberélico, a diferencia de las líneas altas, y que acumulaban niveles mucho más elevados de sustancias similares al ácido giberélico que los cultivares altos. Sugirió que en estas líneas, un “bloqueo en la utilización de GA provoca una acumulación de la hormona”. Esta propuesta resultó ser correcta, aunque el vínculo entre la acción de las giberelinas y el metabolismo no fue tan directo como Radley pudo haber imaginado. Norin-10 es la fuente de los genes de altura reducida (Rht) que Norman Borlaug introdujo en variedades de trigo de alto rendimiento en la Revolución verde para estabilizar el tallo y aumentar el índice de cosecha en la década de 1960.[2]
Formas químicas de las giberelinas
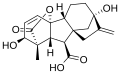
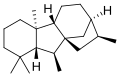
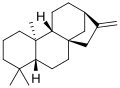
[editar]Todas las giberelinas (GAs) conocidas son ácidos diterpenoides que se sintetizan por la vía del terpenoide en los plástidos y luego se modifican en el retículo endoplásmico y el citosol hasta que alcanzan su forma biológicamente activa.[6] Todas las giberelinas se obtienen a través del esqueleto ent-giberelano, pero derivan del hidrocarburo heterocíclico ent-kaureno. Las giberelinas se denominan GA1 a GAn en orden de descubrimiento, aunque el ácido giberélico, que fue la primera giberelina en caracterizarse estructuralmente, es la GA3. En 2003, se identificaron 126 AG de plantas, hongos y bacterias.[2]
Las giberelinas son ácidos diterpénicos tetracíclicos. Hay dos clases, basadas en la presencia de 19 o 20 átomos de carbono. Las giberelinas de 19 carbonos, como el ácido giberélico, han perdido el carbono 20 y, en su lugar, poseen un puente de lactona de cinco miembros que une los carbonos 4 y 10. Las formas de 19 carbonos son, en general, las formas biológicamente activas de las giberelinas. La hidroxilación también tiene un gran efecto sobre la actividad biológica de la giberelina. En general, los compuestos biológicamente más activos son las giberelinas dihidroxiladas, que poseen grupos hidroxilo tanto en el carbono 3 como en el carbono 13. El ácido giberélico es una giberelina dihidroxilada.[7]
-
GA1 -
ent-Giberelano -
ent-Kaureno
Las GAs bioactivas más habituales son: GA1, GA3, GA4 y GA7.[8] Hay tres rasgos estructurales comunes entre estas GAs:
- Un grupo hidroxilo en C-3β,
- Un grupo carboxilo en C-6 y
- Una lactona entre C-4 y C-10.
El grupo 3β-hidroxilo se puede intercambiar por otros grupos funcionales en las posiciones C-2 y/o C-3, ya que GA5 y GA6 son ejemplos de GAs bioactivos que no tienen un grupo hidroxilo en C-3β.[8]
La presencia de GA1 en varias especies de plantas sugiere que es una GA bioactiva común.[7]
Función biológica
[editar]Las giberelinas están involucradas en el proceso natural de romper la latencia y otros aspectos de la germinación. Antes de que el aparato fotosintético se desarrolle lo suficiente en las primeras etapas de la germinación, las reservas de energía almacenadas del almidón nutren la plántula. Por lo general, en la germinación, la descomposición del almidón en glucosa en el endospermo comienza poco después de que la semilla se exponga al agua.[9]
Las giberelinas se producen en mayor masa cuando la planta se expone a bajas temperaturas. Estimulan el crecimiento del tallo de las plantas mediante la estimulación de la división y elongación celular, regulan la transición de la fase juvenil a la fase adulta, influyen en la iniciación floral, y en la formación de flores unisexuales en algunas especies; promueven el establecimiento y crecimiento del fruto, en casos de que las auxinas no aumentan el crecimiento, promueven la germinación de las semillas (ruptura de la dormición) y la producción de enzimas hidrolíticas durante la germinación.
Biosíntesis de GAs en la planta
[editar]Las GAs generalmente se sintetizan a partir de la vía del metileritritol fosfato (MEP) en las plantas superiores.[10] En esta vía, la GA bioactiva se produce a partir de difosfato de trans-geranilgeranilo (GGDP).
La biosíntesis de las giberelinas está regulada por distintos factores:
- Exógenos:
- Fotoperíodo: Aumentan giberelinas y se produce la floración (en plantas de día largo, que requieren una determinada duración de la noche para crecer).
- Temperatura: En determinadas especies, es necesario pasar una época fría para que se produzca la germinación o floración, esas bajas temperaturas inducen al biosíntesis de GAs.
- Endógenos: Sistema de retroalimentación de las giberelinas: cuando la concentración de GAs es baja, se induce su síntesis, y cuando es alta la inhibe.
- Catabolismo: La hidroxilación del C2 es el proceso catabólico más importante (las GAs que presentan el OH en el C2 son inactivas).[10]
- Conjugación: Suele producirse con glúcidos, generándose una forma inactiva, pero que sirve como reserva movilizable en caso de necesidad.
Regulación de las GAs en plantas
[editar]Mediada por otras hormonas
[editar]La auxina ácido indol-3-acético (AIA) regula la concentración de GA1 en los entrenudos alargados en los guisantes.[11] La eliminación de AIA mediante la eliminación de la yema apical, la fuente de auxina, reduce la concentración de GA1 y la reintroducción de AIA revierte estos efectos para aumentar la concentración de GA1.[11] La auxina aumenta la oxidación de GA3 y disminuye la oxidación de GA2 en la cebada.[12] La auxina también regula la biosíntesis de GA durante el desarrollo del fruto en los guisantes.[13] Estos descubrimientos en diferentes especies de plantas sugieren que la regulación mediada por auxinas en el metabolismo de GAs puede ser un mecanismo universal. Además, el etileno disminuye la concentración de GAs bioactivos.[14]
Factores medioambientales
[editar]Las fluctuaciones en la concentración de GAs influyen en la germinación de la semilla regulada por luz, la fotomorfogénesis durante la desetiolación y la regulación del fotoperíodo de la elongación del tallo y la floración.[8]
Papel en el desarrollo de semillas
[editar]Los niveles de GAs bioactivas y el ácido abscísico tienen una relación inversa y regulan el desarrollo y la germinación de las semillas.[15][16]
Referencias
[editar]- ↑ Srivastava, Lalit M. (2002). «Gibberellins». Plant Growth and Development: Hormones and Environment (en inglés). San Diego, California: Associated Press. pp. 171-190. ISBN 978-0-12-660570-9. Consultado el 22 de febrero de 2015.
- ↑ a b c d e f g h Hedden, Peter; Sponsel, Valerie (2015). «A century of gibberellin research». Journal of Plant Growth Regulation 34: 740-760.
- ↑ Grennan AK (June 2006). «Gibberellin metabolism enzymes in rice». Plant Physiology 141 (2): 524-6. PMC 1475483. PMID 16760495. doi:10.1104/pp.104.900192.
- ↑ a b B B Stowe; Yamaki, and T. (1957). «The History and Physiological Action of the Gibberellins». Annual Review of Plant Physiology 8 (1): 181-216. doi:10.1146/annurev.pp.08.060157.001145.
- ↑ Mees, G.C.; Elson, G.W. (1978). «Chapter 7: The gibberellins». En Peacock, F.C., ed. Jealott's Hill: Fifty years of Agricultural Research 1928-1978. Imperial Chemical Industries Ltd. pp. 55–60. ISBN 0901747017. (requiere registro).
- ↑ Campbell N, Reec JB (2002). Biology (6th edición). San Francisco: Benjamin Cummings. ISBN 9780805366242.
- ↑ a b MacMillan J (December 2001). «Occurrence of Gibberellins in Vascular Plants, Fungi, and Bacteria». Journal of Plant Growth Regulation 20 (4): 387-442. PMID 11986764. S2CID 44504525. doi:10.1007/s003440010038.
- ↑ a b c Yamaguchi S (2008). «Gibberellin metabolism and its regulation». Annual Review of Plant Biology 59: 225-51. PMID 18173378. doi:10.1146/annurev.arplant.59.032607.092804.
- ↑ Davies, Peter J. «Plant growth». AccessScience. doi:10.1036/1097-8542.523000.
- ↑ a b Hedden P, Thomas SG (May 2012). «Gibberellin biosynthesis and its regulation». The Biochemical Journal 444 (1): 11-25. PMID 22533671. S2CID 25627726. doi:10.1042/BJ20120245.
- ↑ a b Ross JJ, O'Neill DP, Smith JJ, Kerckhoffs LH, Elliott RC (March 2000). «Evidence that auxin promotes gibberellin A1 biosynthesis in pea». The Plant Journal 21 (6): 547-52. PMID 10758505. doi:10.1046/j.1365-313x.2000.00702.x.
- ↑ Wolbang CM, Chandler PM, Smith JJ, Ross JJ (February 2004). «Auxin from the developing inflorescence is required for the biosynthesis of active gibberellins in barley stems». Plant Physiology 134 (2): 769-76. PMC 344552. PMID 14730077. doi:10.1104/pp.103.030460.
- ↑ Ngo P, Ozga JA, Reinecke DM (July 2002). «Specificity of auxin regulation of gibberellin 20-oxidase gene expression in pea pericarp». Plant Molecular Biology 49 (5): 439-48. PMID 12090620. S2CID 22530544. doi:10.1023/A:1015522404586.
- ↑ Achard P, Baghour M, Chapple A, Hedden P, Van Der Straeten D, Genschik P, Moritz T, Harberd NP (April 2007). «The plant stress hormone ethylene controls floral transition via DELLA-dependent regulation of floral meristem-identity genes». Proceedings of the National Academy of Sciences of the United States of America 104 (15): 6484-9. Bibcode:2007PNAS..104.6484A. PMC 1851083. PMID 17389366. doi:10.1073/pnas.0610717104.
- ↑ Batge SL, Ross JJ, Reid JB (1999). «Abscisic acid levels in seeds of the gibberellin-deficient mutant lh-2 of pea (Pisum sativum)». Physiologia Plantarum 195 (3): 485-490. doi:10.1034/j.1399-3054.1999.105313.x.
- ↑ White CN, Proebsting WM, Hedden P, Rivin CJ (April 2000). «Gibberellins and seed development in maize. I. Evidence that gibberellin/abscisic acid balance governs germination versus maturation pathways». Plant Physiology 122 (4): 1081-8. PMC 58942. PMID 10759503. doi:10.1104/pp.122.4.1081.