Carbonate de magnésium
Le carbonate de magnésium (MgCO3) est un solide de couleur blanche, qui se trouve à l'état minéral dans la nature. Sous forme de poudre, le carbonate de magnésium est utilisé comme anti-transpirant dans de nombreux sports, connu sous le nom de magnésie — même si en chimie, la magnésie désigne de fait l'oxyde de magnésium.
| Carbonate de magnésium | |
  |
|
| Carbonate de magnésium en poudre. | |
| Identification | |
|---|---|
| Nom UICPA | carbonate de magnésium |
| Synonymes |
magnésite |
| No CAS | |
| No ECHA | 100.008.106 |
| No CE | 208-915-9 |
| Code ATC | A02 A06 |
| PubChem | 11029 |
| ChEBI | 31793 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
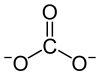
| Formule | MgCO3 |
| Masse molaire[1] | 84,313 9 ± 0,002 3 g/mol C 14,25 %, Mg 28,83 %, O 56,93 %, |
| Propriétés physiques | |
| T° fusion | 350 °C (décomposition)[2] |
| Solubilité | 0,106 g l−1 (eau, 20 °C)[2] |
| Masse volumique | 2,96 g cm−3 (à 20 °C)[2] |
| Thermochimie | |
| S0solide | 65,84 J K−1 mol−1[3] |
| ΔfH0solide | −1 111,69 kJ mol−1[3] |
| Précautions | |
| NFPA 704[4] | |
| Composés apparentés | |
| Autres cations | carbonate de calcium carbonate de strontium carbonate de baryum |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Propriétés physico-chimiques
modifierPour des températures supérieures à 400 °C, une décarboxylation du carbonate de magnésium a lieu et forme l'oxyde de magnésium :
Utilisation
modifierSous forme de poudre appelée couramment « magnésie », le carbonate de magnésium est utilisé dans certains sports comme la gymnastique artistique, l'escalade ou l'haltérophilie pour assécher les mains[5]. La formule de cette poudre est plus précisément (MgCO3)4Mg(OH)25H2O[6]. Elle peut contenir une faible proportion de silice qui, inhalée, peut avoir des effets sur les poumons.[réf. nécessaire]En conséquence, pour des raisons d'hygiène et de sécurité sanitaire, l'utilisation de magnésie dite « liquide » est aujourd'hui courante. Ce produit est en réalité un mélange d'eau, d'alcool (éthylique ou isopropylique) et de carbonate de magnésium.
Notes et références
modifier- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Magnesium(II) carbonat » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 4 mai 2010 (JavaScript nécessaire).
- (en) « Magnesium carbonate », sur NIST/WebBook (consulté le 4 mai 2010).
- UCB, université du Colorado.
- « Colophane et magnésie », sur cosiroc.fr, (consulté le ).
- « Magnesium Carbonate - an overview - ScienceDirect Topics », sur sciencedirect.com (consulté le ).
