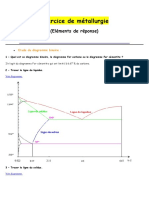
Diagramme Fer Carbone
Diagramme Fer Carbone
Transféré par
dayangDroits d'auteur :
Formats disponibles
Diagramme Fer Carbone
Diagramme Fer Carbone
Transféré par
dayangDescription originale:
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Droits d'auteur :
Formats disponibles
Diagramme Fer Carbone
Diagramme Fer Carbone
Transféré par
dayangDroits d'auteur :
Formats disponibles
DIAGRAMME FER-CARBONE / FER-CEMENTITE
INTRODUCTION……………………………………………………………………...2
I. GENERALITES………………………………………………………………..3
1. Le fer et ses caractéristiques……………………………………………...4
2. Le carbone et ses caractéristiques...………………………………………5
3. La cémentite………………………………………………………………5
4. Alliage fer-carbone……………………………………………………….6
5. Les phases………………………………………………………………...6
II. DIAGRAMME D’EQUILIBRE……………………………………………….7
1. Définition…………………………………………………………………8
2. Différents types de diagrammes d’équilibre…………………………….. 8
3. Elaboration d’un diagramme binaire……………………………………..8
III. DIAGRAMME FER-CARBONE…………………………………………....10
1. Les différents types de diagrammes fer-carbone……………………......11
2. Conditions d’utilisation…………………………………………………12
A. DIAGRAMME FER-CEMENTITE……………………………………. 12
1. Présentation……………………………………………………………..12
2. Définition des constituants micrographiques…………………………...13
3. Les points et lignes caractéristiques du diagramme…………………….14
4. Les transformations……………………………………………………..16
5. Principe de lecture du diagramme………………………………………17
B. TRANSFORMATION DES ACIERS ET FONTES…………………... 18
1. Généralités………………………………………………………………18
2. Désignations normalisées……………………………………………….20
IV. APPLICATION DES DIAGRAMMES D’EQUILIBRE…………………..23
1. En fonderie et en traitements thermiques……………………………….24
2. Dans le domaine de l’assemblage des métaux………………………….24
CONCLUSION………………………………………………………………………. 26
BIBLIOGRAPHIE……………………………………………………………………27
ANNEXE………………………………………………………………………………28
Mécanique et Automatismes Industriels Page 1
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Les matériaux utilisés par l’ingénieur ou le technicien supérieur sont rarement à l’état pur
car difficilement utilisables dans l’industrie du fait de leurs propriétés mécaniques et
chimiques inappropriées. L’addition d’un ou plusieurs éléments (métaux et métalloïde) à un
élément pur peut profondément modifier ses propriétés. Les mélanges ainsi obtenus se
nomment alliages métalliques. Ils comportent plusieurs phases distinctes. Celles-ci vont par
ailleurs influencer les propriétés des matériaux par leur nature et leur répartition.
Il existe une très grande variété d’alliage métallique. Parmi les plus répandus, on a les
alliages du fer et du carbone. L’état thermodynamique d’équilibre des alliages fer-carbone
s’étudie au travers du diagramme binaire Fe-C.
Apprendre à lire, interpréter et utiliser les diagrammes d'équilibre binaires (ou diagrammes
de phases) est donc d'une importance fondamentale en métallurgie. L’étude du cas particulier
du diagramme Fer-Carbone permet d’avoir des compléments d’informations sur la formation
des différentes phases du fer mais aussi sur la présence et le rôle que joue le corps d’addition
c’est-à-dire le carbone dans l’alliage.
C’est ainsi que l’étude du thème intitulé : «Diagramme Fer-Carbone/Fer-Cémentite» nous a
été confié. Dans la suite du travail, nous ferons l’analyse de son mode d’élaboration et de ses
particularités.
Mécanique et Automatismes Industriels Page 2
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Mécanique et Automatismes Industriels Page 3
DIAGRAMME FER-CARBONE / FER-CEMENTITE
1. Le fer et ses caractéristiques
Le fer est l’élément chimique le plus abondant et le plus utilisé de tous les métaux. Il
constitue plus de 90 % des métaux raffinés dans le monde. Le fer est surtout utilisé après
traitement chimique pour la fabrication du fer forgé, des aciers et d’autres alliages. Le tableau
ci-après résume les informations sur le fer :
CARTE D'IDENTITE DU FER
Nom fer
Symbole Fe
Date de la découverte Antiquité
Numéro atomique 26
Masse atomique 55,845
Point de fusion 1 538 °C
Point d'ébullition 2 861 °C
État physique à 20 °C solide
Origine du nom du latin ferrum
Particularité le plus utilisé de tous les métaux
Il y a deux variétés allotropiques du fer (deux réseaux cristallins différents) :
Le fer dont le réseau est cubique centré (CC)
Le fer γ dont le réseau est cubique à faces centrées (CFC).
Le phénomène de la modification du réseau cristallin sous l'effet de la température porte le
nom de transformation allotropique.
Le fer existe aux températures inférieures à 910°C et supérieures à 1400°C. Entre 770°C et
910°C, le fer est désigné par Fe et au-dessus de 1400°C, il est désigné par Fe. Le fer est
magnétique jusqu'à la température de 770°C. Cette température est appelée point de curie,
qui correspond à la transformation magnétique.
Le Fer γ existe entre 910°C et 1400°C, il est paramagnétique c'est-à-dire qu’il ne possède pas
d’aimantation en l’absence de champ magnétique extérieur autrement dit placé dans un champ
magnétique, ces corps acquiert une faible aimantation.
Domaine
Type de fer Structure cristalline
d’existence (°C)
Cubique centré
Fer En dessous de 770
Fer De 770 à 910
Fer De 1400 à 1500
Mécanique et Automatismes Industriels Page 4
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Cubique à Face Centré
Fer De 910 à 1400
2. Le carbone et ses caractéristiques
Le carbone est un élément chimique appartenant à la famille des metalloïdes. Il est essentiel
à l’existence des organismes vivants et possède de nombreuses applications industrielles.
CARTE D'IDENTITE DU CARBONE
Nom Carbone
Symbole C
Date de la découverte Antiquité
Numéro atomique 6
Masse atomique 12,011
Point de fusion 3 527 °C
Point d'ébullition 4 027 °C
État physique à 20 °C Solide
Origine du nom du latin carbo, « charbon », substance riche en carbone
Particularité essentiel à l'existence des organismes vivants
3. La cémentite
La cémentite ou carbone de fer (Fe3C) est une combinaison chimique de fer et de carbone
dont la teneur en carbone peut atteindre 6,67 %. Elle est magnétique jusqu'à 210°C et très
dure mais fragile. Sa température de fusion est d’environ 1216°C et celle de curie est
d’environ 206.85°C. La microstructure de la cémentite peut se présenter dans les aciers sous
les formes suivantes :
Lamellaire dans la perlite lamellaire
Grains dans les aciers ayant subit un traitement thermique de recuit
Précipités inter-granulaires dans les aciers ayant un pourcentage de carbone supérieur
à 0,8 %.
La cémentite est un composé métastable et chimiquement défini de structure orthorhombique.
Mécanique et Automatismes Industriels Page 5
DIAGRAMME FER-CARBONE / FER-CEMENTITE
4. Alliage fer-carbone
En pratique, le fer pur s’emploie qu’à l’état d’alliage avec d’autres corps. Il subsiste
toujours dans ces alliages un peu d’impuretés (soufre, phosphore) qu’il est impossible
d’éliminer complètement à l’affinage du minerai de fer qui contient ces corps. Tous les
alliages à base de fer ayant comme deuxième constituant le carbone portent le nom commun
d’acier. Le carbone joue un rôle fondamental : il durcit le fer et rend possible le phénomène
de la trempe.
5. Les phases
Les phases sont les parties homogènes d’un système. Elles sont caractérisées par :
La composition chimique, le type de réseau cristallin et les propriétés résultantes
La présence d'une surface de séparation avec les autres parties du système appelée
‘’interface‘’
Un changement brusque de composition et de propriétés lors du passage à travers cette
interface.
Parmi les phases, on distingue :
Les solutions solides
Les solutions liquides
Les combinaisons chimiques (type AnBn).
Mécanique et Automatismes Industriels Page 6
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Mécanique et Automatismes Industriels Page 7
DIAGRAMME FER-CARBONE / FER-CEMENTITE
1. Définition
Dans les conditions d'équilibre prévues, le diagramme d'équilibre représente les domaines
d'existence des différentes phases rencontrées dans un plan température-composition. Il
permet, le plus souvent, de prévoir la morphologie, la composition ainsi que la proportion des
phases en présence. Les diagrammes d'équilibre sont donc des documents de base pour le
métallurgiste. Ils lui permettent de connaître les conditions à respecter pour obtenir certaines
phases ou, au contraire, pour éviter leur formation, et ceci afin d'obtenir les propriétés désirées
pour l'alliage considéré, alliage destiné à un emploi donné.
2. Différents types de diagramme d’équilibre
L’addition à un métal pur, d’un ou de plusieurs éléments, métalliques ou non, peut
profondément modifier ses propriétés. Les substances qui forment les alliages sont appelées :
‘’composants’’. Selon le nombre de composants, un alliage peut être :
Binaire (2 composants)
Ternaire (3 composants)
Quaternaire (4 composants)
etc.
Ainsi, un diagramme porte le nom de l’alliage qu’il représente. C’est le cas du diagramme
binaire fer-carbone. Dans la suite du travail, les diagrammes d’équilibre que nous étudierons
se rapportent aux alliages binaires.
3. Elaboration d’un diagramme binaire
Les diagrammes d'équilibre sont une représentation des transformations solide-liquide ou
solide-solide d'un alliage. Ils sont établis à partir des courbes de refroidissement temps-
température de l’alliage binaire considéré. Ces courbes sont relevées pour différentes valeurs
de la teneur en élément d’alliage. Les paramètres qui varient sont la température et la
concentration en élément d’alliage de l’alliage considéré.
Quel que soit le type d'alliage, la solubilité de l'élément "B" (appelé métal d’apport), dans le
métal "A" (appelé métal de base) va dépendre de la température.
Diagramme binaire de composants A-B
Mécanique et Automatismes Industriels Page 8
DIAGRAMME FER-CARBONE / FER-CEMENTITE
La courbe correspondant au liquidus, est la ligne de formation (ou disparition) des premières
gouttes (ou dernières) de liquide. Au-dessus de cette ligne, il n'y a que du liquide.
La courbe correspondant au solidus, est la ligne de formation (ou disparition) des premières
germes (ou dernières) de solide. En-dessous de cette courbe, il n'y a que du solide.
Mécanique et Automatismes Industriels Page 9
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Mécanique et Automatismes Industriels Page 10
DIAGRAMME FER-CARBONE / FER-CEMENTITE
1. Les différents types de diagramme fer-carbone
Le carbone dont le point de fusion est supérieur à 3500°C est soluble dans le fer et peut se
cristalliser à l'état pur en formant le graphite ou se combiner avec le fer en formant une phase
intermétallique Fe3C appelée cémentite ou carbone de fer.
Lorsque le refroidissement du métal liquide est lent les atomes de carbone se cristallisent en
formant le graphite et dans le cas contraire on a la formation de la cémentite (Fe3C), qui ne
peut se décomposer à la température ambiante. Mais à un maintien de température supérieure
à 500°C et une durée très longue, la cémentite peut se décomposer en graphite.
La présence aussi du silicium peut favoriser la décomposition de la cémentite (formation du
graphite). On a donc l'existence de deux diagrammes d'équilibres :
a. Le diagramme fer-cémentite
Le diagramme d'équilibre métastable Fe-Fe3C (cémentite) est caractérisé par la présence de
cémentite Fe3C, correspond aux aciers et aux fontes blanches. Il représente la composition
des phases et la structure des alliages dont la concentration varie du fer pur à la cémentite. La
cémentite correspond à 6,67 % de carbone. Ce diagramme se présente comme suit :
b. Le diagramme fer-graphite
Le diagramme d'équilibre stable fer-graphite est caractérisé par la présence de carbone libre
C correspondant aux fontes grises, produits titrant au moins 2% de carbone. Il ressemble
beaucoup au précédent, cependant la verticale du solidus correspondant à la cémentite (à
6,67% de carbone) n'existant plus, le diagramme se poursuit jusqu'au carbone pur: dans
l'analyse précédente, il suffit donc de remplacer le terme cémentite par graphite, mais l'étude
se limite aux faibles teneurs en carbone.
Mécanique et Automatismes Industriels Page 11
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Dans la suite de l’exposé, nous nous limiterons à l’étude du diagramme fer-cémentite.
2. Conditions d’utilisation
Ces diagrammes ne sont valables en toute rigueur que pour les alliages formés
exclusivement de fer et de carbone. Si un ou plusieurs éléments interviennent en faible
proportion, le diagramme obtenu reste très voisin du diagramme théorique. C’est ainsi que
l’on peut utiliser le diagramme fer-carbone pour les aciers ordinaires. Mais si la proportion
de l’élément étranger augmente, le diagramme peut être profondément modifié.
A. DIAGRAMME FER-CEMENTITE
1. Présentation
Mécanique et Automatismes Industriels Page 12
DIAGRAMME FER-CARBONE / FER-CEMENTITE
2. Définition des constituants micrographiques
a. La ferrite
C’est une solution solide de carbone dans le fer , c'est à dire que la ferrite est constituée
par du fer renfermant des traces de carbone (faible teneur en carbone, inférieure à 0,02 %),
ainsi que d'autres inclusions.
On distingue la ferrite à basse température et à solubilité du carbone allant jusqu'à 0,02 %
et la ferrite à haute température et à solubilité limite en carbone allant jusqu'à 0,1 %. La
ferrite est peu tendre et très ductile. Elle est magnétique à température ordinaire, au
microscope la ferrite a l'aspect de grains homogènes polyédriques. Elle est ferromagnétique
jusqu'à 760°C, c’est-à-dire qu’elle possède une aimantation permanente même en l’absence de
champ magnétique extérieur.
b. L'austénite
C’est une solution solide de carbone et d’autres inclusions dans le fer γ, La solubilité limite
du carbone dans le fer γ est de 2,14 %. L'austénite est stable à haute température, elle est peu
dure est relativement malléable. La microstructure de l'austénite est composée de grains
polyédriques. Elle peut exister à la température ambiante que dans un état métastable. Elle est
antiferromagnétique c’est-à-dire que son aimantation magnétique est nulle.
c. La cémentite
Selon le diagramme Fe-Fe3C et lors du refroidissement, la cémentite peut exister sous trois
différentes formes de liaisons mais avec la même composition chimique.
DESIGNATION OBTENTION PAR
Cémentite primaire Cristallisation du métal liquide suivant la ligne CD
Cémentite secondaire Ségrégation à partir de l’austénite suivant la ligne ES
Cémentite tertiaire Ségrégation à partir de la ferrite suivant la ligne PQ
d. La perlite
C'est un eutectoïde formé d'un mélange de grains de cémentite sphéroïdaux noyés dans la
ferrite globulaire en couches alternées (88 % de ferrite et 12 % de cémentite). Elle est obtenue
lors du refroidissement et par décomposition de l'austénite à 0,8 % de carbone.
Elle présente dans l’acier ordinaire toujours une teneur en carbone de 0,85 %. La perlite est
dure et assez ductile.
Mécanique et Automatismes Industriels Page 13
DIAGRAMME FER-CARBONE / FER-CEMENTITE
e. Le lédéburite I
C’est un mélange eutectique entre l'austénite et la cémentite et provenant lors du
refroidissement du métal liquide avec 4,3 % de carbone à la température eutectique.
Le lédéburite I contient 51,4 % d'austénite et 48,6 % de cémentite et peut contenir 2,06 à
6,67% de carbone. Son domaine de stabilité est 723°C à 1147°C.
f. Le lédéburite II
Le lédéburite ll provient durant le refroidissement du lédéburite I par décomposition
eutectoïdale du composant contenant 51,4 % d'austénite en perlite à la température de 723°C.
Le lédéburite II contient 51,4 % de perlite et 48,6 % de cémentite.
Durant la solidification des alliages de fer et de carbone, il y a lieu trois types de
transformations isothermiques, il s'agit des réactions péritectiques, eutectiques et eutectoïdes.
3. Les points et lignes caractéristiques du diagramme
Mécanique et Automatismes Industriels Page 14
DIAGRAMME FER-CARBONE / FER-CEMENTITE
a. Les points du diagramme
Ils sont donnés dans le tableau ci-après :
POINTS CORRESPONDANCES TEMPERATURE (°C) % DE CARBONE
A Fusion du fer pur 1538 0
Phase liquide en équilibre avec la
B ferrite δ et l'austénite à la température 1493 0,51
péritectique
Transformation eutectique à la
C 1147 4,30
température
D Fission de la cémentite 1392 6.67
Teneur limite du carbone dans
E 1147 2,1
l'austénite à la température eutectique
F - 1147 6,67
G - 906 0
Teneur limite du carbone dans la
H 1493 0,10
ferrite
L'austénite à la température
J 1499 0,16
péritectique
K - 723 6,67
M - 760 0
Transformation polymorphe
N 1392 0
réciproque ferrite-austénite (δ-γ)
Teneur limite dans la ferrite à la
P 721 0,02
température eutéctoïde
Q - 20 0,006
L'austénite à la température
S 721 0,8
eutectoïde
C’ - 1147 4,30
E’ - 1153 2,03
S’ - 727 0,69
b. Les lignes caractéristiques
Les lignes du diagramme d'équilibre Fe-Fe3C qui déterminent le processus de cristallisation
ont la notation et le sens physique suivant :
LIGNES CORRESPONDANCES
Liquidus qui matérialise la température de début de cristallisation de la ferrite δ
AB
à partir de l'alliage liquide
Limite supérieure intérieure de la coexistence des deux phases ferrite δ et
NH et NJ
austénite (A)
Mécanique et Automatismes Industriels Page 15
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Liquidus qui marque le début de cristallisation de l'austénite A à partir de
BC
l’alliage liquide
Liquidus correspondant au début de cristallisation de la cémentite primaire
CD
(Cml) à partir de l'alliage liquide
Ligne de solidus traduisant les températures délimitant le domaine de l'alliage
AH liquide et les cristaux Fe δ. Au-dessous existent uniquement les cristaux de
ferrite δ
Ligne de transformation péritectique (T = 1499°C, C = constante), A la
température inférieure à 1499°C, on a l'amorce de la réaction péritectique
HJB
(interaction du liquide de composition B avec les cristaux de fonte δ de
composition H dégage de l'austénite de composition I
ECF Cette ligne correspond à la cristallisation de l'eutectique appelé lédéburite (Lb)
ABCD représente donc la ligne liquidus au-dessus de laquelle tous les alliages sont à l'état
liquide, et AHJECF représente la ligne de solidus en-dessous de laquelle tous les alliages se
trouvent à l'état cristallin (solide).
c. Les points de transformations
Les points de transformations des aciers jouent un rôle prédominant dans la détermination
des températures des traitements thermiques (trempe, revenu, recuit et cémentation).
Ces points sont notés par A0, A1, A2, A3 et Acm, lors du chauffage ou du refroidissement sont
notés respectivement par AC0, AC1, AC2, AC3 et ACCm et Ar0, Ar1, Ar2, Ar3 et ArCm.
A0 : (T = 210°C) correspond à la transformation lors du chauffage de la cémentite
ferromagnétique en cémentite non magnétique.
A1 : (T = 727°C) correspond à la transformation réversible perlite –austénite.
A2 : point de curie (T = 769°C), au-dessus de cette température le fer perd ses propriétés
magnétiques, cette température est marquée par ligne MO.
A3 : correspond aux températures associées à la ligne SE (Cm est le symbole abrégé de la
cémentite)
Donc les lignes GOS et SE représentent le lieu des points A3 et Acm définissant des
températures variables.
4. Les transformations
a. La transformation péritectique
Durant le refroidissement des alliages titrant de 0,1 à 0,51 % de carbone, se précipite la
ferrite (F) suivant la ligne AB. A la température de 1493°C, il y a interaction péritectique
des cristaux (0,1 % C) avec le reste du liquide de composition B (0,51 % C), (LB), en
formant l’austénite de composition I (0,16 % C) selon la réaction péritectique :
Mécanique et Automatismes Industriels Page 16
DIAGRAMME FER-CARBONE / FER-CEMENTITE
b. La transformation eutectique
Les alliages liquides titrant de 2,06 à 6,67 % C se solidifient suivant la ligne BC en donnant
de l’austénite primaire suivant la ligne CD en donnant la cémentite primaire.
A la température eutectique de 1147°C, se décompose le liquide eutectique restant (4,3%C)
en austénite (2,06 % C) et cémentite (6,67 % C) selon la réaction eutectique :
Le mélange formé d’austénite (E) et de cémentite (F) est appelé lédéburite selon le nom du
métallurgiste allemand Ledebur.
c. La transformation eutectoïde
A la température eutectoïde de 723°C se décompose l’austénite eutectoïde titrant 0,8%C en
formant la ferrite avec 0,02 % C et la cémentite secondaire avec 6,67 % C (Fe3C(K)) suivant
la réaction eutectoïde :
Le mélange constitué de ferrite et de cémentite Fe3C s’appelle perlite.
5. Principe de lecture du diagramme
Les différentes règles de lecture que nous présenterons dans cette partie s’appliquent dans
n’importe quel domaine biphasé de n’importe quel diagramme d’équilibre binaire.
a. Règle des phases - Domaine biphasé
A l’équilibre, le nombre V de variables indépendantes est fixé par l’équation de GIBBS : la
variance ou le degré de liberté V = N – P + 2 avec
N = nombre de constituants
P = nombre de phases
2 = ce chiffre représente la température et la pression
Dans les systèmes qui nous intéressent, l’influence de la pression est négligeable. Ainsi nous
avons V = N – P + 1. On a donc, en fonction de N, dans un système biphasé V = 3 – P.
Dans un domaine biphasé, la règle des phases nous donne V = 3 – 2 ; V = 1 si la température
est fixée arbitrairement.
Mécanique et Automatismes Industriels Page 17
DIAGRAMME FER-CARBONE / FER-CEMENTITE
b. La règle de l’horizontale
A une température T donnée, les compositions des phases liquide et solide en présence sont
données par les abscisses des points d’intercession de l’horizontale (de la température T)
correspondant avec le liquidus et le solidus. On obtient ainsi la composition, en pourcentage,
de l’alliage à la température T.
c. La règle des segments inverses
Soit un mélange A-B de composition initiale C0 pris à la température T. la composition de
la phase liquide est CL et celle de la phase solide est CS. Soit FL et FS les proportions relatives
du liquide et du solide de ce mélange.
La conservation de la masse totale de l’alliage permet d’écrire :
FL + FS = 1 d’où FS = 1 - FL
(FL*CL) + (FS*CS) = C0 FL*CL + CS - CS*FL = C0 FL*(CL - CS) = C0 - CS
Le problème est équivalent à celui qui consiste à équilibrer une balance.
C0 - CS CL - CS
M P N
MLiquide
MSolide
L’équilibre est réalisé pour :
B. TRANSFORMATION DES ACIERS ET FONTES
1. Généralités
Les alliages à teneur en carbone inférieure ou égale à 2 %C s'appellent aciers et ceux dont
la teneur en carbone est comprise entre 2 et 6.67 %C s'appellent fontes. Cette délimitation
coïncide avec la solubilité limite du carbone dans l'austénite. L'austénite possède une structure
très plastique, ce qui rend les aciers malléables tandis que les fontes possèdent de bonnes
Mécanique et Automatismes Industriels Page 18
DIAGRAMME FER-CARBONE / FER-CEMENTITE
propriétés de fonderie, un point de fusion plus bas et des retraits plus petits dus à la présence
dans la structure du composant eutectique lédéburite.
Selon le pourcentage de carbone, nous avons :
Aciers hypoeutectoïdes %C < 0.8
Aciers eutectoïdes %C = 0.8
Aciers hypereutectoïdes %C > 0.8
Fontes hypoeutectiques %C < 4.3
Fontes eutectoïdes %C = 4.3
Fontes hypereutectiques 4.3 < %C < 6.67
a. Les aciers
A titre d’exemple, nous pouvons citer :
Les aciers à 0,05 % C : Lorsque la ligne liquidus est atteinte, il y a précipitation des cristaux
primaires Fe dans l’alliage liquide. Après dépassement de la ligne solidus AH (T=1510°C),
la totalité de l’alliage est solidifié et se compose de Fe. A la température 1440°C (ligne NH),
commence la transformation de la ferrite Fe en austénite (γ) pauvre en carbone et selon la
réaction :
La figure ci-dessous montre la structure de l’acier à 0,05 % C et à la température ambiante
(agrandissement x 100). A côté des cristaux de ferrite clairs, on peut distinguer les taches
sombres dans les joints de grains de Fe, représentant la perlite et à l’intérieur des grains de
Fe, les taches sombres représentant la scorie restant dans l'acier.
Les aciers à 0,80 % C : La cristallisation primaire de cet acier s’effectue comme celle de
l'acier à 0,60% C et la cristallisation secondaire s’effectue sans transformation de la ferrite, à
partir de l’austénite. Il y a transformation eutectoïde directe de l’austénite en perlite. La figure
ci-dessous, montre la structure métallographique (perlite pure) de l’acier eutectoïde.
Mécanique et Automatismes Industriels Page 19
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Les aciers à 0.90% C : La figure ci-dessous montre la structure de cet acier, lequel a été
trempé durant 10 heures à T = 700°C.
b. Les fontes
Dans la fonte, une partie du carbone dissous à l’état solide se précipite sous forme de
graphite ou de carbure. Plusieurs types de fontes existent.
La fonte blanche (sans graphite) : La solidification et le refroidissement s’opèrent
suivant le diagramme fer-cémentite. En fonction de la teneur en carbone par rapport à
l’eutectique, l’on distingue les fontes blanches hypoeutectoïde (3 < %C < 4.3) et les fontes
blanches hypereutectoïde.
La fonte grise : La plupart du carbone se trouve sous forme de lamelles de graphite. Le
pourcentage en carbone de la matrice dépendra de la vitesse de refroidissement. Si la
vitesse de refroidissement est très lente, tout le refroidissement depuis l’état liquide
s’opérera en suivant le diagramme fer-graphite : la structure finale sera de type ferrite-
graphite. Si on augmente la vitesse de refroidissement, la solidification commencera
suivant le diagramme fer-graphite puis se poursuivra selon le diagramme fer-cémentite.
Dans ce cas, on obtiendra de la ferrite et de la lédéburite. On distingue, en fonction de la
teneur en carbone par rapport à l’eutectique, les fontes grises hypoeutectoïde (%C = 3) et
les fontes grises hypereutectoïde (%C = 5).
2. Désignation normalisée
a. Les aciers
Classification par emploi
La désignation commence par la lettre S pour les aciers d’usage général et par la lettre E
pour aciers de construction mécanique. Le nombre qui suit indique la valeur minimale de la
limite d’élasticité (en mégapascals). S’il s’agit d’un acier moulé, la désignation est précédée
de la lettre G.
Exemple : S 235, GE 295
Mécanique et Automatismes Industriels Page 20
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Classification par composition chimique
Acier non alliés : teneur en manganèse inférieure à 1%. La désignation se compose de la
lettre C suivie du pourcentage de la teneur moyenne en carbone multipliéé par 100.
Exemple : C 40 avec 40 = 0.40% de carbone
Aciers faiblement alliés : teneur en manganèse supérieure ou égale à 1% et teneur de chaque
élément d’alliage inférieure à 5%. La désignation comprend dans l’ordre :
Un nombre entier, égal à cent fois le pourcetage de la teneur moyenne en carbone
Un ou plusieures groupes de lettres qui sont les symboles chimiques des éléments
d’addition rangés dans l’ordre des teneures décroissantes
Une suite de nombres rangés dans le même ordre que les élélments d’alliage, et indiquant
le pourcentage de la teneur moyenne de chaque élément
Les teneurs sont multipliées par un coeficient multiplicateur variable en fonction des éléments
d’alliage (voir tableau ci-après).
COEFICIENT MULTIPLICATEUR
Elément d’alliage Coef Eléme,t d’alliage Coef
Cr, Co, Mn, Ni, Si, W 4 Ce, N, P, S 100
Al, Be, Cu, Mo, Nb, Pb, Ta, Tl, V, Z 10 B 1000
Exemples : 55 Cr 3 correspond à 0.55% de C ; 0.75 % de chrome (3/4=0.75)
51 Cr V4 correspond à 0.51 % de C ; 1% de chrome (4/4=1), pour cette désignétion, le
pourcentage de vanadium n’est pas précisé.
Aciers fortement alliés : teneur d’au moins un élément d’alliage supérireure ou egale à 5%.
La désignation commence par la lettre X suivie de la même désignation que celle des aciers
faiblement alliés, à l’exeption des valeus des teneurs qui sont des pourcentages nominaux
réels.
Exemple : X 55 Cr 30 corespond à 0.30% de C ; 13% de chrome
Aciers rapides : La désignation comprend successivement les symboles suivants :
Les lettres HS
Les nombres indiquants les valeurs des élélments d’alliage dans l’ordre suivant :
Tungsrène (W), Molybdène (Mo), Vanadium (V), Cobalt (Co).
Chaque nombre répresente la teneur moyenne.
Exemple : HS 8.5-3.5-3.5-5-11 correspond à 8.5% de tungstène, 3.5% de molybdène, 3.5% de
vanadium, 11% de cobalt.
Mécanique et Automatismes Industriels Page 21
DIAGRAMME FER-CARBONE / FER-CEMENTITE
b. Les fontes
Fontes à graphite lamellaire : après le prefixe EN, les fontes sont désignées par le symbole
GJL suivi de la valeur en mégapascas de la resistance minimale à la rupture par extension.
Exemple : EN-GJL 100
Fontes maleables à graphite shéroïdale : après le prefixe EN, les fontes sont désignées par
le symbole (GJMW, GJMB, GJS) suivi de la valeur en mégapascas de la resistance minimale
à la rupture par extension et du pourcentage de l’allongement après rupture.
Exemple : EN-GJS-350-22
Mécanique et Automatismes Industriels Page 22
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Mécanique et Automatismes Industriels Page 23
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Comme application, nous citerons à titre d'exemple trois grands domaines de la métallurgie
où l'utilisation de ces diagrammes est indispensable pour obtenir rapidement l'objectif à
atteindre
L'élaboration (fonderie, frittage)
Les traitements thermiques (mise en solution, transformations structurales, recuits)
L'assemblage (brasage, soudage).
1. En fonderie et en traitement thermique
Ces diagrammes sont d'une importance fondamentale. Le fondeur peut en tirer les
informations suivantes :
La température minimale à laquelle il faut chauffer un alliage donné pour qu'il soit
totalement liquide,
La nature des transformations susceptibles de se produire, ou d'être partiellement
escamotées,
La température de fin de solidification minimale dans le cas de la diffusion nulle dans
le solide, sachant que la fin de solidification, selon la vitesse de refroidissement, sera
intermédiaire entre cette température minimale et la température théorique donnée par
le diagramme d'équilibre pour l'alliage considéré,
La nature des phases formées et les caractéristiques mécaniques associées (cas des
composés intermétalliques fragiles...) pour un alliage donné,
Quelle composition choisir pour obtenir les caractéristiques voulues (liées à la nature
des phases formées), ou pour éviter la formation de composés indésirables...
La composition des alliages à bas point de fusion avantageux en fonderie
Les diagrammes sont aussi d'une grande utilité dans le domaine des traitements thermiques
c'est-à-dire des transformations à l'état solide.
2. Dans le domaine de l'assemblage des métaux
Ils fournissent aussi des informations précieuses.
a. Cas du brasage
Ils vont permettre :
De définir la composition des alliages susceptibles d'être utilisés comme métal
d'apport,
De préciser, connaissant la composition du métal d'apport, la température minimale à
laquelle il faudra braser les pièces,
D'indiquer la nature des phases susceptibles de se former entre le métal d'apport et le
métal de base.
b. Cas du soudage hétérogène
Mécanique et Automatismes Industriels Page 24
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Lorsque l'on veut assembler par soudage deux pièces de nature différente, le problème
métallurgique est similaire à celui rencontré avec le brasage en ce qui concerne la nature des
phases qui vont se former entre les deux métaux et les propriétés qui en découlent: la
connaissance des diagrammes est l'un des éléments indispensables pour prévoir le
comportement de la soudure. Si les deux matériaux ont des points de fusion très différents,
des problèmes technologiques s'ajouteront pour les procédés de soudage classique.
Le "soudage diffusion" qui est un procédé d'assemblage à l'état solide permet de s'affranchir
de ce dernier problème. Il permet aussi de résoudre souvent le problème de l'incompatibilité
métallurgique des matériaux à assembler, c'est à dire la formation de composés
intermétalliques fragiles dans l'interface. Pour réaliser une jonction exempte de phases
fragiles, il faut interposer, entre les deux pièces, des couches (feuillards ou dépôts) de métaux
compatibles deux à deux avec leurs voisins immédiats. Le choix de ces intermédiaires ne peut
se faire qu'en consultant les différents diagrammes d'équilibre: seuls les métaux ne formant
pas de phases intermétalliques avec leurs voisins immédiats peuvent convenir.
Mécanique et Automatismes Industriels Page 25
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Cet exposé nous a permis de comprendre que la connaissance des diagrammes de phase est
un outil de base pour le métallurgiste et le métallographe. Ceux-ci renseignent en effet sur :
Les types de transformations qui doivent se produire pendant la solidification et le
refroidissement du solide (ou inversement au chauffage)
Les températures de début et de fin de transformation
La nature des phases en présence
La composition de ces phases à l'équilibre
La proportion des phases présentes à une température donnée (règle des segments
inverses ou règle de l’horizontale appliquée sur les concentrations exprimées en masse %).
Notons aussi que les diagrammes binaires ne peuvent comporter que des domaines étendus à
une ou deux phases. La coexistence de trois phases n’est possible que lors d'une réaction de
type eutectique, péritectique, eutectoïde ou péritectoïde. Il y a donc toujours alternance des
domaines monophasés et biphasés.
L’intérêt de cette étude réside dans le fait qu’elle a été pour nous une opportunité de
concrétiser nos connaissances sur la solidification des métaux, et de savoir lire et utiliser les
diagrammes d’équilibre.
Mécanique et Automatismes Industriels Page 26
DIAGRAMME FER-CARBONE / FER-CEMENTITE
Documents techniques
André CHEVALIER, 2004. Guide du dessinateur industriel. Hachette Technique,
Page 324-326
Dr DAGO Gnassé Leon, 2008. Cour de metallurgie. Chapitre III
Martine HOURCADE. Les diagrammes d’équilibre binaires ou diagrammes de
phases
Encarta Junior, 2009. Sciences et techniques-la physique-la mécanique-le fer / le
carbone.
Webographie
http://search.mywebsearch.com/mywebsearch/GGmain.jhtml?searchfor=digramme+fe
r-carbone&st=kwd
http://www.mywebsearch.com/jsp/cfg_redir2.jsp?id=ZCfox000&fl=0&ptb=mT7AtqN
HuHEbFmChzK9ueQ&url=http://search.mywebsearch.com/mywebsearch/dft_redir.jh
tml&st=kwd&searchfor=diagramma+binaire
Mécanique et Automatismes Industriels Page 27
DIAGRAMME FER-CARBONE / FER-CEMENTITE
A. Structure micrographique de quelques aciers et fontes
B. Diagramme d’équilibre fer-cémentite
Mécanique et Automatismes Industriels Page 28
DIAGRAMME FER-CARBONE / FER-CEMENTITE
A. Structure micrographique de quelques aciers et fontes
Mécanique et Automatismes Industriels Page 29
DIAGRAMME FER-CARBONE / FER-CEMENTITE
B. Diagrammes d’équilibre fer-cémentite
Mécanique et Automatismes Industriels Page 30
Vous aimerez peut-être aussi
- Fascicule de Problemes de Materiaux MetalliquesDocument27 pagesFascicule de Problemes de Materiaux MetalliquesSam100% (5)
- Rapport D'analyse MétallographiqueDocument18 pagesRapport D'analyse Métallographiquebelkacem100% (1)
- TD Matériaux TRCDocument3 pagesTD Matériaux TRCbino100% (1)
- Cours FsaDocument10 pagesCours FsaAfafLamzaitiPas encore d'évaluation
- Corrigé Type TD 1+2+3Document4 pagesCorrigé Type TD 1+2+3Wallah Bakary100% (4)
- Los SolventesDocument134 pagesLos SolventesBrennosPas encore d'évaluation
- Chapitre 3 Etude Du Diagramme Fer Carbone ConvertiDocument14 pagesChapitre 3 Etude Du Diagramme Fer Carbone ConvertiSkanderPas encore d'évaluation
- Cours - 02 Diagramme Fer-CarboneDocument14 pagesCours - 02 Diagramme Fer-CarbonePascal Diassana100% (2)
- Diagramme Fe Fe3CDocument15 pagesDiagramme Fe Fe3CRuroniPas encore d'évaluation
- DiagFe CDocument18 pagesDiagFe Cnnkknn100% (5)
- Chapitre 3 Etude Du Diagramme Fer Carbone 170322102221Document15 pagesChapitre 3 Etude Du Diagramme Fer Carbone 170322102221MohamedAyoubPas encore d'évaluation
- Les FontesDocument13 pagesLes FontesMargareta Galaju100% (3)
- Fer CarboneDocument22 pagesFer CarboneMAMI Mourad100% (1)
- 2 Elaboration Des Metaux FerreuxDocument55 pages2 Elaboration Des Metaux FerreuxZakari YaePas encore d'évaluation
- Cours de Materiaux Metalliques (1 Année Licence Appliquée Génie Mécanique)Document5 pagesCours de Materiaux Metalliques (1 Année Licence Appliquée Génie Mécanique)Walid Ben AmirPas encore d'évaluation
- Thèse PDFDocument147 pagesThèse PDFfaouzi sellaliPas encore d'évaluation
- TP1Document12 pagesTP1Firass ChafaiPas encore d'évaluation
- Chapitre 3 Diagramme Fer CarboneDocument23 pagesChapitre 3 Diagramme Fer CarboneNariman Narou100% (1)
- Manipulation 4 Revenu Des AciersDocument3 pagesManipulation 4 Revenu Des Aciershidouriabdelmoumen9802100% (1)
- Fabrication de L'acierDocument3 pagesFabrication de L'acierkhaled bouzidi0% (1)
- Tp-3-Trempe-Des-Aciers (C45 Trés Important)Document12 pagesTp-3-Trempe-Des-Aciers (C45 Trés Important)Mouna Kallel100% (2)
- Traitement Thermique FinDocument11 pagesTraitement Thermique Finprof.stm.stePas encore d'évaluation
- Traitements Thermiques Des Métaux: - Les Traitements de Durcissement - Les Traitements D'adoucissementDocument12 pagesTraitements Thermiques Des Métaux: - Les Traitements de Durcissement - Les Traitements D'adoucissementJàMàl MejorPas encore d'évaluation
- DS MS 2021Document6 pagesDS MS 2021Yassine El Idrissi100% (1)
- TPE Matériaux Métalliques: Encadré Par: M. Salah MEZLINI Elaboré Par: Ala BEN SALAH Souha Abdellaoui Groupe: 1Document5 pagesTPE Matériaux Métalliques: Encadré Par: M. Salah MEZLINI Elaboré Par: Ala BEN SALAH Souha Abdellaoui Groupe: 1Derouich Rahma100% (1)
- Chapitre I Metallurgie Des Poudres I.1 Généralités, DéfinitionsDocument3 pagesChapitre I Metallurgie Des Poudres I.1 Généralités, Définitionsaziz zaouiPas encore d'évaluation
- Application Diagramme D Quilibre SDMDocument1 pageApplication Diagramme D Quilibre SDMBø ÑyPas encore d'évaluation
- Structures Metallographiques Des AciersDocument4 pagesStructures Metallographiques Des Aciersmichel_bnjPas encore d'évaluation
- Metallurgie de LaluminiumDocument9 pagesMetallurgie de LaluminiumKorichiKarimPas encore d'évaluation
- L1-PMI-GIM - TD 3 Matériaux 2 Correction - TextMarkDocument4 pagesL1-PMI-GIM - TD 3 Matériaux 2 Correction - TextMarkziiz ziziPas encore d'évaluation
- Elements de ReponsesDocument9 pagesElements de Reponsesjaouya100% (1)
- Cours SDMDocument4 pagesCours SDMKhaled Gammoudi100% (3)
- CH 1 Diagrammes D'equilibres Métalliques (v1.1)Document10 pagesCH 1 Diagrammes D'equilibres Métalliques (v1.1)Chokri AtefPas encore d'évaluation
- Sujet Dexamen Et CorrigeDocument4 pagesSujet Dexamen Et CorrigeaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaaPas encore d'évaluation
- Les Matériaux MétalliquesDocument25 pagesLes Matériaux MétalliquesLOUkmen BelPas encore d'évaluation
- TD 1 Métallurgie StructuraleDocument5 pagesTD 1 Métallurgie StructuraleOussama SalHiPas encore d'évaluation
- TP 1Document6 pagesTP 1Ramzi Ayadi100% (1)
- Traitements Thermiques Dans La MasseDocument26 pagesTraitements Thermiques Dans La MasseftiraPas encore d'évaluation
- TP Métallographie 2021Document16 pagesTP Métallographie 2021aymenPas encore d'évaluation
- Caractérisation MétallographiqueDocument7 pagesCaractérisation MétallographiqueNefaa Sayar100% (2)
- Chapitre 4 Les Transformations A Etat Solide Des Alliages Fe CDocument24 pagesChapitre 4 Les Transformations A Etat Solide Des Alliages Fe CChokri AtefPas encore d'évaluation
- TD. Transformations de Phases - CopieDocument9 pagesTD. Transformations de Phases - CopieWalid Ben AmirPas encore d'évaluation
- Traitements ThermiqueDocument8 pagesTraitements ThermiqueKarla SaraPas encore d'évaluation
- Traitement Thermique API2 - 2020Document45 pagesTraitement Thermique API2 - 2020Yasser Lamyasser100% (2)
- Microstructures Et MétallographieDocument14 pagesMicrostructures Et Métallographielaz_k100% (1)
- Diagramme TTT & TRCDocument22 pagesDiagramme TTT & TRCMohamed Lalioui100% (3)
- Chapitre2 Diagramme de PhaseDocument22 pagesChapitre2 Diagramme de PhaseOussama El BouadiPas encore d'évaluation
- Exercice AcierDocument5 pagesExercice AcierWalid Ben Amir50% (2)
- Cours de Sidérurgie 1er Master 2016-2017Document140 pagesCours de Sidérurgie 1er Master 2016-2017Reagan Busangu100% (1)
- Cours Matériaux Et Structures Partie 2 PDFDocument35 pagesCours Matériaux Et Structures Partie 2 PDFMoudi Bouhlel100% (1)
- Chapitre 4 Diagramme Equilibre BinaireDocument14 pagesChapitre 4 Diagramme Equilibre BinairewafikPas encore d'évaluation
- Aaaaa PDFDocument50 pagesAaaaa PDFKim Palacio100% (2)
- Manipulation 1 Micrographie Et MacrographieDocument4 pagesManipulation 1 Micrographie Et Macrographiehidouriabdelmoumen980267% (3)
- TP MétallurgieDocument20 pagesTP MétallurgieSoraya BouslahPas encore d'évaluation
- Chapitre 2-P1-Aspects Thermique Et Chimique de Soudage PDFDocument12 pagesChapitre 2-P1-Aspects Thermique Et Chimique de Soudage PDFSourour Trabelsi100% (1)
- Materiaux MetalliquesDocument32 pagesMateriaux Metalliquesزهير مزريقيPas encore d'évaluation
- Cours N°2-Diagramme Fer CarboneDocument14 pagesCours N°2-Diagramme Fer CarboneDamienPas encore d'évaluation
- Chapitre 6 Diagramme Fer CarbonneDocument11 pagesChapitre 6 Diagramme Fer CarbonneDhiflaoui SaifPas encore d'évaluation
- 4 Diagramme Fer Carbone 36 PagesDocument36 pages4 Diagramme Fer Carbone 36 Pagesaziz zaouiPas encore d'évaluation
- Chap II - Les Différents Classes Des MatériauxDocument180 pagesChap II - Les Différents Classes Des Matériauxomarmarri2016Pas encore d'évaluation
- Metallurgie SecondaireDocument35 pagesMetallurgie Secondairelina.mrj123Pas encore d'évaluation
- II - Alliages Ferreux - Aciers & FontesDocument154 pagesII - Alliages Ferreux - Aciers & FontesTimo ShmittPas encore d'évaluation
- Sciences Des MateriauxDocument9 pagesSciences Des MateriauxAdel ZitouniPas encore d'évaluation
- 2ndes Seq 5Document2 pages2ndes Seq 5dayangPas encore d'évaluation
- 1ER devoir d'auto trimestre1 2024-2025Document1 page1ER devoir d'auto trimestre1 2024-2025dayangPas encore d'évaluation
- Implémentation Des Arrêtés 238 Et 239Document2 pagesImplémentation Des Arrêtés 238 Et 239dayang100% (1)
- 4 ProgrammeDocument3 pages4 ProgrammedayangPas encore d'évaluation
- Fiche DaserDocument4 pagesFiche DaserdayangPas encore d'évaluation
- TableurDocument24 pagesTableurdayangPas encore d'évaluation
- 0284 Cours Developpement LogicielDocument58 pages0284 Cours Developpement LogicieldayangPas encore d'évaluation
- TD Elec NumDocument10 pagesTD Elec NumdayangPas encore d'évaluation
- E Algebre PDFDocument4 pagesE Algebre PDFdayangPas encore d'évaluation
- Le Traitement de Texte Word PDFDocument25 pagesLe Traitement de Texte Word PDFdayangPas encore d'évaluation
- Soudage 3Document13 pagesSoudage 3dayangPas encore d'évaluation
- Premier Devoir D'auto 2nd Trimestre 2019-2020 2 Pages Par FeuilleDocument1 pagePremier Devoir D'auto 2nd Trimestre 2019-2020 2 Pages Par FeuilledayangPas encore d'évaluation
- DistributeursDocument7 pagesDistributeursdayangPas encore d'évaluation
- Révision Équilibre Chimique CorrectionDocument10 pagesRévision Équilibre Chimique CorrectionchadaPas encore d'évaluation
- TP MostecDocument78 pagesTP MostecRached MairchiPas encore d'évaluation
- Mémore de LicenceDocument61 pagesMémore de LicenceMed Ben Ahmed100% (4)
- Examen Normale (18-19)Document3 pagesExamen Normale (18-19)Khlid100% (2)
- Expose de BacteriologieDocument9 pagesExpose de Bacteriologiemelchyzue069Pas encore d'évaluation
- Notion D'éclairageDocument7 pagesNotion D'éclairageGiscard TabetPas encore d'évaluation
- 6-Retrait VolumiqueDocument5 pages6-Retrait VolumiquePierre MackenziePas encore d'évaluation
- 2.bioener Metab RegulDocument140 pages2.bioener Metab RegulKenza Kassab100% (1)
- CS-GT-009 R.00Document2 pagesCS-GT-009 R.00Massimo FumarolaPas encore d'évaluation
- 1ere Seance 14 Sept2017 Diagbin Introd. Gle Diagr. Unaires 1Document22 pages1ere Seance 14 Sept2017 Diagbin Introd. Gle Diagr. Unaires 1ZerPas encore d'évaluation
- Annuaire Des Descripteurs Sciences Agronomiques Et EnvironnementDocument192 pagesAnnuaire Des Descripteurs Sciences Agronomiques Et EnvironnementNdiayePas encore d'évaluation
- Chap.2.Planchers MixtesDocument23 pagesChap.2.Planchers MixteslokaPas encore d'évaluation
- Exercices - Suivi Temporel D'une Transformation Chimique (PR AJAJI)Document8 pagesExercices - Suivi Temporel D'une Transformation Chimique (PR AJAJI)linacharif13Pas encore d'évaluation
- Les Systèmes de RestrictionDocument4 pagesLes Systèmes de Restrictiona.itatahinePas encore d'évaluation
- Exam-MEF M2M 2013 PDFDocument6 pagesExam-MEF M2M 2013 PDFHamza IguiPas encore d'évaluation
- Environ NementDocument29 pagesEnviron Nementhanae mPas encore d'évaluation
- Afnor: Avril 2003Document9 pagesAfnor: Avril 2003SAIB BRAHIMPas encore d'évaluation
- Amelioration de La Qualite Des - EL MEHROUS Hafsa - 3218 PDFDocument51 pagesAmelioration de La Qualite Des - EL MEHROUS Hafsa - 3218 PDFMohammed Mohammed BoujidaPas encore d'évaluation
- Physique Du Bâtiment PDFDocument53 pagesPhysique Du Bâtiment PDFRAMIPas encore d'évaluation
- DZ NP Sika Viscocrete 3045Document2 pagesDZ NP Sika Viscocrete 3045djadjPas encore d'évaluation
- 05-SA3 Réactions D'oxydo-RéductionDocument23 pages05-SA3 Réactions D'oxydo-RéductionberthouPas encore d'évaluation
- Résumé de CoursDocument119 pagesRésumé de CoursÑäḑ ĴoqĶễrPas encore d'évaluation
- 0 - Analyse de L'eau - Tests Rapides - 2016Document168 pages0 - Analyse de L'eau - Tests Rapides - 2016Sahar AkoumPas encore d'évaluation
- NUT Ra AGtransDocument221 pagesNUT Ra AGtransIlyas VoiceoverPas encore d'évaluation
- CHEM - TD 3.2 - Pont Mixte Isostatique - Corrigé - VADocument11 pagesCHEM - TD 3.2 - Pont Mixte Isostatique - Corrigé - VAMario100% (1)
- UTC105 THRMIQUE COURS e PDFDocument46 pagesUTC105 THRMIQUE COURS e PDFDavid BrouPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - 1ère AS (2010-2011) MR TIMOUMI MohamedDocument3 pagesDevoir de Contrôle N°1 - Physique - 1ère AS (2010-2011) MR TIMOUMI MohamedHanine HmidaPas encore d'évaluation