Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Transféré par
zineb fellaDroits d'auteur :
Formats disponibles
Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Transféré par
zineb fellaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Droits d'auteur :
Formats disponibles
Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Chromatographie Liquide - 2019-2020 3e Année Pharmacie
Transféré par
zineb fellaDroits d'auteur :
Formats disponibles
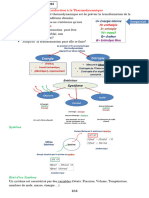
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
CHROMATOGRAPHIE LIQUIDE HAUTE PERFORMANCE
« CLHP - HPLC »
I. Introduction
Parmi les techniques chromatographiques dont la phase mobile est un liquide, la chromatographie
liquide haute performance (CLHP) est la plus connue.
II. PRINCIPE DE LA CHROMATOGRAPHIE LIQUIDE (CL)
Est une technique de séparation chromatographique fondée sur la distribution différentielle des
espèces entre deux phases non miscibles :
- Phase stationnaire : Silice vierge ou greffée, Polymère moléculaire, Échangeurs d’ions.
- Phase mobile : Solvant pur, Mélange de solvants
Chaque soluté se répartit entre les deux phases citées selon un coefficient de distribution de Nernst
«K»
K = CS/CM
CS : Concentration du soluté dans la phase stationnaire
CM : Concentration du soluté dans la phase mobile
III.CHROMATOGRAPHIE LIQUIDE HAUTE PERFORMANCE
III.1. Chromatographie d’adsorption
Phase stationnaire : Solide adsorbant polaire (ex: gel de silice , alumine) ou peu polaire (ex: charbon
actif)
Phase mobile : Solvant polaire (ex: méthanol) ou apolaire (ex: éther)
La rétention est due à une suite de processus d’adsorption /désorption du soluté
Phase mobile
Phase stationnaire
Soluté
Fig.1: Principe de la chromatographie d’adsorption
III.2. Chromatographie de partage
a. Principe :
Phase stationnaire : Liquide immobilisé sur un support inerte
Phase mobile : liquide
La rétention et la séparation sont basées sur :
✓ La différence de solubilité des solutés dans la phase mobile
✓ Les différences d’interactions des solutés avec la phase stationnaire
3e année Pharmacie 2019-2020 Page 1
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
b. Types :
1.Chromatographie de partage classique ou en phase normale (NPLC)
✓ Phase stationnaire est plus polaire que la phase mobile
✓ Phase mobile peu polaire ou apolaire (ex: isopropanol, hexane, acétate d’éthyle)
2.Chromatographie de partage à polarité de phase inversée (RPLC)
✓ Phase stationnaire moins polaire que la phase mobile
✓ Phase mobile polaire (ex: Acétonitril (ACN),méthanol)
IV. CONCEPTION GENERALE D’UN APPAREIL DE CLHP
Colonne
Logiciel
Système
d’injection
Réservoir
Phase mobile Echantillon
Pompes Détecteur
Effluent
(Déchet)
Fig.2: Schéma des différents composants d’un chromatographe pour HPLC
IV.1.Réservoirs de la phase mobile
Un ou plusieurs bouteilles (500 mL), en verre ou en acier inoxydable dans lequel plonge un tube avec
une extrémité filtrante en téflon.
Fig.3: Réservoirs de solvants Fig.4: filtre (acier inox ou téflon)
IV.2. Pompes
Toute installation de CLHP comporte au moins une pompe pour forcer le passage de la
phase mobile à travers la colonne chromatographique
Délivre la phase mobile en continu et à débit précis et constant :Débit : 0,01 à 10 ml/min ;Stabilité de
flux < 1% ;Pression maximale 350 bars
Généralement pilotées par informatique.
3e année Pharmacie 2019-2020 Page 2
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Permet de délivrer à débit constant :
✓ Eluant de composition fixe : mode isocratique
✓ Eluant de composition variable : mode gradient d’élution
Les pompes à piston alternative est l’un des systèmes de pompage les plus utilisés en C.L.H.P.
1er piston 2nd piston 2nd piston 1er piston
Fig.5: Principe de fonctionnement d’une pompe (binaire) à 2 pistons en série en HPLC
IV.3. Système d’injection
- La méthode la plus simple et la plus pratique d’introduire l’échantillon est le procédé d’injection
par boucles d’échantillonnage (vanne à 6 voix)
- Une vanne à boucle d’échantillonnage d’une capacité fixe :10, 20, 50,… µL
Position chargement de la Position injection dans
boucle « LOAD » la colonne « INJECT »
Fig.6: Vanne d’injection à six voies avec boucle d’échantillonnage pour HPLC
IV.4. Colonne chromatographique en CLHP
Fig.7: Colonnes en acier de longueurs et diamètres variables
• La colonne chromatographique est constituée d’:
✓ Un Support solide
3e année Pharmacie 2019-2020 Page 3
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
- Tube droit en acier inoxydable, ou en verre recouvert extérieurement par l’acier.
- Longueur : 5 à 30 cm
- Diamètre interne : 4 à 5 mm
✓ Un Contenant de remplissage
- Solide inerte (billes en verre, polymères poreux…)
- Rôle : fixation de la phase stationnaire
✓ Une Phase stationnaire
- Silice, polymère
• La colonne chromatographique est précédée d’une pré-colonne, courte (0.4 à 1 cm) de même
nature de phase stationnaire. Cette colonne de garde sert à retenir certaines impuretés et à
prolonger la durée de vie de la colonne principale en préservant ses performances.
Sens de l’élution
Colonne
précolonne analytique
R
R
DF DF DF
R : Raccord
DF : Disque fritté
Fig.8: colonne standard et pré-colonne de CLHP
IV.5. Phase stationnaire de HPLC de partage
IV.5.1. Gel de silice
Le gel de silice est un solide amorphe ayant pour formule de composition SiO 2 (H2O) n, de caractère
polaire, acide.
A la surface de la silice, on retrouve des groupes : silanols (-OH) , siloxanes (-O-)
Fig.9: Structure de gel de silice
Le gel de silice comporte des pores de tailles différentes
Il est préparé soit de :
1. Micro-sphères : microparticules sphériques d’un diamètre constant dans une même colonne
mais il en existe plusieurs types allant de 1 à 12 um.
Fig.10: Représentation d’une s tructure de gel silice Fig.11: Représentation d’une s tructure de gel silice
comporta nt des pores de diffusion répartis dans la comporta nt Particules poreuse en surface avec un noyau
tota l ité de la particule. non poreux.
3e année Pharmacie 2019-2020 Page 4
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
2. Monolithes : il s’agit d’un gel de silice formé d’une seule pièce dans la colonne même
Fig.12: Représentation détail de structure
d’un remplissage du type monolithique.
Les silices chromatographiques sont constituées de particules sphériques.Cette forme sphérique
offre une meilleure résistance mécanique et une moindre résistance à l’écoulement.
Fig.13: Si lice de forme irrégulière Fig.14: Si l ice de forme sphérique homogène
IV.5.2. Qualités et défauts du gel de silice
a. Qualités
✓ Surface spécifique importante
✓ Grande résistance mécanique
✓ Faible taille des particules (1.5 à 10 μm)
✓ Répartition granulométrique très étroite
✓ Particules sphériques
✓ Réactivité des groupements silanol (Si-OH)(Greffage)
b. Défauts
✓ Rétention des solutés basiques par échange d’ions due au caractère acide des silanols libres
ce qui induit des pics en traînée
✓ Solubilisation de la silice en milieu alcalin (pH > 7 )
IV.5.3. Gel de silice greffé
✓ La méthode de greffage la plus utilisée est la silanisation
✓ Réaction d’une organo-silane à fonction réactive X sur les groupements silanols du support
de silice par formation de liaison chimique covalente (pont siloxane)
OH CH3 OH CH3
Si - OH + X – Si – R Si – O – Si – R + H-X
O CH3 O CH3
X = ( Cl, OCH3 , OC2H5 )
Selon le radical « R » lors du greffage, résultent :
Phase stationnaire polaire
- Exp : (-diol, -cyanopropyl, aminopropyl,…)
3e année Pharmacie 2019-2020 Page 5
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
- Chromatographie liquide de partage en phase normale (NPLC)
Phase stationnaire apolaire
- Exp : (-alkyl, -phenyl,…)
- Chromatographie liquide de partage en phase inverse (RPLC)
Tableau 1: Exempl es de phase s tationnaires greffées
IV.5.4. End-capping
Les groupements silanols résiduels restants libres sont réduits par un traitement au
triméthylchlorosilane (TMCS) qui est le plus petit silane, c’est le endcapping.
Le « end-capping » est généralement de caractère apolaire.
CH3
Cl – Si – CH3
CH3
TMCS
IV.6. Phase mobile
IV.6.1. Propriétés des solvants utilisés
✓ Inertie chimique vis-à-vis des solutés à analyser et insolubilité vis-à-vis de la phase stationnaire
✓ Pureté des solvants (Solvants grade HPLC)
✓ Des interactions soluté-solvant (Force intermoléculaire dipôle-dipôle ,Liaisons hydrogènes…)
✓ Viscosité de la phase mobile (Pas trop élevée)
✓ Compatibilité avec le système de détection
✓ Polarité des solvants :
a. L’énergie libre d’adsoption du solvant ( °)
La force éluante de la phase mobile varie avec l'énergie libre d’adsorption qui permet de contrôler la
rétention des solutés
Plus ( °) est élevée , plus la phase mobile est élutive et le facteur de rétention est faible
b.La polarité P’ d’un solvant
L’indice le plus utilisé pour décrire quantitativement la polarité d’un solvant en CL est l’indice de
polarité de Snyder.
Cette polarité est scindée en
✓ Xe : mesure le pouvoir accepteur de protons par rapport à l’éthanol
3e année Pharmacie 2019-2020 Page 6
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
✓ Xd : mesure le Pouvoir donneur de protons par rapport au Dioxane
✓ Xn : mesure le pouvoir à donner des interactions dipôle- dipôle par rapport au Nitrométhane
Pour chaque solvant, on a : (Xe + Xd + Xn = 1)
L’indice de polarité varie de (-2) pour les Fluoroalcanes trés peu polaires jusqu’à 10,2 pour l’eau qui
est trés polaire
IV.6.2. Choix des solvants
La phase mobile est constituée d’un ou de plusieurs solvants de polarités et rôles différents :
➢ Solvant de base de polarité inverse à celle de la phase stationnaire (peu élutif)
➢ Modificateur de polarité (proche de celle de la phase stationnaire) (trop élutif)
Fig. 15: Pouvoir d’élution de quelques solvant en NPLC et RPLC
IV.6.3. Contrôle du pH
Quand les solutés sont de nature acide ou basique, il devient nécessaire de contrôler le pH de la
phase mobile (milieu tamponné).
- Les acides sont analysés à un pH inférieur d’au moins 2 unités au pKa de l’espèce la plus acide.
- Les bases sont analysées à un pH supérieur d’au moins 2 unités au pKa de l’espèce la plus
basique.
Fig. 16: Influence du pH dans la séparation des composés
IV.6.4. Adjuvants de la phase mobile
Une phase mobile peut contenir des substances dissoutes, parmi lesquelles :
- Tampons acido-basiques (solutés acides ou bases faibles).
- Source de chlorures pour certains détecteurs électrochimiques.
- EDTA: dans le but de complexer les ions métalliques ( pouvant interférer lors de détection
électrochimique).
3e année Pharmacie 2019-2020 Page 7
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
IV.6.5. Solutions de rinçage
A la fin de toute analyse chromatographique, il est nécessaire de rincer la totalité du système en le
faisant traverser par une solution de rinçage composée généralement de:
- Un solvant organique pour éliminer les souillures apolaires.
- Un solvant polaire (eau) pour éliminer les souillures polaires.
La proportion de ces solvants est fixée en fonction de la nature de l’échantillon et de la structure des
solutés.
Afin d’éviter la prolifération microbienne pouvant obstruer les fines tubulures d’un système HPLC, il
est recommandé, à la fin de l’analyse, de plonger les tubulures dans un solvant organique.
IV.6.6. ORDRE D’ELUTION
✓ En NPLC : une substance apolaire est trop fortement éluée par la phase mobile
✓ En RPLC : une substance polaire est trop fortement éluée par la phase mobile
IV.6.7. Modes de travail
Selon la composition de la phase mobile au cours de l’analyse
a. Mode isocratique
La composition de la phase mobile reste inchangée au cours de l’analyse. Même pouvoir d’élution
Fig. 17: Séparation des composés d’un mélange en mode isocratique (Eau/ACN)70/30
b. Mode à gradient d’élution
La composition de la phase mobile change au cours de l’analyse.
Il est possible d’augmenter la force éluante pour éliminer les composés très retenus pouvant
conduire à des contaminations.
Fig. 18: Sépa ration des composés d’un mélange en mode gradient
(20 à 60% ACN) pendant 30 mi n
3e année Pharmacie 2019-2020 Page 8
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
IV.7. Détecteurs en HPLC
La détection se fait par un instrument placé immédiatement à la sortie de la colonne.
Il permet de suivre en continu la séparation et de mesurer la concentration des solutés.
IV.7.2. Principaux détecteurs utilisés
Tab.2: Principaux détecteurs utilisés en HPLC Partage
a. Réfractomètre différentiel
Mesure en continu la différence d'indice de réfraction entre la phase mobile contenant le soluté et la
phase mobile pure correspondant à la référence.
R = Z (n-n0)
R: la réponse du réfractomètre. n: indice de réfraction de l’effluent.
Z: constante caractéristique de l’appareil. n0: indice de réfraction de la phase mobile
Fig.19 : Principe de la réfractométrie différentielle
b. Spectrométrie de masse
Fig.20: Appareillage CL-UV- MS
3e année Pharmacie 2019-2020 Page 9
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
c. Détecteur évaporatif à diffusion de lumière (DDL)
Est fondé sur l'évaporation partielle de l'effluent de la colonne de façon à obtenir un brouillard de
particules solides ou liquides du soluté qui traverse un faisceau lumineux.
La lumière diffusée sous un ongle déterminé est détectée par un photomultiplicateur.
Fig.21: principe de Détecteur à diffusion de la lumière(DDL)
d. Spectrophotométrie UV/visible
Mesure la perte d’intensité de la lumière UV - Visible lors du passage à travers une solution.
La sensibilité optimale est obtenue en utilisant le détecteur à la longueur d’onde où l’absorbance du
composé d’intérêt est la plus grande : λ max
La réponse est fondée sur la loi de Beer-Lambert:
A = log (I0/I) = - log T = ε L C
A: Absorbance
T: Transmittance
ε: Absorptivité molaire du soluté à la longueur d’onde λ.
I0: Intensité du rayonnement incident.
I: Intensité du rayonnement transmis.
L: Longueur du chemin optique.
C: Concentration du soluté dans l’effluent.
Fig. 22 : Système monochromatique
3e année Pharmacie 2019-2020 Page 10
Faculté de Médecine de Blida Département de Pharmacie Laboratoire de Chimie Analytique
Fig. 23 : Système polychromatique
e. Spectrofluorimètrie
Certains composés organiques absorbent des radiations dans l’UV et réémettent une fraction de la
lumière absorbée à une longueur d’onde supérieures.
If = KC
If: Intensité de la fluorescence
K: facteur de proportionnalité
C: Concentration de l’analyte
f. Détecteurs électrochimiques
✓ Utilisent les propriétés oxydo-réductrices des solutés, ce qui suppose que l'effluent de la colonne
chromatographique soit suffisamment conducteur pour permettre le passage du courant.
✓ Les échantillons à détecter doivent pouvoir s'oxyder ou se réduire à un potentiel suffisamment
faible pour ne pas provoquer l'électrolyse de la phase mobile ou des composants de la matrice de
l'échantillon.
✓ Le signal mesuré correspond à la perte ou au gain d'un ou plusieurs électrons.
✓ Chaque composé à des conditions particulières d'analyse: pH, potentiel de travail,…
V. APPLICATIONS DE CLHP
V.1. Dosage en biologie médicale
✓ Analyse spécialisée.
✓ Méthodes développées en interne obligatoirement validées.
✓ Matrices biologiques complexe (sang, urine, …)
✓ Nécessite un traitement pré analytique de l’échantillon (Extraction liquide/liquide, Extraction sur
phase solide, dérivatisation pour HPLC à détection fluormétrique)
V.2. Contrôle du médicament
La CLHP est retrouvée à différentes rubriques de monographies des pharmacopées (Ph.Eur,
USP) à savoir l’identification, essais, et dosage.
3e année Pharmacie 2019-2020 Page 11
Vous aimerez peut-être aussi
- Cours PHYSIQUE - MPSI1920 PDFDocument411 pagesCours PHYSIQUE - MPSI1920 PDFMohamed ELouaarPas encore d'évaluation
- Sulfate D'ammonium Et de Fer (III)Document4 pagesSulfate D'ammonium Et de Fer (III)sumaleePas encore d'évaluation
- Catalyse Hétérogène Partie 1Document19 pagesCatalyse Hétérogène Partie 1abdarxPas encore d'évaluation
- Chromato-TD 2013Document43 pagesChromato-TD 2013Saber Ben Zian100% (1)
- Cours - 1Document72 pagesCours - 1JudicaëlPas encore d'évaluation
- 3-TP Solution TitréesDocument14 pages3-TP Solution TitréesMeriem BenPas encore d'évaluation
- Chapitre VDocument16 pagesChapitre VkouassiPas encore d'évaluation
- QQQ PDFDocument62 pagesQQQ PDFSalma DaaddiPas encore d'évaluation
- Saa 1Document12 pagesSaa 1Mimi lovePas encore d'évaluation
- TD Des Grandes Familles Et Procédés Analytiques Des Substances NaturellesDocument7 pagesTD Des Grandes Familles Et Procédés Analytiques Des Substances NaturellesLe seul SauveurPas encore d'évaluation
- Cours Et TD Propriètés OptiquesDocument62 pagesCours Et TD Propriètés Optiquesmohamed HanouniPas encore d'évaluation
- Chapitre 1 2023 24 Étapes Méthodes AnalyseDocument12 pagesChapitre 1 2023 24 Étapes Méthodes Analysemoumen.houamelPas encore d'évaluation
- Polycope ComplexométrieDocument8 pagesPolycope ComplexométriealaadoubekhPas encore d'évaluation
- Méthodologie (HPLC) G03Document33 pagesMéthodologie (HPLC) G03Máñ ØûPas encore d'évaluation
- تدبير المقالعDocument27 pagesتدبير المقالعMohammed Ben Ali100% (1)
- Chromato 2Document36 pagesChromato 2Hamza DerrajiPas encore d'évaluation
- Chap II ComplexationDocument17 pagesChap II ComplexationyoussefPas encore d'évaluation
- La ThèseDocument155 pagesLa ThèseZakia ZakiaPas encore d'évaluation
- Chimie MecanismesReactionnelsDocument6 pagesChimie MecanismesReactionnelsAshall David WheiPas encore d'évaluation
- Cours Chromato Methode Analyse 2021Document16 pagesCours Chromato Methode Analyse 2021Oussama amasouPas encore d'évaluation
- Nothing To DoDocument9 pagesNothing To Domugi100% (1)
- Barbi Turi QuesDocument9 pagesBarbi Turi QuesmatPas encore d'évaluation
- Rapport TP CinétiqueDocument44 pagesRapport TP CinétiqueNour-Eddin LaaouajPas encore d'évaluation
- Extraction Des EnzymesDocument28 pagesExtraction Des EnzymesBerenger MabéléPas encore d'évaluation
- TB1TP Fiche 7 Polarimetrie PDFDocument3 pagesTB1TP Fiche 7 Polarimetrie PDFAmirou Baby MixicoPas encore d'évaluation
- 2015 04 28 Cours de GPA1 PDFDocument53 pages2015 04 28 Cours de GPA1 PDFbhr100% (1)
- Banc KoflerDocument2 pagesBanc KoflerTaouil MohamedPas encore d'évaluation
- Catalyseur de WilkinsonDocument37 pagesCatalyseur de WilkinsonAchwak BelfadelPas encore d'évaluation
- Chimie 3 Diagrammes E-Ph - ResumeDocument6 pagesChimie 3 Diagrammes E-Ph - Resumesali100% (1)
- Oxydoreduction 11Document9 pagesOxydoreduction 11azerfazPas encore d'évaluation
- Polycondensation 2022Document37 pagesPolycondensation 2022Eya B. TalebPas encore d'évaluation
- TP N°02 MMDocument2 pagesTP N°02 MMKenza HacenePas encore d'évaluation
- Cours de RMN S4Document56 pagesCours de RMN S4EmadPas encore d'évaluation
- 02 Dosage Spectrophotometrique ExoDocument5 pages02 Dosage Spectrophotometrique ExoElias EidPas encore d'évaluation
- PARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1Document42 pagesPARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1beauty queensPas encore d'évaluation
- Serie 2Document1 pageSerie 2mirouPas encore d'évaluation
- Examen S5 Chimie Organique 19-01-2015Document4 pagesExamen S5 Chimie Organique 19-01-2015Sara LouaarPas encore d'évaluation
- Partie I - Chapitre IIIDocument12 pagesPartie I - Chapitre IIIHafsa KoraichiPas encore d'évaluation
- Chapitre 2 Réactions de SubstitutionDocument14 pagesChapitre 2 Réactions de Substitutionsimo GriPas encore d'évaluation
- Méthodes de Séparation2016Document5 pagesMéthodes de Séparation2016fifi fifiPas encore d'évaluation
- Methode de MohrDocument9 pagesMethode de MohrMouaadh feradjPas encore d'évaluation
- QCM Chimie, Physique, Sciences Des Mat EriauxDocument5 pagesQCM Chimie, Physique, Sciences Des Mat EriauxAdam JouamaaPas encore d'évaluation
- Serie 2Document8 pagesSerie 2Mourad MatmourPas encore d'évaluation
- Master PhosphoreDocument34 pagesMaster PhosphoreMohamed EL FAGHLOUMIPas encore d'évaluation
- Serie-4 SMC 6Document1 pageSerie-4 SMC 6SOUFYANE MUSTAPAPas encore d'évaluation
- Compte Rendu Polynome 2Document15 pagesCompte Rendu Polynome 2saganogos100% (1)
- Affiche Master PharmacoDocument1 pageAffiche Master PharmacobnhikPas encore d'évaluation
- Cinétique 1Document21 pagesCinétique 1Closed WayPas encore d'évaluation
- TD Master BiopharmacieDocument17 pagesTD Master BiopharmacieIbrahim KAMBAPas encore d'évaluation
- TD Spectrometrie de Masse de L3Document4 pagesTD Spectrometrie de Masse de L3Hk EhPas encore d'évaluation
- Eléments de Chimie Analytique 2 - Méthodes Titrimétriques Et Méthodes Systématique de Résolution de ProblèmesDocument53 pagesEléments de Chimie Analytique 2 - Méthodes Titrimétriques Et Méthodes Systématique de Résolution de ProblèmesYoussra CherratiPas encore d'évaluation
- Cours TP e M1 S2 Ga 2019 2020Document2 pagesCours TP e M1 S2 Ga 2019 2020CHARIF ZakariaPas encore d'évaluation
- Examen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1Document2 pagesExamen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1sidi mohamed el amine nekkal100% (1)
- Série Cpg1.Document3 pagesSérie Cpg1.lahyaniPas encore d'évaluation
- TP 2 Ta PDFDocument3 pagesTP 2 Ta PDFHaweme MouatazPas encore d'évaluation
- Chapitre 7 TaninsDocument89 pagesChapitre 7 TaninsAlexandre Kpangny BéniPas encore d'évaluation
- Chapitre I Colorants VIDocument23 pagesChapitre I Colorants VInourisana85100% (1)
- Cours Chimie Analytique Chapitres 1 Et 2Document10 pagesCours Chimie Analytique Chapitres 1 Et 2Florent yedonouPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- HPLC HighPressureLiquidChromatogrphyDocument19 pagesHPLC HighPressureLiquidChromatogrphyfakhrouPas encore d'évaluation
- A-6 HPLC-1Document27 pagesA-6 HPLC-1ABDESSAMAD HAMOUMIPas encore d'évaluation
- Pharmaco Du Domaine HistaminergiqueDocument29 pagesPharmaco Du Domaine Histaminergiquezineb fellaPas encore d'évaluation
- Validation Dune Méthode Analytique - 5e Année Pharmacie - 2019-2020Document3 pagesValidation Dune Méthode Analytique - 5e Année Pharmacie - 2019-2020zineb fellaPas encore d'évaluation
- Stabilité Des Médicaments 2020 DJERMOUNEDocument13 pagesStabilité Des Médicaments 2020 DJERMOUNEzineb fellaPas encore d'évaluation
- Chromatographie en Phase Gazeuse DR F.BELAIDIDocument12 pagesChromatographie en Phase Gazeuse DR F.BELAIDIzineb fellaPas encore d'évaluation
- Controle Qualite MP-PF - 2019-2020 5e Année PharmacieDocument7 pagesControle Qualite MP-PF - 2019-2020 5e Année Pharmaciezineb fellaPas encore d'évaluation
- Chromatographie Sur Couche Mince DR F.BELAIDIDocument14 pagesChromatographie Sur Couche Mince DR F.BELAIDIzineb fellaPas encore d'évaluation
- Methodes D'extraction Des Substances NaturellesDocument30 pagesMethodes D'extraction Des Substances Naturelleszineb fella100% (1)
- 2022 Tle Spã© Chapitre 12 Dynamique D Un Circuit ElectriqueDocument5 pages2022 Tle Spã© Chapitre 12 Dynamique D Un Circuit Electriquemavrinissue4Pas encore d'évaluation
- Constitutions, Fonctionnement Et Caractéristiques Électriques D'une Cellule Photovoltaïque (PV)Document24 pagesConstitutions, Fonctionnement Et Caractéristiques Électriques D'une Cellule Photovoltaïque (PV)Ahmed AgnaouPas encore d'évaluation
- TD Thermo 21-22Document3 pagesTD Thermo 21-22Junior ALLODJIPas encore d'évaluation
- GP Génie PolymèresDocument37 pagesGP Génie PolymèresMebarka TimPas encore d'évaluation
- Oleg Eric Anitoff Chimie OrganiqueDocument255 pagesOleg Eric Anitoff Chimie Organiqueoleg anitoffPas encore d'évaluation
- MMC Composites 4Document6 pagesMMC Composites 4zeryouh oumaymaPas encore d'évaluation
- ThermiqueDocument2 pagesThermiquemariaPas encore d'évaluation
- Terminale Specialite Physique Chimie Mouvements de Satellites Et de Planetes Les Trois Lois de KeplerDocument5 pagesTerminale Specialite Physique Chimie Mouvements de Satellites Et de Planetes Les Trois Lois de KeplerpauljuniormbossaobaPas encore d'évaluation
- TP Physique 9 Oscillations de La Pendule ElastiqueDocument3 pagesTP Physique 9 Oscillations de La Pendule Elastiquedouaadhifallah7Pas encore d'évaluation
- Savon MayssaDocument12 pagesSavon MayssaJihene ManaiPas encore d'évaluation
- BASE 09 - Notions de Carrosserie. SoudouresDocument39 pagesBASE 09 - Notions de Carrosserie. Soudouresguenane salah eddinePas encore d'évaluation
- Td2 Biophysique SNV UstombDocument1 pageTd2 Biophysique SNV UstombChenouza SghrPas encore d'évaluation
- Emploi Du Temps Automne 2021 22 LST S5Document6 pagesEmploi Du Temps Automne 2021 22 LST S5Abderrafie BCPas encore d'évaluation
- Prepa 2023 BaDocument3 pagesPrepa 2023 Baange borisPas encore d'évaluation
- VEDA FRANCE - Couvre Joints Profiles D ObturationDocument10 pagesVEDA FRANCE - Couvre Joints Profiles D Obturationj.nives.maisons.ivacoPas encore d'évaluation
- Corrige PhysiqueDocument3 pagesCorrige Physiquebensaidyosr898Pas encore d'évaluation
- COURSMECANIQUE2023Document16 pagesCOURSMECANIQUE2023DottledogPas encore d'évaluation
- ChapitreVII - Thermochimie - 2021Document13 pagesChapitreVII - Thermochimie - 2021nouralc.2005Pas encore d'évaluation
- Simulation D'un Système Photovoltaïque Alimentant Une Machine AsynchroneDocument87 pagesSimulation D'un Système Photovoltaïque Alimentant Une Machine AsynchroneKamel FacihPas encore d'évaluation
- 063b-Exercice 7-CorrigeDocument10 pages063b-Exercice 7-Corrigeairnesse59Pas encore d'évaluation
- Expose BioinformatiqueDocument10 pagesExpose Bioinformatiquebillel lamairiaPas encore d'évaluation
- 4 Tectonique PDFDocument26 pages4 Tectonique PDFChems-eddine BenslimanePas encore d'évaluation
- ch2 Reaction Acido-Basique (Récupération Automatique)Document21 pagesch2 Reaction Acido-Basique (Récupération Automatique)Rayn HPas encore d'évaluation
- Angle D'incidence (Optique) - WikipédiaDocument8 pagesAngle D'incidence (Optique) - WikipédiaMutunda MauricePas encore d'évaluation
- Chap-8 Bilans ThermiquesDocument28 pagesChap-8 Bilans Thermiquescherif003Pas encore d'évaluation
- Belmihoub KhellafDocument167 pagesBelmihoub Khellafrahim chouakriaPas encore d'évaluation
- Wirelock Booster Kit FR FrenchDocument9 pagesWirelock Booster Kit FR FrenchMohamed IbrahimPas encore d'évaluation
- 1er S - DS 4 - Corrigé - Chap 7 Et 8Document2 pages1er S - DS 4 - Corrigé - Chap 7 Et 8Marouane NazihPas encore d'évaluation
- Exercices 11 Mouvement D'un Projectile Dans Le Champ de PesanteurDocument2 pagesExercices 11 Mouvement D'un Projectile Dans Le Champ de PesanteurSalimPas encore d'évaluation