Microbiologie
| Partie de | |
|---|---|
| Pratiqué par | |
| Champs |
La microbiologie est un domaine des sciences appliquées qui a pour objet les micro-organismes et les activités qui les caractérisent. Plus spécifiquement, la microbiologie se consacre à l'identification et à la caractérisation des micro-organismes ; à l'étude de leur origine et de leur évolution ; à définir leurs caractéristiques, les produits de leurs activités et leurs besoins ; et à comprendre les relations qu’ils entretiennent entre eux et avec leur milieu naturel ou artificiel.
Les micro-organismes appartenant à trois règnes présentant une structure cellulaire eucaryote ou procaryote, ou qui est eucaryote, et qui est caractérisé par l'unicellularité, une taille microscopique ou ultramicroscopique, un potentiel métabolique et de reproduction, l'omniprésence et l'abondance[1]. Les micro-organismes sont répartis en cinq groupes[1] : les algues, les protozoaires, les mycètes, les bactéries, les virus et les prions. Les bactéries sont classées parmi les monères. Les algues unicellulaires font partie des protistes procaryotes et eucaryotes. Les champignons unicellulaires, les lichens et les protozoaires sont des protistes eucaryotes. Les virus et les prions sont des acaryotes (soit sans organisation cellulaire).
On parle aussi maintenant de « microbiologie moléculaire », dans le domaine des biotechnologies notamment[2].
Historique
[modifier | modifier le code]
Dès l'Antiquité, on postulait l'existence d'agents infectieux transmissibles invisibles à l'œil nu.
- 1546 : Jérôme Fracastor impute la transmission des maladies à des germes vivants, qu'il appelait « seminaria ».
- 1665 : Robert Hooke montre les structures de reproduction des moisissures et est donc le premier à décrire des micro-organismes.
- 1668 : Francesco Redi (expérience de Redi sur l'origine des asticots) démontre le principe de la biogénèse qui remet en cause la théorie de la génération spontanée.
- 1677 : Découverte des bactéries par le microscopiste hollandais Antoine van Leeuwenhoek.
- 1828 : Christian Gottfried Ehrenberg utilise pour la première fois le terme bactérie.
- 1840 : Le pathologiste allemand Jacob Henle propose une « théorie des germes » pour les maladies.
- 1857-1876 : Louis Pasteur (doyen de la faculté des sciences de Lille) met en évidence les rôles des micro-organismes dans la fermentation lactique et alcoolique. Il développe les techniques de pasteurisation et de stérilisation lui permettant la mise en place de cultures pures de micro-organismes. La possibilité de culture a permis de démontrer que la génération spontanée était une aberration.
- 1877-1895 : Louis Pasteur démontre que des maladies sont la conséquence de la présence de ces micro-organismes. Premières recherches systématiques sur l'origine de certaines maladies, ainsi que la vaccination (connue depuis Edward Jenner pour la variole - maladie virale).
- 1873-1882 : Robert Koch met en évidence le bacille responsable de la tuberculose (Mycobacterium tuberculosis). Koch a établi les règles (toujours utilisées) qui permettent de démontrer rigoureusement qu'une bactérie donnée est à l'origine d'une infection.
- 1884 : Hans Christian Gram développe une technique de coloration qui est la plus utilisée dans l'étude et la classification des bactéries en deux grands groupes : les bactéries à Gram positif et celles à Gram négatif.
- 1912 : Paul Ehrlich découvre le premier traitement efficace (dérivé d'arsenic) contre la syphilis. C'est la première fois qu'on traite avec un agent chimiothérapeutique une maladie bactérienne.
- 1917 : Découverte des bactériophages par Frederick Twort et Félix d'Hérelle.
- 1928 : Frederick Griffith découvre la transformation bactérienne et établit les fondements de la génétique moléculaire.
- 1929 : Alexander Fleming découvre les propriétés antibactériennes de la pénicilline produite par Penicillum. L'humanité entre dans l'ère des antibiotiques.
- 1944 : Albert Schatz et Selman Waksman découvrent un autre antibiotique: la streptomycine qui sera bientôt utilisée contre la tuberculose.
- 1960 : François Jacob, David Perrin, Carmen Sanchez et Jacques Monod proposent le concept d'opéron pour le contrôle de l'expression des gènes bactériens.
- 1977 : Carl Woese étudie l'ARN ribosomique pour découvrir une troisième forme de vie, les Archaea, distincte génétiquement des bactéries et des eucaryotes.
- 1986 : En utilisant une enzyme de la bactérie Thermus aquaticus, Kary Mullis invente la technologie de PCR (Polymerase Chain Reaction). La technique de PCR est devenue l'outil de base de la biologie moléculaire.
- 1995 : Séquençage complet du premier génome bactérien (Haemophilus influenzae) par Craig Venter et ses collègues du TIGR. La microbiologie entre dans l'ère de la génomique.
- 2006-2020 : Emmanuelle Charpentier et Jennifer Doudna découvrent, dans des bactéries, le système CRISPR-Cas9.
Organismes étudiés
[modifier | modifier le code]Procaryotes
[modifier | modifier le code]Les procaryotes Prokaryota ou Prokarya), du grec pro (avant) et caryon (noyau), sont des organismes dont la cellule ne possède pas de noyau cellulaire ni d'autres organites, ils appartiennent à au moins deux taxons distincts :
- les archéobactéries ou archées sont un groupe particulier, car il ne comprend essentiellement que des espèces anaérobies (n'ayant pas besoin d'oxygène, voire souvent ne tolérant pas l'oxygène), vivant dans des environnements extrêmes : on parle d'organisme extrémophile. Les environnements extrêmes sont à la limite des conditions tolérées par les cellules biologiques (milieu salin très acide ou très alcalin, milieu à température proche de l'ébullition). Les archéobactéries ne sont pas que des extrémophiles, ce sont aussi des organismes plus communs qui vivent dans des conditions de vie classique comme les marais ou les rumens des ruminants. Il ne faut pas associer systématiquement archéobactéries à des organismes extrêmes même si on retrouve parmi eux la plupart des extrémophiles ;
- on retrouve les eubactéries dans notre quotidien : sol, nourriture, etc. Ce sont les bactéries les plus connues. Cependant certaines eubactéries sont aussi extrémophiles.
Ces micro-organismes ont des mécanismes pour résister à ces conditions.
Eucaryotes
[modifier | modifier le code]Les eucaryotes ont un système membranaire interne enfermant des organites (noyau, plaste, mitochondrie, etc.) ; ils présentent un cytosquelette interne (actine, tubuline) absent chez les procaryotes, qui leur confère une taille souvent plus importante que les procaryotes.
On estime que chaque groupe d'eucaryotes a eu un ancêtre parmi les procaryotes (archéobactéries ou eubactéries), et que les mitochondries (et peut-être aussi d'autres organites comme les chloroplastes) présents dans le cytoplasme des eucaryotes actuels ont aussi eu au moins un ancêtre procaryote distinct qui aurait colonisé cette ancienne bactérie pour vivre en symbiose (endosymbiose) avec elle et former tous les eucaryotes qui ne peuvent plus vivre sans elles.
En effet, on retrouve dans les mitochondries un cytosquelette interne spécifique, une structure membranaire externe complexe, un matériel génétique interne spécifique logé dans une zone plasmique appelée proto-noyau (dépourvu de membrane mais tout de même structurée), même si les mitochondries ne peuvent se multiplier seules sans le concours de la cellule hôte (les mitochondries auraient perdu leurs facultés de reproduction qui ne leur étaient plus nécessaires, puisque la cellule hôte leur fournit pratiquement tout le matériel nécessaire à leur croissance et leur division).
Algues
[modifier | modifier le code]Contrairement aux champignons et aux protozoaires, les algues ont des pigments chlorophylliens leur permettant de réaliser la photosynthèse.
Elles sont donc des organismes vivant immobile et autotrophes.
Les algues sont présentes dans le sol, les plantes, l'eau douce et l'eau de mer.
Le mot « algue » n'a pas de sens d'un point de vue phylogénétique, c'est-à-dire que l'ancêtre commun à toutes les algues est celui des eucaryotes.
Champignons
[modifier | modifier le code]Les champignons sont présents dans le sol, plantes, débris végétaux, lichen, parasites de l'homme, des animaux et des plantes.
Remarque : une levure, eucaryote unicellulaire, est un champignon. Il existe de nombreuses espèces de levures comme Saccharomyces cerevisiae (levure de boulangerie), la famille des Candida (responsables des candidoses), Rhodotorula (parfois retrouvée dans la choucroute qu'elle colore en rouge), Schizosaccharomyces, etc.
Les champignons sont « absorbotrophes » : ils se nourrissent par absorption. Ils sécrètent des enzymes qui digèrent des polymères dans le milieu extérieur, ce mécanisme chimique transforme par exemple les glucides en monomères (petites molécules) qui sont ainsi absorbés.
Les champignons constituent un groupe biphylétique, car une partie d'entre eux, les eumycètes, appartiennent aux opistocontes, et une autre, les oomycètes, aux hétérocontes.
Taille des micro-organismes
[modifier | modifier le code]Comme signalé au début, les micro-organismes sont de très petite taille (d'où leur nom) :
- procaryotes (bactéries) : de l'ordre de 0,5 à 3 µm (pour la largeur), pas de limite en longueur ; le pouvoir de résolution de l'œil humain est de 100 µm (10−4 m soit 0,1 mm), ces micro-organismes sont donc tous invisibles à l'œil nu ;
- eucaryotes : très variable, de 2 à 200 µm (pour la largeur), pas de limite en longueur ; certains eucaryotes sont visibles à l'œil nu (notamment les algues), d'autres ne sont visibles que sous forme d'agrégats (cas des champignons, dont les parois plasmiques émettent des filaments sur une grande longueur relativement à leur taille). Tous les eucaryotes ne s'agrègent pas ainsi (notamment les protozoaires, invisibles à l'œil nu).
Le rapport surface sur volume est directement influencé par la taille : si l'on considère une forme simple telle que la sphère, la surface est proportionnelle au carré de la taille ( avec le rayon de la sphère), alors que le volume est proportionnel au cube de la taille (), le rapport surface/volume est donc inversement proportionnel à ().
Ceci conditionne la vitesse à laquelle le micro-organisme se nourrit : la nourriture passe à travers la membrane plasmique, donc la vitesse d'absorption est proportionnelle à la surface, mais la quantité à nourrir est proportionnelle au volume. La vitesse à laquelle entrent et sortent les nutriments et les déchets est donc inversement proportionnelle à la taille.
Donc plus la bactérie est petite, plus elle va pouvoir se nourrir à grande vitesse. Elle compense sa petite taille par une multiplication à très grande vitesse (taux de croissance très rapide).
Culture des micro-organismes
[modifier | modifier le code]Richesse du milieu
[modifier | modifier le code]Les micro-organismes ont besoin :
- d'une source d'énergie ;
- pour les chimiotrophes, elle provient de la dégradation de composés chimiques (par exemple du glucose),
- pour les phototrophes, de la lumière ;
- d'une source de carbone ;
- pour les autotrophes, il suffit de CO2 atmosphérique (carbone minéral),
- pour les hétérotrophes, elle provient de molécules organiques (CH4, oses, etc.) ;
- de macroéléments (ainsi appelés en raison de leur concentration dans le milieu de culture) : C, H, O, N, S, Na, Mg, P, K. Les éléments carbone, azote, phosphore doivent être présents aux proportions 100/10/1 pour un milieu correct ;
- de microéléments : Cu, Co, Zn, Cl, Fe, etc. ;
- d'une source d'azote, d'origine minérale (sel d'ammonium) ;
- de facteurs de croissance pour les auxotrophes : vitamines, acides aminés, bases azotées. Les bactéries prototrophes sont celles qui n'ont pas besoin de facteur de croissance ;
- de dioxygène (oxygène moléculaire) pour les aérobies strictes, ou d'absence de dioxygène pour les anaérobies stricts ; pour ces derniers micro-organismes, le peroxyde d'hydrogène (H2O2) formé par la réaction entre l'O2 et l'H2O les empoisonnent, car ils ne possèdent pas une catalase dégradant H2O2, à l'inverse des individus aérobies. Il existe également des micro-organismes aérobies facultatifs capables de se multiplier en présence ou en l'absence d'oxygène grâce à leur capacité à utiliser la fermentation et des bactéries microaérophiles qui ne se développent qu'à une certaine pression en dioxygène ;
- de facteurs physico-chimiques :
- pour le facteur température, on distingue trois catégories de micro-organismes selon leur optimum de croissance. Les psychrophiles ont leur optimum à 15 °C, les mésophiles à 37 °C, les thermophiles à 65 °C. Il faut descendre au-delà de −18 °C pour arrêter toute croissance microbienne. À 3 °C, il y a peu de risques lié aux bactéries pathogènes (mésophiles, donc virulentes à la température du corps) ou toxinogènes, seules quelques bactéries vivant à ces températures peuvent être dangereuses (listéria),
- pour le facteur pH, on considère que les bactéries préfèrent la neutralité excepté pour les bactéries lactiques. Pour les levures et moisissures, le pH optimum est plus acide (pH=5).
Diversité du milieu de culture
[modifier | modifier le code]On distingue trois types de milieux de culture selon leur composition :
- Milieux synthétiques : milieux dont on peut donner la composition chimique complète. Les milieux synthétiques sont utilisés en recherche fondamentale ;
- Milieux semi-synthétiques: Ils contiennent outre des substances chimiques de nature et proportions déterminées, des produits d’origine naturelle aussi définis que possibles.
- Milieux empiriques : milieux dont on ne connaît que partiellement la composition.
et parmi ces deux types de milieux, il existe des milieux sélectifs (qui vont permettre de sélectionner le type de micro-organismes qui pourront s'y multiplier). On peut ainsi choisir de ne laisser se développer qu'un genre de bactérie donné (ex. : milieu mFC pour les coliformes fécaux ou gélose au sang pour certains pathogènes) ou au contraire de favoriser le développement des levures-moisissures en ajoutant un antibiotique au milieu. La température à laquelle on incubera les milieux inoculés constitue également un facteur de sélection comme mentionné plus haut.
Les milieux de culture peuvent contenir des extraits de levure (cellules de levure déshydratées et lysées) qui fournissent une source d'acides aminés, de vitamines et d'azote, des extraits de malt apportant une source de carbone, des peptones (protéines animales, de poisson, de caséine de lait) source d'azote organique qui intéresse les individus hétérotrophes.
Ces milieux sont soit liquides, soit solides. Pour solidifier le milieu on utilise fréquemment la gélose ou agar-agar, un polymère de sucre tiré d'une algue rouge présentant la propriété de former avec l'eau un gel solide si la température est inférieure à 60 °C.
Méthodes
[modifier | modifier le code]Challenge test
[modifier | modifier le code]Un challenge test est une technique permettant de démontrer l'efficacité anti-microbienne (bactériostatique ou bactéricide) d'une substance donnée (produits pharmaceutiques, cosmétiques ou agroalimentaires par exemple)[3].
Cette technique consiste à inoculer une quantité connue de différents germes microbiens (bactéries, levures, moisissures, etc.) dans la substance à tester, puis de dénombrer ces germes à diverses échéances. Dans le cadre des produits pharmaceutiques, il est recommandé d'effectuer le challenge tests sur les quatre micro-organismes suivants: S. aureus, P. aeruginosa, A. brasiliensis (anciennement A. niger) et C. albicans, qui sont représentatifs de nombreux types de germes.
Ce test permet notamment de valider la date limite de consommation (DLC) ou la date limite d'utilisation optimale (DLUO) d'un produit.
Stérilisation
[modifier | modifier le code]La stérilisation est l'opération qui consiste à éliminer les micro-organismes d'un objet et ce, de manière durable. En microbiologie, le but de la stérilisation est d'une part maîtriser les micro-organismes introduits dans le milieu d'étude, et d'autre part éviter la contamination du milieu extérieur et des personnes (voir aussi l'article sur l'hygiène)[4].
Il existe trois façons pour stériliser un milieu de culture. Une destruction par la chaleur, par une méthode de filtration ou par l'emploi de radiation et d'agent chimique (gaz).
Chaleur
[modifier | modifier le code]On distingue les procédés à chaleur « sèche » ou « humide ».
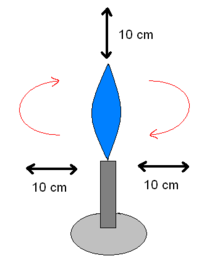
- chaleur sèche :
- bec Bunsen : tout l'air qui se trouve dans un globe virtuel de quinze centimètres de rayon de la flamme d'un bec Bunsen, est passé une fois dans la flamme. Ceci crée une enceinte fictive stérile. Les microbiologistes travaillent avec une flamme oxydante qui crépite,
- « four Pasteur » ou « four Poupinel » : c'est un four classique utilisé à 180 °C pendant 90 minutes au minimum. Il est moins efficace que l'autoclave (et consomme plus d'énergie)[5].
- chaleur humide :
- autoclave : son principe est de faire bouillir de l'eau dans une enceinte hermétiquement close pour augmenter la pression et donc dépasser les 100 °C d'ébullition (principe de l'autocuiseur). Il existe différents réglages selon les éléments à stériliser, typiquement un cycle durera entre 3 et 30 min à une température de 121-134°C. [6]
Cas particuliers : la pasteurisation et tyndallisation
[modifier | modifier le code]La pasteurisation est un procédé pour la conservation des aliments par lequel un aliment est chauffé à une température définie pendant une période de temps définie avant d'être refroidi rapidement. Les températures de pasteurisation varient entre 70 °C et 85 °C. Cette technique ne détruit qu'une partie de la flore bactérienne. Ce n'est, en aucun cas, une technique de stérilisation.
La tyndallisation est une série de chauffages brefs à des températures de 70 °C à intervalles réguliers (trois chauffages d'une heure, vingt-quatre heures entre deux chauffages), ceci afin de laisser aux formes résistantes la possibilité de germer pour les tuer au chauffage suivant. Par exemple, la destruction des germes pathogènes du lait se fait par un cycle de 63 °C pendant trente minutes suivie de 73 °C pendant quinze minutes.
L'ébullition n'est pas une méthode de stérilisation. Les formes sporulées des bactéries peuvent résister jusqu'à huit heures trente à 100 °C.
Filtration
[modifier | modifier le code]La filtration est une technique qui consiste à faire passer un liquide à travers un filtre dont les pores ont un diamètre de 0,2 µm ; les micro-organismes sont trop gros pour passer et sont donc retenus par le filtre. Pour forcer ce liquide à traverser le filtre, on utilise deux solutions :
- mise en pression du liquide par l'intermédiaire d'un piston ;
- aspiration du liquide en créant par exemple une enceinte dépressurisée de l'autre côté du filtre.
Cette technique est intéressante lors d'utilisation de produits thermolabiles (c'est-à-dire qui ne résistent pas à la chaleur) comme certains acides aminés aromatiques, vitamines, hormones de croissance, acides nucléiques et une bonne partie des antibiotiques. Cependant les filtres de 0,2 µm colmatent vite. On peut contourner ce problème en augmentant la surface du filtre ou en utilisant un procédé de filtration tangentielle.
Dans certains cas le filtre ayant servi à stopper les micro-organismes peut être déposé sur un milieu de culture solide afin de permettre la multiplication des germes, ceci dans le but de procéder à leur dénombrement et à leur identification.
Radiation et agent chimique
[modifier | modifier le code]Ces techniques sont utilisées par les industries dont l'alimentaire. Elles sont très pénétrantes, car les radiations et certains gaz traversent le plastique et tuent les micro-organismes.
Les rayons ultraviolets ne sont cependant pas une bonne technique de stérilisation, car ils sont non pénétrants, donc ils ne passent pas au travers de matériaux comme le plastique et le verre. De plus certains micro-organismes sont capables de réparer les dommages infligés par les ultraviolets si le produit est éclairé après application de rayons ultraviolets ; c'est le phénomène dit « de photo-réparation ».
On peut dans certains cas utiliser le rayonnement gamma, beaucoup plus pénétrant et puissant que les ultraviolets.
Notion de culture pure
[modifier | modifier le code]Technique des stries
[modifier | modifier le code]Elle est basée sur la notion d'UFC (unité formant une colonie). Chaque unité cellulaire (une cellule, un groupe de cellules ou un morceau d'hyphe) va donner une colonie.
Sur un milieu de culture, il y a formation d'un monticule de bactéries ou de levures avec une forme particulière (la colonie). La forme de ce monticule est déterminée par l'organisation de la colonie, qui elle-même est déterminée génétiquement. Les champignons vont, eux, développer un thalle c'est-à-dire ce que l'on peut par exemple observer sur les confitures ayant « moisi.
L'UFC est utilisée aussi pour le dénombrement bactérien en utilisant des cultures sur boîte de Pétri à partir de tubes préparés par dilutions en cascades de la suspension bactérienne mère.
L'observation macroscopique de l'aspect des colonies permet de différencier les colonies de bactéries contaminantes de celles qu'on cherche à isoler.
Technique de suspension dilution
[modifier | modifier le code]Cette technique sert à évaluer le nombre de micro-organismes qui se trouvent dans un milieu liquide (eau de puits, boissons, eau de piscine, etc.) ou dans un milieu solide (sol, aliments, etc.). Elle peut aussi servir à isoler une souche pure à partir d'un mélange.
Il s'agit simplement d'une suite de dilutions suivie d'un prélèvement d'un aliquot qui sera ensemencé soit par étalement ou soit en profondeur (dans la masse) sur un milieu de culture sélectif ou non contenu dans des boîtes de Pétri. Après incubation des boîtes de Pétri, il suffira ensuite de compter le nombre de colonies, et connaissant le volume de l'aliquot (0,1 mL(ensemencement par étalement) ou 1 mL(ensemencement dans la masse ou en profondeur)), on en déduira la quantité approximative de bactéries dans le milieu.
Identification des bactéries
[modifier | modifier le code]L'identification des bactéries se fait suivant une clé dichotomique qui va des caractères les plus vastes aux plus pointus pour aboutir à une espèce bactérienne donnée.
Critères morphologiques
[modifier | modifier le code]L’étude de la morphologie bactérienne est le premier acte effectué par un laboratoire de diagnostic pour identifier une bactérie. L'observation de la morphologie bactérienne permet une orientation préliminaire du diagnostic.
Macroscopique
[modifier | modifier le code]À l'œil nu, on peut distinguer les caractéristiques d'une colonie :
- la forme du relief (bombée, semi-bombée, plate) ;
- la taille ;
- la couleur ;
- l'aspect (collant, filamenteux, etc.) ;
- l'odeur ;
- la transparence (opaque, translucide) ;
- l'allure des contours (régulier, dentelés) ;
- la consistance ;
- la pigmentation ;
- aspect de la surface (lisse ou rugueuse).
Il existe trois grands types de colonies :
- colonies de Type S (Smooth = lisse) : contours lisse et réguliers, semi-bombée, surface brillantes, crémeuses ;
- colonies de Type M (Muqueux) : contours lisse et réguliers, très bombées, surface très brillantes, filantes ;
- colonies de Type R (Rough = rugueux) : contours irréguliers, plates rugueuses et mates, sèches.
Microscopique
[modifier | modifier le code]État frais
[modifier | modifier le code]L'état frais se fera avec une suspension de colonie qui ne sera pas fixée sur la lame comme la coloration de gram mais se fera avec une goutte de suspension entre lame et lamelle. Cette observation microscopique se fera à l'objectif x40 avec peu de lumière pour ne pas tuer les bactéries car le but de cette observation est de voir leurs mobilités (on peut voir aussi la morphologie mais cela se voit mieux en coloration de gram).
Coloration de Gram
[modifier | modifier le code]Les bactéries étant en général quasiment transparentes, on commence par préparer un étalement (faire un frottis) sur lame de microscope auquel on applique une coloration de Gram. L'observation microscopique se fera à l'objectif x100 avec de l'huile à immersion. Les bactéries à Gram positif apparaîtront mauves alors que celles à Gram négatif apparaîtront roses. Il existe d'autres colorations, comme celle au vert de malachite permettant de mettre en évidence les formes sporulées. La coloration de Gram permet de déterminer le type de paroi cellulaire.
Forme
[modifier | modifier le code]La forme est extrêmement diverse au sein du monde bactérien. Si on excepte les bactéries dépourvues de paroi (Mycoplasmes), qui peuvent être très polymorphes, la diversité est relativement restreinte pour les bactéries d’intérêt médical et vétérinaire. Parmi celles-ci, on distingue principalement des formes sphériques (cocci), cylindriques (bacille), spiralées (spirille), enroulées (spirochète) à appendice bourgeonnant ou filamenteux.
Mode de groupement
[modifier | modifier le code]Elles peuvent se regrouper en chaînes (Streptococcus, Enterococcus, Lactococcus, etc.), en amas asymétriques ou grappes (Staphylococcus), en amas cubiques réguliers (sarcines), en palissades ou en paquets d’épingles (Corynebacterium), etc. Le mode de groupement, à condition de l’apprécier sur une culture jeune effectuée en milieu liquide et de tenir compte de l’aspect prédominant, est également un élément important pour orienter l'identification.
Taille
[modifier | modifier le code]Les plus petites bactéries ont une taille de 0,1 à 0,2 µm (Chlamydia) alors que certaines ont un diamètre supérieur à 10 µm. La plus grande bactérie connue (Thiomargarita namibiensis) peut atteindre un diamètre de 750 µm.
Présence de spores
[modifier | modifier le code]Toutes les bactéries n'ont pas la possibilité de sporuler. Pour mettre en évidence les spores au microscope optique, il suffit de les colorer au vert de malachite ou à l'encre de Chine. Mais on peut les deviner à la coloration de Gram (absence de coloration). Les spores sont présents chez les Bacillus.
Mobilité
[modifier | modifier le code]Les bactéries peuvent être équipées d'un ou plusieurs flagelle(s) leur permettant de se déplacer. Les deux mobilités les plus courantes sont la mobilité par ciliature péritriche si la bactérie se déplace dans tous les sens, soit par ciliature polaire si la bactérie part dans un seul sens. Pour définir le mode de déplacement des bactéries, on parle de chimiotactisme. La bactérie évoluant dans un milieu se déplace selon des gradients de concentration pour se rapprocher de sa « nourriture »
Certaine motilité dépende d'un mécanisme impliquant le pilus de type IV et de plusieurs polysaccharides comme chez la bactérie Myxococcus xanthus[7].
Capsule
[modifier | modifier le code]La capsule est formée de polymères (polysaccharides ou protides) disposés en couches à la périphérie de la bactérie. Celle-ci permet à la bactérie d'adhérer aux surfaces (coloniser les surfaces) et d'échapper au système immunitaire car les antigènes de surface sont recouverts par la capsule qui les rend indétectables (pouvoir pathogène).
Critères biochimiques
[modifier | modifier le code]On identifie aussi une bactérie en observant si elle utilise tel ou tel substrat. On la met donc en contact dans un milieu de culture avec un glucide, ou un peptide, ou d'autres substrats plus complexes — le test de l'oxydase par exemple utilise le tétraméthyl-paraphénylènediamine. On peut révéler l'utilisation de ce substrat par virage d'un indicateur de pH car un glucide utilisé donne un produit acide, un peptide donne un produit basique, etc.
Chaque famille de bactéries a des caractères propres, on peut donc les rassembler facilement avec des caractéristiques de base comme l'utilisation du glucose avec ou sans oxygène, la réduction des nitrates, etc. Ensuite, on dispose de galeries d'identifications biochimiques qui sont parfois vendues par des sociétés spécialisées. Ces tests sont assez longs, de un à deux jours.
Critères génétiques
[modifier | modifier le code]On peut citer des techniques de génie génétique comme :
- la PCR (Polymerase Chain Reaction) pour cibler un gène présent uniquement chez une famille ou un genre bactérien par réhybridation spécifique de courtes séquences d'ADN (oligonucléotides amorces) synthétiques précises ;
- les puces à ADN qui utilisent le même principe mais ayant une précision allant jusqu'à la souche même.
Systématique bactérienne
[modifier | modifier le code]La systématique permet d'identifier une souche bactérienne inconnue grâce à différents examens et à l'utilisation de milieux de culture spécifiques.
La coloration de Gram et les tests de la catalase et de l'oxydase permettent de déterminer la famille. Des milieux de cultures spécifiques permettent d'arriver au genre et à l'espèce. Des examens supplémentaires tels que le sérogroupage peuvent être utilisés dans certains cas.
Coques à Gram positif et catalase positive
[modifier | modifier le code]- Famille des Micrococcaceae
- Genre Micrococcus
- Famille des Staphylococcaceae
- Genre Staphylococcus
Coque à Gram positif et catalase négative
[modifier | modifier le code]- Famille des Streptococcaceae
- Streptocoques des groupes Lancefield A, B, C, D (Enterococcus), F et G
Coque à Gram négatif
[modifier | modifier le code]Gram négatif regroupe les bactéries à paroi fine qui ne retiennent pas le bleu de gentiane/cristal. Elles apparaissent au microscope optique en rose après que l'on ajoute de la fuchsine (genre neisseria, par exemple).
Bacille à Gram positif
[modifier | modifier le code]- Genre Bacillus
- Genre Listeria
- Genre Clostridium
Bacille à Gram négatif
[modifier | modifier le code]Oxydase négative
[modifier | modifier le code]Famille des Enterobacteriaceae :
- Genre des Salmonella
- Genre des Escherichia
- Sérogroupage des Escherichiae Coli
- Sérogroupage des autres Escherichia
- Genre Shigella
- Genre Klebsiella
- Genre Enterobacter
- Genre Serratia
- Genre Proteus
- Genre Morganella
- Genre Providencia
- Genre Hafnia
Oxydase positive
[modifier | modifier le code]Agents antibactériens
[modifier | modifier le code]Agents physiques
[modifier | modifier le code]On peut citer les agents suivants :
- la chaleur : à partir de 65 °C, les protéines sont dénaturées, cependant certains micro-organismes sont capables de supporter des températures plus élevées ;
- le pH : qu'il soit trop acide ou trop basique ;
- les hautes pressions : à partir de 6 000 bar. Ainsi, c'est avec un traitement par la pression que l'on stérilise les jus de fruits produits en industrie ;
- les UV : à une longueur d'onde voisine de 260 nm, ils détruisent tous les micro-organismes. Peu efficaces à travers les plastiques, ils sont utilisés pour stériliser l'air ;
- les rayons gamma : comme les UV, ils sont très efficaces. Ils peuvent traverser tous les plastiques et servent donc à stériliser les instruments comme les fils chirurgicaux. Leur utilisation a été tentée pour les produits alimentaires, sans succès auprès du public.
Agents chimiques
[modifier | modifier le code]Les agents chimiques utilisés se répartissent dans deux catégories : antiseptiques et désinfectants. Les antiseptiques sont utilisés pour l'élimination des micro-organismes sur des tissus vivants ; les désinfectants quant à eux sont utilisés sur des surfaces inertes.
Antibiotiques
[modifier | modifier le code]Les antibiotiques sont des substances chimiques qui ont une action spécifique avec le pouvoir de limiter la prolifération de bactéries spécifiques. Elles sont dépourvues de toxicité pour les autres cellules (champignons et autres eucaryotes). Ces molécules peuvent avoir une action drastique, c'est-à-dire bactéricide ; leur efficacité peut être également limitée à empêcher le développement des bactéries (on parle alors d'action bactériostatique).
Résistances aux antibiotiques
[modifier | modifier le code]Croissance bactérienne
[modifier | modifier le code]C'est le pouvoir ou la capacité des bactéries à augmenter leur nombre ; il est en fonction du type de bactéries (thermophiles, mésophiles, psychrophiles, psychrotrophes, etc.) Quand des bactéries sont incubées dans un milieu liquide adéquat, elles continuent généralement à se multiplier de façon exponentielle jusqu'à ce qu'un facteur nécessaire à leur croissance approche de l'épuisement et devienne limitant ou que des produits métabolites inhibiteurs (acides organiques, alcools, ammoniaque, etc.) s'accumulent exagérément. Cette culture, pratiquée sans addition de nutriment ni élimination de déchets en cours de croissance, s'appelle une culture en milieu discontinu ou en batch qui constitue un système clos. Une culture de ce type se comporte comme un organisme multicellulaire avec une limitation de croissance génétiquement déterminée.
On peut représenter graphiquement la croissance d'une culture de ce type en portant le logarithme du nombre de cellules viables en fonction du temps. La courbe obtenue pourra être divisée en six phases :
- Phase de latence. C'est une période d'adaptation de la souche à son nouveau milieu. Cette phase serait inexistante si la souche était issue du même milieu de culture ;
- Phase d'accélération. Au cours de cette étape, il y a synthèse active des enzymes ;
- Phase de croissance exponentielle. Au cours de cette phase, la bactérie croît à un taux constant maximal ;
- Phase de ralentissement. Au cours de cette phase, le milieu commence à s'épuiser : diminution de la concentration en nutriments, les déchets cellulaires commencent à s'accumuler dans le milieu ;
- Phase stationnaire. Au cours de cette phase, il y a autant de bactéries qui se divisent que de bactéries qui meurent ;
- Phase de déclin. Au cours de cette phase, les bactéries meurent à cause d'un manque de nutriment et d'une accumulation trop importante de déchets que la bactérie produit.
Diauxie
[modifier | modifier le code]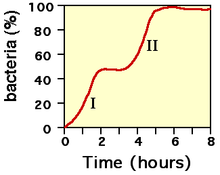
En présence de deux sources de carbone, les bactéries exhibent une courbe de croissance biphasique. Ceci s'explique par la consommation de la source de carbone la plus facilement assimilable, puis une adaptation pendant laquelle les enzymes permettant de dégrader la deuxième source de carbone sont synthétisées, puis consommation de la deuxième source de carbone (c'est le cas par exemple du milieu Kligler-Hajna. Sur ce milieu, la bactérie utilise le glucose comme première source de carbone puis le lactose comme second source de carbone lorsqu'il n'y a plus de glucose). L'analyse de ce comportement a permis à Jacques Monod de définir la notion d'opéron ; le plus connu étant l'opéron lactose.
Notes et références
[modifier | modifier le code]- Cet article est partiellement ou en totalité issu de l'article intitulé « Challenge test » (voir la liste des auteurs).
- Le Grand Dictionnaire terminologique, « microorganisme ».
- Accès vers un document de synthèse diffusé par ADIT (article du Pr Dr Axel A. Brakhage, « Les bioproduits pharmaceutiques », p. 11/29, dans « Les biotechnologies blanches, avancées et perspectives - Rencontre d'experts franco-allemande », Berlin, 29 septembre 2006).
- (en) A. D. Russell, « Challenge testing: principles and practice », International Journal of Cosmetic Science, vol. 25, no 3, , p. 147–153 (ISSN 0142-5463 et 1468-2494, DOI 10.1046/j.1467-2494.2003.00179.x, lire en ligne, consulté le )
- (en) S. Mohapatra, « Sterilization and Disinfection », dans Essentials of Neuroanesthesia, Elsevier, (ISBN 978-0-12-805299-0, PMCID PMC7158362, DOI 10.1016/b978-0-12-805299-0.00059-2, lire en ligne), p. 929–944
- Bonazzi, Florence (2005), L'hygiène au cabinet médical des médecins généralistes : observation de 30 médecins de l'agglomération grenobloise (Doctoral dissertation, université Joseph-Fourier).
- (en) Vinny R. Sastri, « 4 - Material Requirements for Plastics Used in Medical Devices », dans Plastics in Medical Devices (Third Edition), William Andrew Publishing, coll. « Plastics Design Library », (ISBN 978-0-323-85126-8, DOI 10.1016/b978-0-323-85126-8.00008-4, lire en ligne), p. 65–112
- (en) Salim T. Islam, Israel Vergara Alvarez, Fares Saïdi et Annick Guiseppi, « Modulation of bacterial multicellularity via spatio-specific polysaccharide secretion », PLOS Biology, vol. 18, no 6, , e3000728 (ISSN 1545-7885, PMID 32516311, PMCID PMC7310880, DOI 10.1371/journal.pbio.3000728, lire en ligne, consulté le )
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Microbiologie médicale
- Bactériologie médicale
- Microbiologie alimentaire
- Biohygiéniste
- Culture microbiologique
- Géomicrobiologie
- Paléomicrobiologie
- Collection française de bactéries phytopathogènes
Liens externes
[modifier | modifier le code]
- Ressource relative à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Sélection de sites sur la microbiologie sur le web : Les Signets de la Bibliothèque nationale de France






