Herpesviridae
| Realm | Duplodnaviria |
|---|---|
| Règne | Heunggongvirae |
| Embranchement | Peploviricota |
| Classe | Herviviricetes |
| Ordre | Herpesvirales |
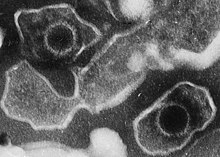
Les Herpèsvirus – lat. Herpesviridae – constituent une famille de virus à ADN qui provoquent des maladies chez les humains et les autres animaux. Le nom est dérivé du mot grec ἕρπειν (herpein « ramper »), en référence à la propagation des lésions cutanées, impliquant généralement des cloques, observées dans les poussées d'herpès simplex 1 et 2, et de zona[2]. En 2020, 115 espèces sont reconnues[3], et peuvent provoquer des infections latentes ou lytiques.
Neuf types d'herpèsvirus sont connus pour infecter principalement les humains[4]. Plus de 90 % des adultes ont été infectés par au moins l'un d'entre eux, et une forme latente du virus demeure chez presque tous les humains qui ont été infectés[5].
Au total, plus de 130 herpèsvirus sont connus[6], dont certains proviennent de mammifères, d'oiseaux, de poissons, de reptiles, d'amphibiens et de mollusques. Parmi les herpèsvirus animaux figurent le virus de la pseudorage, l'agent causal de la maladie d'Aujeszky chez le porc, et l'herpèsvirus bovin 1, l'agent causal de la rhinotrachéite infectieuse bovine et de la vulvo-vaginite pustuleuse.
Taxonomie
[modifier | modifier le code]Liste des sous-familles
[modifier | modifier le code]Selon BioLib (27 mai 2016)[7], NCBI (27 mai 2016)[8], World Register of Marine Species (27 mai 2016)[9], Catalogue of Life (27 mai 2016)[10] :
- Sous-famille des Alphaherpesvirinae
- Sous-famille des Betaherpesvirinae
- Sous-famille Gammaherpesvirinae
| Sous-famille | Genre | Hôte | Tropisme tissulaire | Entrée cellulaire | Transmission |
|---|---|---|---|---|---|
| Alphaherpesvirinae | Iltovirus | Oiseaux | Aucun | Endocytose des récepteurs cellulaires | Oral-fécal, aérosol |
| Mardivirus | Galliformes | ||||
| Scutavirus | Tortues de mer | ||||
| Simplexvirus | Mammifères (incl. humains) | Muqueuse épithéliale | Endocytose des récepteurs cellulaires | Sexe, salive | |
| Varicellovirus | Glycoprotéines | Aérosol | |||
| Betaherpesvirinae | Cytomégalovirus | Singes (incl. humains) | Muqueuse épithéliale | Glycoprotéines | Urine, salive |
| Muromégalovirus | Rongeurs | Glandes salivaires | Contact | ||
| Proboscivirus | Éléphants | Aucun | |||
| Roseolovirus | Humains | Lymphocytes, monocytes, macrophages, cellules épithéliales | Contact respiratoire | ||
| Gammaherpesvirinae | Rhadinovirus | Mammifères (incl. humains) | Lymphocytes B | Glycoprotéines | Sexe, salive |
| Macavirus | |||||
| Percavirus | |||||
| Lymphocryptovirus |
Structure virale
[modifier | modifier le code]Tous les virions des Herpesviridae partagent une structure commune, de l'intérieur vers l'extérieur :
- un génome d'ADN linéaire double brin, monopartite, relativement grand, codant 100 à 200 gènes enfermé dans
- une cage protéique icosaédrique (avec une symétrie T = 16) appelée capside[11] ou nucléocapside, formé de 162 capsomères (150 hexons et 12 pentons, tous deux composés de VP5[12]), elle-même enveloppée dans
- une couche protéique appelée tégument contenant les protéines virales (26 sont identifiées) et des ARNm viraux
- une membrane bicouche lipidique appelée enveloppe, d'où émergent
- des spicules formés de glycoprotéines. On a identifié 11 glycoprotéines: gB, gC, gD, gE, gG, gH, gI, gJ, gK, gL et gM. Parmi celles-ci, gB, gH, et gL sont présentes dans tous les Herpesviridae.
Cycle de réplication
[modifier | modifier le code]À la suite de la liaison de l'enveloppe virale protéique aux récepteurs de la membrane cellulaire, le virion est ingéré et démantelé, permettant à l'ADN viral de migrer vers le noyau de la cellule. À l'intérieur du noyau, l'ADN viral subit une réplication et une transcription limitées à un petit nombre de gènes viraux appelés gènes latents. De cette manière, le virus peut persister dans la cellule (et donc dans l'hôte) indéfiniment. La réactivation de virus latents intervient dans de nombreuses maladies organiques.
Tandis que la primo-infection est souvent accompagnée d'une période limitée de maladie clinique, la latence à long terme est asymptomatique. À la suite de l'activation, le virus entame la transcription de nombreux gènes additionnels non-latents appelés gènes lytiques qui conduisent à une réplication accélérée et à la production de nouveaux virus. La formation de l'enveloppe définitive se fait à partir de la membrane de l'appareil de Golgi (une enveloppe provisoire prend forme à partir de la membrane nucléaire) contrairement à la plupart des autres virus dont l'enveloppe se forme à partir de la membrane plasmique. Souvent, l'activation lytique entraîne la mort de la cellule.
Herpèsvirus humains
[modifier | modifier le code]Transmission
[modifier | modifier le code]À l'exception de VZV (de la famille des alpha Herpès Virus), le mode de transmission est le fait de contacts interhumains rapprochés, oraux ou sexuels. Le VZV est transmis par voie respiratoire. Notons que le CMV qui se transmet essentiellement par la salive (plus généralement par contact à des liquides biologiques infectés, lait maternel, urines des couches) peut être transmis par voie sanguine.
Symptômes
[modifier | modifier le code]Cliniquement, l'activation lytique s'accompagne souvent de l'apparition de symptômes non spécifiques tels qu'une faible fièvre, un mal de crâne, un mal de gorge, un état de fatigue, un érythème, etc. ainsi que de signes cliniques tels que des ganglions lymphatiques gonflés ou douloureux et des signes immunologiques tels qu'une diminution du nombre des cellules tueuses naturelles NK.
Implications
[modifier | modifier le code]Joel Dudley (en) et son équipe de l'École de médecine du Mont Sinaï à New York, démontrent que les virus 6A (HHV-6A) et 7 (HHV-7) seraient impliqués dans la maladie d'Alzheimer sans que l'étude puisse démontrer si la présence anormale des virus, dans plus de 600 échantillons cérébraux, est cause ou effet de la maladie [14].
Notes et références
[modifier | modifier le code]- ICTV. International Committee on Taxonomy of Viruses. Taxonomy history. Published on the Internet https://talk.ictvonline.org/., consulté le 28 janvier 2021
- TSL Beswick, « The Origin and the Use of the Word Herpes », Med Hist, vol. 6, no 3, , p. 214–232 (PMID 13868599, PMCID 1034725, DOI 10.1017/S002572730002737X)
- P Wildy, « Classification and nomenclature of viruses. First report of the International Committee on Nomenclature of Viruses. », Monographs in Virology, vol. 5, , p. 1–81 (OCLC 333944)
- John Carter et Venetia Saunders, Virology, Principles and Applications, John Wiley & Sons, (ISBN 978-0-470-02386-0)
- Chayavichitsilp P, Buckwalter JV, Krakowski AC, Friedlander SF, « Herpes simplex », Pediatrics in Review, vol. 30, no 4, , p. 119–29; quiz 130 (PMID 19339385, DOI 10.1542/pir.30-4-119)
- Brown JC, Newcomb WW, « Herpesvirus capsid assembly: insights from structural analysis », Current Opinion in Virology, vol. 1, no 2, , p. 142–9 (PMID 21927635, PMCID 3171831, DOI 10.1016/j.coviro.2011.06.003)
- BioLib, consulté le 27 mai 2016
- NCBI, consulté le 27 mai 2016
- World Register of Marine Species, consulté le 27 mai 2016
- Catalogue of Life Checklist, consulté le 27 mai 2016
- (en) Shuai Yuan, Jialing Wang, Dongjie Zhu, Nan Wang, Qiang Gao, Wenyuan Chen, Hao Tang, Junzhi Wang, Xinzheng Zhang, Hongrong Liu et al., « Cryo-EM structure of a herpesvirus capsid at 3.1 Å », Science, 6 apr 2018: (lire en ligne)
- (en) Brian R. Bowman, Matthew L.Baker, Frazer J. Rixon, Wah Chiu et Florante A. Quiocho, « Structure of the herpesvirus major capsid protein », EMBO Journal, , p. 757-765 (ISSN 0261-4189, lire en ligne)
- (en) Louise Giffin et Blossom Damania, « KSHV », dans Advances in Virus Research, vol. 88, Elsevier, (ISBN 978-0-12-800098-4, PMID 24373311, PMCID PMC4104069, DOI 10.1016/b978-0-12-800098-4.00002-7, lire en ligne), p. 111–159
- Coll, Multiscale Analysis of Independent Alzheimer’s Cohorts Finds Disruption of Molecular, Genetic, and Clinical Networks by Human Herpesvirus, Neuron, 21 juin 2018, https://www.cell.com/neuron/fulltext/S0896-6273(18)30421-5
Références biologiques
[modifier | modifier le code]- (en) Référence ICTV : Herpesviridae (consulté le )
- (en) Référence BioLib : Herpesviridae
- (en) Référence Catalogue of Life : Herpesviridae (consulté le )
- (en) Référence NCBI : Herpesviridae (taxons inclus) (consulté le )
- (en) Référence WoRMS : Herpesviridae (+ liste genres + liste espèces) (consulté le )


