Maladie de Basedow
| Spécialité | Endocrinologie |
|---|
| CIM-10 | E05.0 |
|---|---|
| CIM-9 | 242.0 |
| OMIM | 275000 |
| MedlinePlus | 000358 |
| eMedicine |
120619 ped/899 |
| MeSH | D006111 |

La maladie de Basedow ou Graves-Basedow est une hyperthyroïdie auto-immune (maladie de la thyroïde). La personne atteinte produit des anticorps anormaux (stimulant le recepteur de la TSH) dirigés contre les cellules folliculaires de la thyroïde. Plutôt que de détruire ces cellules, comme le ferait tout anticorps normal, ces anticorps reproduisent les effets de la TSH et stimulent continuellement la libération d'hormones thyroïdiennes, provoquant une hyperthyroïdie accompagnée de signes cliniques spécifiques. La maladie de Basedow ou de Graves, plus fréquente chez la femme que chez l'homme, se manifeste le plus souvent par une accélération du métabolisme basal, une diaphorèse, des pulsations cardiaques rapides et irrégulières, une augmentation de la nervosité et une perte pondérale. Il s'agit de sa forme la plus fréquente.
Elle doit son nom à Carl von Basedow.
Épidémiologie
[modifier | modifier le code]La maladie de Basedow peut toucher tout le monde, mais essentiellement les individus entre 40 et 60 ans et plus rarement à l'adolescence. Elle est cinq à dix fois plus fréquente chez les femmes. Elle est la cause de près des trois quarts des hyperthyroïdies[1].
Il existe un facteur génétique comme l'atteste une atteinte concomitante chez de vrais jumeaux[2] ainsi que la présence d'antécédents familiaux[3].
Comparativement au tabagisme actif persistant, la cessation de consommation de tabac diminue le risque de développer une maladie de Basedow, notamment dans sa forme oculaire, et plus particulièrement chez les femmes[4].
Dénomination
[modifier | modifier le code]Décrit à de nombreuses reprises, ce syndrome doit son nom à Carl von Basedow[5] mais peut avoir plusieurs dénominations[6] :
- goitre exophtalmique ;
- goitre toxique diffus ;
- hyperthyroïdie auto-immune ;
- maladie de Graves ;
- maladie de Graves-Basedow.
Causes et facteurs de risque
[modifier | modifier le code]La maladie est probablement de cause multifactorielle. Il existe une participation génétique et plusieurs gènes sont impliqués : CD40, CTLA4, PTPN22, FCRL3, gènes de la thyroglobuline et au récepteur à la TSH[7].
Le stress peut avoir un rôle provocateur[8]. Le tabagisme est un facteur de risque[9].
La maladie est plus fréquente chez la femme, faisant suspecter une participation génétique et/ou hormonale. D'autres facteurs ont été identifiés : infection à Yersinia enterocolitica, déficit en sélénium ou en vitamine D[10].
Physiopathologie
[modifier | modifier le code]L'auto-immunité se développe à partir des anticorps anti-récepteurs de la TSH, dans lequel le corps fabrique des anticorps pour le récepteur de la thyroïde-stimulant hormone (TSH-R). Ces anticorps se lient aux récepteurs TSH qui se trouvent sur les cellules qui produisent des hormones thyroïdiennes, ce qui entraîne une production anormalement élevée de T3 et T4. C'est une hypersensibilité de type V[11].
Éléments cliniques
[modifier | modifier le code]Ils comprennent l'association de signes d'hyperthyroïdie et de signes plus spécifiques de la maladie.
Hyperthyroïdie
[modifier | modifier le code]Elle se caractérise par une asthénie, un amaigrissement contrastant avec un appétit conservé voire augmenté, une hypersudation, des attitudes d'évitement de la chaleur. Il peut exister des troubles psychologiques, une agitation, une nervosité, un tremblement, une soif permanente avec augmentation des mictions (polyurie-polydipsie)
L'examen clinique montre une fréquence cardiaque accélérée (tachycardie), voire un rythme irrégulier.
Signes et symptômes plus spécifiques de la maladie
[modifier | modifier le code]Les signes et symptômes sont les suivants :
- goitre (augmentation de volume de la thyroïde) ;
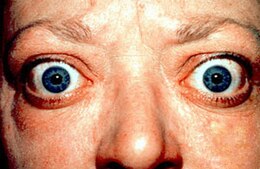
- exophtalmie (déplacement de l'œil hors de son orbite) ;
- myxœdème (infiltration cutanée) au niveau des tibias ;
- gynécomastie[12],[13] (développement excessif des glandes mammaires chez l'homme) ;
- augmentation du rythme cardiaque ;
- augmentation de l'activité métabolique ;
- plus rarement, hippocratisme digital[14] (déformation des ongles).
Diagnostic
[modifier | modifier le code]Biologie
[modifier | modifier le code]L'hyperthyroïdie est démontrée biologiquement par l'effondrement du taux de TSH dans le sang, couplé à un taux élevé de triiodothyronine (T3) et de thyroxine (T4). En cas de maladie de Basedow, il existe une élévation du taux d'anticorps anti-récepteur de la TSH (« TRAK »), hautement spécifique et sensible[15], et des TSI (Thyroid stimulating immunoglobulins).
Imagerie
[modifier | modifier le code]La scintigraphie thyroïdienne consiste en la visualisation du captage (fixation) par cet organe d'un composé radioactif. Elle montre typiquement une thyroïde augmentée de volume et hyperfixante. Elle permet de différencier la maladie de Basedow d'autres causes d'hyperthyroïdie, comme un nodule, dit « toxique », par exemple.
La vascularisation du goitre est augmentée et peut être démontrée par un doppler de la thyroïde. L'échographie de la glande, couplée au doppler, a des résultats comparables à ceux de la scintigraphie[16]. L'échographie permet par ailleurs de détecter les nodules et distinguer une thyroïdite d'un Basedow (baisse du débit dans le premier cas)[17].
L'imagerie peut ainsi mettre en évidence dans près de 35 % des cas de maladie de Basedow des nodules thyroïdiens associés, généralement non fonctionnels[18]. Dans environ 1% des cas, il est retrouvé un ou des nodules fonctionnels en plus de la maladie de Basedow (syndrome de Marine-Lenhart)[19].
Association à d'autres maladies auto-immunes
[modifier | modifier le code]- Insuffisance surrénalienne
- Myasthénie
- Thyroïdite d'Hashimoto
- Diabète de type 1
- Polyendocrinopathie auto-immune
- Syndrome de Means
Évolution
[modifier | modifier le code]Une rémission spontanée se fait dans près d'un tiers des cas[20]. Le risque de rechute à court terme après arrêt des antithyroïdiens de synthèse peut être prédit par la persistance d'un taux élevé d'anticorps anti-récepteur de la TSH[21]. Il reste toutefois élevé, dépassant 50 %[22].
Traitement
[modifier | modifier le code]Les trois options sont la prescription de médicaments antithyroïdiens de synthèse (méthimazole et propylthiouracile), l'ablation chirurgicale de la thyroïde et l'emploi d'iode radioactif (iode 131 : irathérapie), détruisant ainsi sélectivement la glande. Ces trois traitements ont une efficacité comparable mais le taux de rechute est plus élevé avec les médicaments (près de 40 %) qu'avec les deux autres méthodes[23]. Le choix de l'une ou l'autre des options dépend d'un certain nombre de paramètres, dont font partie les habitudes locales (les États-Unis recourant de manière beaucoup plus fréquente que l'Europe à l'iode radioactif en première intention[24]).
Pour les antithyroïdiens de synthèse, deux techniques de prescription peuvent être utilisés : la titration (ou recherche de la dose minimale efficace) ou la prescription à doses importantes conduisant à une hypothyroïdie et à une substitution hormonale associée[10]. dans tous les cas, un dosage des hormones thyroïdiennes doit être fait au premier mois, puis tous les trois mois si l'hyperthyroïdie est équilibrée. Le traitement est prolongé jusqu'à 18 mois[25], voire plus[26].
L'ingestion d'iode radioactif a une efficacité un peu différée[27] et se complique fréquemment d'une hypothyroïdie secondaire, traitée par substitution hormonale[28].
La prise en charge de l'atteinte oculaire a fait l'objet de la publication de recommandations par l'European Group on Graves' Orbitopathy en 2008[29]. L'exophtalmie nécessite une prévention des lésions oculaires, secondaire à une couverture insuffisante des paupières avec un risque de lésion de la cornée. Plus rarement, elle doit être traitée pour elle-même.
Divers
[modifier | modifier le code]Louis-Ferdinand Céline en 1933, met au point un produit, la Basedowine, enregistré au Laboratoire National de contrôle des médicaments sous le no 343-4 et commercialisé par les Laboratoires Gallier jusqu'en 1971[30].
Glafira Ziegelmann, première femme interne de Montpellier et la première femme admissible à l'agrégation de médecine, consacre en 1898 sa thèse au traitement de la maladie de Basedow[31].
Notes et références
[modifier | modifier le code]- (en) Weetman AP, « Graves' disease », N. Engl. J. Med., 2000;343:1236-48.
- (en) Brix TH, Kyvik KO, Christensen K, Hegedüs L, « Evidence for a major role of heredity in Graves' disease: a population-based study of two Danish twin cohorts », J. Clin. Endocrinol. Metab., 2001;86:930-4.
- (en) Manji N, Carr-Smith JD, Boelaert K et al. « Influences of age, gender, smoking, and family history on autoimmune thyroid disease phenotype », J. Clin. Endocrinol. Metab., 2006;91:4873-80.
- (en) Vestergaard P, « Smoking and thyroid disorders--a meta-analysis », Eur J Endocrinol, vol. 146, no 2, , p. 153-61. (PMID 11834423, lire en ligne [PDF])
- (en) « Article « Maladie de Basedow » », sur Who Named It?
- « Maladie de Basedow », sur mesh.inserm.fr
- Marinò M, Latrofa F, Menconi F, Chiovato L, Vitti P, « Role of genetic and non-genetic factors in the etiology of Graves disease », J. Endocrinol. Invest., 2015;38:283–294
- Winsa B, Adami HO, Bergström R et al. « Stressful life events and Graves' disease », The Lancet, 1991;338:1475–1479
- Wiersinga WM, Smoking and thyroid, Clin Endocrinol (Oxf), 2013;79:145–151
- De Leo S, Lee SY, Braverman LE, « Hyperthyroidism », The Lancet, 2016;388:906–918
- Weetman A, Hypersensitivity: Stimulatory (Type V), 2001 10.1038/npg.els.0001435
- (en) Chan WB, Yeung VT, Chow CC, So WY, Cockram CS. « Gynaecomastia as a presenting feature of thyrotoxicosis » Postgrad Med J. 1999;75(882):229-31.
- (en) Sai-Ching Jim Yeung, Mouhammed Amir Habra, Alice Cua Chiu, George T Griffing. « Graves Disease Clinical Presentation » Medscape Reference, mis à jour le 21 mars 2013, consulté le 16 mai 2013.
- Fatourechi V, Ahmed DD, Schwartz RM, « Thyroid acropachy: report of 40 patients treated at a single institution in a 26-year period », J. Clin. Endocrinol. Metab., 2002;87:5435–5441
- Tozzoli R, Bagnasco M, Giavarina D, Bizzaro N, « TSH receptor autoantibody immunoassay in patients with Graves' disease: improvement of diagnostic accuracy over different generations of methods. Systematic review and meta-analysis », Autoimmun Rev, 2012;12:107–113
- Cappelli C, Pirola I, De Martino E et al. « The role of imaging in Graves' disease: a cost-effectiveness analysis », Eur. J. Radiol., 2008;65:99–103
- Ota H, Amino N, Morita S et al. « Quantitative measurement of thyroid blood flow for differentiation of painless thyroiditis from Graves' disease », Clin. Endocrinol. (Oxf), 2007;67:41–45
- (en) Won Bae Kim et al., « Ultrasonographic screening for detection of thyroid cancer in patients with Graves' disease », Clinical Endocrinology, (DOI 10.1111/j.1365-2265.2004.02043.x, lire en ligne)
- (en) Danielle Neuman et al., « Marine-Lenhart Syndrome: Case Report, Diagnosis, and Management », Cases report in endocrinology, (DOI 10.1155/2018/3268010, lire en ligne)
- (en) Codaccioni JL, Orgiazzi J, Blanc P, Pugeat M, Roulier R, Carayon P. « Lasting remissions in patients treated for Graves' hyperthyroidism with propranolol alone: a pattern of spontaneous evolution of the disease », J. Clin. Endocrinol. Metab., 1988;67:656-62.
- Barbesino G, Tomer Y, « Clinical review: Clinical utility of TSH receptor antibodies », J. Clin. Endocrinol. Metab., 2013;98:2247–2255
- Abraham P, Avenell A, McGeoch SC, Clark LF, Bevan JS, Antithyroid drug regimen for treating Graves' hyperthyroidism, Cochrane Database Syst Rev, 2010;CD003420
- (en) Törring O, Tallstedt L, Wallin G. et al. « Graves' hyperthyroidism: treatment with antithyroid drugs, surgery, or radioiodine -- a prospective, randomized study », J. Clin. Endocrinol. Metab., 1996;81:2986-93.
- (en) Wartofsky L, Glinoer D, Solomon B et al. « Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan, and the United States » Thyroid 1991;1:129-35.
- Allannic H, Fauchet R, Orgiazzi J et al. « Antithyroid drugs and Graves' disease: a prospective randomized evaluation of the efficacy of treatment duration », J. Clin. Endocrinol. Metab., 1990;70:675–679
- Anagnostis P, Adamidou F, Polyzos SA et al. « Predictors of long-term remission in patients with Graves' disease: a single center experience », Endocrine, 2013;44:448–453
- Bonnema SJ, Hegedüs L, Radioiodine therapy in benign thyroid diseases: effects, side effects, and factors affecting therapeutic outcome, Endocr Rev, 2012;33:920-980
- Perros P, Basu A, Boelaert K et al. Postradioiodine Graves' management: the PRAGMA study, Clin Endocrinol (Oxf), 2022;97:664-675
- Bartalena L, Baldeschi L, Dickinson AJ et al. « Consensus statement of the European Group on Graves' Orbitopathy (EUGOGO) on management of Graves' orbitopathy », Thyroid, 2008;18:333–346
- Louis-Ferdinand Céline et la pharmacie, Lucie Coignerai-Devillers, Revue d'histoire de la pharmacie, 74e année, no 269, 1986. pp. 137-139.
- Ziegelmann Glafira, Pathogénie et traitement de la maladie de Basedow (thèse de Montpellier), Montpellier, Firmin et Montane, , 79 p. (lire en ligne)
Liens externes
[modifier | modifier le code]- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :