Benzene
Il benzene è un composto chimico che a temperatura ambiente e pressione atmosferica si presenta sotto forma di liquido volatile incolore altamente infiammabile, dall'odore caratteristico.[1]
| Benzene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Benzene | |
| Nomi alternativi | |
| [6]annulene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H6 |
| Massa molecolare (u) | 78,1118 |
| Aspetto | liquido incolore[1] |
| Numero CAS | |
| Numero EINECS | 200-753-7 |
| PubChem | 241 |
| SMILES | C1=CC=CC=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,8787[2] |
| Indice di rifrazione | 1,49792[3] |
| Solubilità in acqua | 1,770 g/L a 293 K |
| Coefficiente di ripartizione 1-ottanolo/acqua | 2,13 |
| Temperatura di fusione | 5,49 °C (278,64 K)[4] |
| ΔfusH0 (kJ·mol−1) | 9,8663[4] |
| ΔfusS0 (J·K−1mol−1) | 35,40[4] |
| Temperatura di ebollizione | 80,15 °C (353,30 K)[4] |
| ΔebH0 (kJ·mol−1) | 44,3 |
| Punto triplo | 278,5 K[4] |
| Punto critico | 562 K, 48,9 bar, 0,25 L/mol[4] |
| Tensione di vapore (Pa) a 293 K | 1,01×104 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 82,9 (gas),[5] 49 (liq)[6] |
| ΔfG0 (kJ·mol−1) | 124,5 |
| S0m(J·K−1mol−1) | 173,26 (liq)[6] |
| C0p,m(J·K−1mol−1) | 135,69 (liq)[6] |
| ΔcombH0 (kJ·mol−1) | −3267 (liq)[6] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 930 mg/kg (oral rat), 8260 mg/kg (dermal rat/rabbit)[7] |
| Indicazioni di sicurezza | |
| Punto di fiamma | −11 °C (262 K), closed cup[7] |
| Limiti di esplosione | 1,2÷8,6% vol.[7] |
| Temperatura di autoignizione | 555 °C (828 K)[7] |
| TLV (ppm) | 0,5 ppm[8] |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 372 - 319 - 315 - 304 - 340 - 350 |
| Consigli P | 201 - 210 - 301+310 - 331 - 305+351+338 - 308+313 - 302+352 [9] |
Dal punto di vista chimico, il benzene (talvolta indicato come Ph-H o φ-H[10][11]) è un idrocarburo aromatico monociclico avente formula bruta C6H6.[1]. Le distanze di legame tra gli atomi che compongono il benzene misurano 139 pm per il legame C-C e 110 pm per il legame C-H[12]. Il gruppo funzionale che deriva dal benzene è dovuto alla perdita di un atomo di idrogeno (C6H5-), prende il nome di fenile[13] e si indica come Ph (da non confondere con pH).
È un costituente naturale del petrolio, ma viene anche sintetizzato a partire da altri composti chimici presenti nel petrolio stesso.[14] Possiede notevoli proprietà solventi: è miscibile in tutte le proporzioni con molti altri solventi organici, mentre è molto poco solubile in acqua (0,18% a 25 °C).[3]
Viene da tempo impiegato come antidetonante nelle benzine, ma a causa della sua pericolosità per la salute e della facilità con cui contamina le falde freatiche, diverse entità (tra cui gli Stati Uniti e l'Unione europea) ne stanno scoraggiando l'uso limitandone le concentrazioni ammesse per legge[15][16].
Il termine benzolo si utilizza per indicare una miscela di benzene e dei suoi composti omologhi superiori (e allo stesso modo i termini "toluolo" o "xilolo" indicano le miscele costituite principalmente, ma non esclusivamente, da toluene e xilene).[17] Talvolta viene impiegato come sinonimo di benzene, come traduzione pedestre dal tedesco benzol, benché questo nome sia deprecato dalla IUPAC.
Storia
modificaIl benzene venne scoperto nel 1825 dallo scienziato britannico Michael Faraday, che lo isolò dal petrolio e lo chiamò bicarburo di idrogeno.[18]
Nel 1834 fu ricavata la formula empirica del benzene (CH) e in seguito la sua formula molecolare (C6H6), che destò stupore in quanto fu la prima molecola conosciuta avente un numero uguale di atomi di carbonio e di atomi di idrogeno.[19]
Nel 1834 il chimico tedesco Eilhard Mitscherlich lo ottenne mediante distillazione di acido benzoico (componente della resina di benzoino) e della calce.[20] Mitscherlich diede a questo composto il nome di benzino.[21] Nel 1847, il chimico britannico Charles Mansfield, durante i suoi studi per conto di August Wilhelm von Hofmann, isolò il benzene dal catrame.[22] Due anni dopo, ideò un metodo di produzione a scala industriale a partire dal catrame. Nel 1851 Marcellin Berthelot lo sintetizzò mediante trimerizzazione dell'acetilene (facendo scaldare l'acetilene in un tubo di vetro).[23]
Il dibattito sulla struttura molecolare del benzene
modificaQualche anno dopo venne scoperta la formula bruta di questo composto, causando molti interrogativi sulla struttura della molecola. Vennero presentate svariate strutture possibili, ma per molto tempo nessuna era in grado di spiegarne le proprietà chimiche.
In particolare nessuna delle formule di struttura proposte ne spiegava adeguatamente la reattività che, a giudicare dalla composizione elementare (C6H6), avrebbe dovuto essere simile a quella degli alcheni e degli alchini, ossia esplicarsi principalmente tramite reazioni di addizione ai doppi e tripli legami, mentre nella realtà sperimentale il benzene predilige le reazioni di sostituzione.
Una proposta in grado di conciliare la forma bruta con l'apparente assenza di doppi e tripli legami fu quella di Albert Ladenburg, in cui i sei atomi di carbonio sono disposti ai vertici di un prisma a base triangolare; tale struttura (presentata nel 1869[24]) fu però smentita dall'osservazione sperimentale, secondo cui la molecola del benzene è planare (cioè con i sei atomi di carbonio disposti sullo stesso piano). Una molecola del genere comunque esiste e oggi viene chiamata "benzene di Ladenburg" o prismano.
La prima forma strutturale corretta fu proposta nel 1861 da Johann Josef Loschmidt, che diede una base alla corretta interpretazione del modello molecolare del chimico tedesco Friedrich August Kekulé von Stradonitz nel 1865.[25]
Un'altra struttura erronea fu proposta nel 1867 da James Dewar: si trattava di un diene biciclico. Il composto, tuttora noto come benzene di Dewar[26] (o biciclo[2.2.0]esa-2,5-diene), è stato sintetizzato nel 1962.[27]
Nel 1887 Henry Edward Armstrong propone un'altra ipotetica struttura del benzene, detta "centroide di Armstrong", molto simile alla reale struttura, in quanto rappresenta con sei segmenti dei "legami delocalizzati".[28]
Altre ipotesi sulla struttura del benzene furono il benzene di Claus (proposto nel 1867,[24] e mai sintetizzato) e il benzvalene ottenuto per la prima volta nel 1971.[29] A queste si aggiungono inoltre le ipotesi avanzate da Julius Thomsen (1886), Adolf von Baeyer (1887), Vaubel (1894), Sachse (1888), Collie (1897) e Konig (1905).[24]
La formula di Kekulé
modificaNel 1865 Kekulé mise in evidenza il fatto che tutti gli atomi di idrogeno del benzene sono equivalenti ai fini della loro reattività.[30] Per rendere però possibile il fatto che un atomo di carbonio (tetravalente) legasse con soli tre atomi, postulò che i carboni legano tra loro a due a due con doppi legami; più precisamente, i doppi legami sono posizionati in maniera alternata sull'anello. Questa struttura è insatura, per cui per spiegare il fatto che il benzene dia risposta negativa ai saggi di insaturazione (non decolora il bromo disciolto in tetracloruro di carbonio, non reagisce col permanganato di potassio in soluzione acquosa[31]) Kekulé avanzò l'ipotesi che i legami doppi e semplici scambiassero la loro posizione lungo l'anello con velocità tanto elevata che le reazioni caratteristiche degli alcheni non potessero avvenire.
L'ipotesi che il benzene fosse una molecola in cui gli atomi di carbonio formano un ciclo in cui si alternano legami doppi e semplici (ovvero un "cicloesatriene") veniva invalidata dall'osservazione sperimentale della geometria della molecola, in cui tutti i legami hanno uguale lunghezza, a cui corrisponde un'energia di legame intermedia tra quella di un legame singolo e quella di un legame doppio.
In realtà la struttura del benzene si pone a metà tra quelle di due "cicloesatrieni" equivalenti; si dice che è un ibrido di risonanza tra due formule limite:
Per spiegare definitivamente la causa della particolare struttura del benzene, bisognerà aspettare la teoria degli orbitali ibridi, elaborata da Linus Pauling (premio Nobel per la chimica e per la pace) nella sua pubblicazione "La natura dei legami chimici". Infatti, i legami chimici possono essere descritti con una buona applicazione considerando che all'origine degli stessi c'è un mescolamento degli orbitali atomici (metodo LCAO, Combinazione Lineare degli Orbitali Atomici), ove n orbitali atomici si mescolano per formare n orbitali molecolari.
Gli orbitali molecolari ottenuti nel benzene (cioè sp2 per gli atomi di carbonio e s per gli idrogeni) spiegano la struttura planare e la delocalizzazione elettronica della molecola.
Questo tipo di delocalizzazione (in cui un orbitale è esteso a più atomi giacenti su un piano attraverso cui vengono condivisi 4n+2 elettroni, con n intero positivo) è associato a una particolare proprietà del benzene e di altri composti chimici, detta aromaticità. L'aromaticità è la proprietà fondamentale che distingue i composti aromatici dagli altri idrocarburi ciclici, sia in termini di stabilità sia di reattività chimica.
Nel 1929 la cristallografa Kathleen Lonsdale, utilizzando la tecnica della diffrazione ai raggi X, confermò che tutti i legami carbonio-carbonio della molecola del benzene possiedono la stessa lunghezza,[32][33] inspiegabile con la teoria di Kekulé, poiché un legame doppio è più corto di un legame singolo. Inoltre, la lunghezza dei legami carbonio-carbonio è maggiore di un legame doppio e minore di un legame singolo, come se tra gli atomi di carbonio intercorresse "un legame e mezzo".
In qualsiasi caso, ancora oggi, l'ipotesi di Kekulè viene considerata dalla comunità scientifica internazionale "una felice intuizione":[34][35]
«A proposito della scoperta del benzene si narra quanto segue: "Kekulé era a casa, alla sua scrivania e invano arrancava sulla possibile forma di una molecola con 6 atomi di carbonio e 6 di idrogeno. Esausto, andò a sedersi davanti al caminetto e si addormentò. In sogno vide gli atomi che si legavano fra loro per formare una specie di serpente. A un certo punto il serpente si morse la coda formando un anello. Al risveglio Kekulé provò a disporre i 6 atomi di carbonio in una struttura chiusa: era nato l'anello benzenico!"»
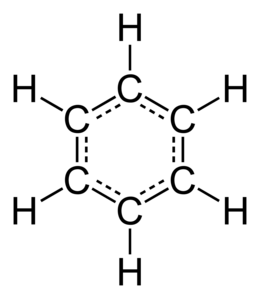
Struttura molecolare
modificaLa sua molecola è planare, i sei atomi di carbonio hanno ibridazione sp2 e sono disposti ai vertici di una struttura a esagono regolare; a ognuno di essi è legato un atomo di idrogeno. Ogni atomo di carbonio condivide con gli altri un elettrone spaiato nel proprio orbitale p non coinvolto nell'ibridazione e perpendicolare al piano della molecola. La lunghezza del legame C-C è 1,39 Å, intermedia tra quella tipica di un legame singolo carbonio-carbonio (1,54 Å) e quella tipica di un legame doppio carbonio-carbonio (1,34 Å).[36]
Per poter meglio rappresentare la natura delocalizzata del legame, spesso l'anello benzenico viene rappresentato da un esagono (ogni vertice è un atomo di carbonio, gli idrogeni sono omessi) con all'interno un cerchio.
Simboli Unicode
modificaData la sua diffusione, all'anello benzenico sono stati anche assegnati due caratteri Unicode, quello corrispondente al codice U+232C:[37]
e quello corrispondente al codice U+23E3:[38]
(Se al posto dei simboli compaiono rettangoli vuoti, è perché il set di caratteri in uso sul vostro PC non include i due caratteri).
Delocalizzazione e mesomeria
modificaLa diffrazione dei raggi X mostra che tutti e sei i legami carbonio-carbonio nel benzene hanno la stessa lunghezza, ovvero circa 140 picometri (pm).[39] Le lunghezze del legame C–C sono maggiori di un doppio legame (135 pm) ma più brevi di un singolo legame (147 pm). Questa distanza intermedia è causata dalla delocalizzazione degli elettroni, distribuiti equamente tra ciascuno dei sei atomi di carbonio. Benzene e cicloesano hanno una struttura simile, ma la delocalizzazione elettronica all'interno del benzene influisce notevolmente sulla sua reattività. La molecola è planare.[40] La descrizione dell'orbita molecolare implica la formazione di tre orbitali π delocalizzati che occupano tutti e sei gli atomi di carbonio, mentre la descrizione del legame di valenza implica una sovrapposizione di strutture di risonanza.[41][42][43][44] È probabile che questa stabilità contribuisca alle peculiari proprietà molecolari e chimiche note come "aromaticità".
Si può spiegare la struttura planare del benzene per il fatto che questa forma, gli orbitali 2p (x o y) puri (cioè non ibridati) degli atomi di carbonio ottimizzano il mescolamento elettronico laterale. Quindi non c'è nessun doppio legame tra i carboni, ma esiste una particolare struttura chiamata "sistema risonante" (o delocalizzato) che può essere descritto come la presenza dei legami singoli, ma gli elettroni dei doppi legami creano una nube elettronica che lega alternatamente ora due carboni, poi gli altri due, continuamente e con incredibile rapidità, accorciando i legami e rendendoli tutti uguali, spiegando quindi le osservazioni ai raggi X. La molecola del benzene può essere quindi così rappresentata.
In realtà, nessuna di queste due forme (rappresentate nell'immagine) esiste a causa della delocalizzazione degli elettroni pi (gli elettroni che generano la nube). In una molecola organica i legami singoli sono dei legami σ, formati da elettroni da cui dipende la possibilità di rotazione del legame e sono i più frequenti. I legami doppi sono formati da un legame σ e da un legame π, vengono prodotti da elettroni 2p (x o y) del carbonio, inoltre obbligano l'atomo a una struttura planare dei suoi tre legami disponibili.
Gli orbitali 2p (x o y), essendo perpendicolari al piano dei legami possibili per l'atomo, possono interagire liberamente tra di loro, creando la delocalizzazione: ogni elettrone non è posseduto da uno specifico atomo e non concorre a nessun legame, ma è presente su tutto l'anello, rinforzando tutti i legami in maniera equivalente.
Il fenomeno di delocalizzazione del benzene viene rappresentato con un cerchio (corrispondente alla nube elettronica) contenuto in un esagono (corrispondente allo scheletro carbonioso).
Un altro metodo per descrivere la struttura del benzene e per spiegare le sue proprietà è il metodo degli orbitali molecolari. Questo metodo venne ideato da Erich Hückel nel 1931.
Aromaticità
modificaIl fenomeno della delocalizzazione elettronica in un anello idrocarburico corrisponde a una proprietà chimica, che viene chiamata aromaticità.
L'aromaticità è una proprietà di un variegato gruppo di molecole di cui il benzene è un classico esempio ed è la responsabile di una serie di caratteristiche, tra cui l'elevata stabilità.[45]
Dal diagramma energetico di Huckel si ricava che, essendo i legami π delocalizzati su tutto l'anello, esso è stabilizzato con un'energia maggiore di 150 kJ/mol. Le reazioni chimiche alle quali partecipa il benzene sono quelle in cui tale stabilità viene conservata, ad esempio le sostituzioni degli idrogeni con altri gruppi funzionali.
Caratteristiche e proprietà fisico-chimiche
modificaIl benzene è un liquido incolore, con indice di rifrazione pari a 1,50 (molto vicino a quello del vetro).
La sua viscosità è minore di quella dell'acqua. È estremamente solubile in solventi organici apolari, ma la sua solubilità in acqua è bassissima (1,77 g/L a 20 °C).
Presenta odore caratteristico, per cui gli esseri umani possono percepire la sua presenza nell'aria a una concentrazione di soli 1,5 mg/m³ fino a una soglia massima di 900 mg/m³ di aria.
Il benzene forma azeotropo con molte sostanze, tra cui: acqua, alcol metilico, alcol etilico, alcol propilico, alcool isobutilico, metiletilchetone e cicloesano.[3]
Nella spettroscopia d'assorbimento infrarosso, il benzene presenta una banda di assorbimento intorno ai 1 500–1 600 cm−1, dovuta alle vibrazioni dei legami carbonio-carbonio, e molti picchi di assorbimento tra i 650 e i 1 000 cm−1, dovuti alle vibrazioni dei legami carbonio-idrogeno. La posizione e l'ampiezza di questi ultimi picchi danno informazioni sulle eventuali sostituzioni di alcuni atomi di idrogeno.
Nella risonanza magnetica nucleare l'idrogeno presenta un picco di sostituzione chimica δ a 7,27 ppm.[46][47]
-
Diagramma di fase del benzene
-
Pressione di vapore del benzene al variare della temperatura (allo stato liquido e solido)
-
Variazione con la temperatura della tensione superficiale del benzene
Produzione
modificaIl benzene viene prodotto per combustione incompleta di composti ricchi in carbonio, ad esempio, è prodotto naturalmente nei vulcani o negli incendi di foreste, ma anche nel fumo delle sigarette, o comunque a temperature superiori ai 500 °C.
Fino alla seconda guerra mondiale, la quasi totalità del benzene era un sottoprodotto della produzione di carbon coke nell'industria dell'acciaio. Durante gli anni cinquanta, la domanda di benzene crebbe enormemente per le richieste delle neonate fabbriche di produzione di materie plastiche, per cui fu necessario produrre il benzene anche dal petrolio.
La maggior parte del benzene è prodotta dalle industrie petrolchimiche, e in una minor parte, dal carbone.
La produzione industriale è costituita da tre procedimenti chimici che concorrono grosso modo in parti uguali alla produzione del benzene:
- il reforming catalitico
- l'idrodealchilazione del toluene
- lo steam cracking.
Nel 1996, la produzione mondiale di benzene era di 33 milioni di tonnellate, di cui 7 negli Stati Uniti, 6,5 in Europa, 4,5 in Giappone, 1,4 nella Corea del Sud e 1 milione in Cina.
Reforming catalitico
modificaCirca il 30% del benzene viene prodotto attraverso il processo di reforming catalitico.[48]
Nel reforming catalitico una miscela di idrocarburi aventi temperatura di ebollizione compresa tra 60 °C e 200 °C, a cui viene aggiunto idrogeno, viene fatta passare su un catalizzatore (cloruro platinoso o cloruro di renio) a una temperatura compresa tra 500 °C e 525 °C e una pressione compresa tra le 8 e le 50 atmosfere.
In queste condizioni, gli idrocarburi alifatici formano degli anelli (ciclizzano) perdendo degli atomi di idrogeno, per diventare idrocarburi aromatici.
I composti aromatici prodotti durante la reazione vengono separati dalla miscela mediante estrazione utilizzando dei solventi come sulfolano o glicol-dietilene. Il benzene viene invece separato dagli altri composti aromatici mediante distillazione.
Idrodealchilazione del toluene
modificaCirca il 25-30% del benzene viene prodotto attraverso il processo di idrodealchilazione del toluene.[48]
In questo processo chimico, il toluene viene mescolato con idrogeno, quindi viene fatto passare su un catalizzatore (ossido di cromo, ossido di molibdeno o ossido di platino) a una temperatura compresa tra 500 °C e 600 °C e una pressione tra 40 e 60 atm.[49] In queste condizioni, il toluene subisce una dealchilazione (perdita di un gruppo alchilico, in particolare un gruppo metilico):
La resa di questo processo è superiore al 95%. Alcuni composti aromatici più pesanti, come lo xilene, possono essere utilizzati al posto del toluene ottenendo rese comparabili.
Steam cracking
modificaCirca il 30-35% del benzene viene prodotto dal processo di steam cracking.[48]
Lo steam cracking è un processo utilizzato per produrre l'etilene e altre olefine a partire da idrocarburi alifatici. A seconda della miscela usata come materia prima nella produzione delle olefine, lo steam cracking può dare come sottoprodotto un liquido ricco in benzene, chiamato benzina di pirolisi (costituita in genere dal 50% di benzene).[48] Questo liquido può essere miscelato con altri idrocarburi per essere poi utilizzato come additivo per la benzina o essere separato per distillazione nei suoi componenti.
Utilizzi
modificaIl benzene è un solvente molto usato nell'industria chimica; è stato anche impiegato per la sintesi di varie medicine, di materie plastiche, del caucciù sintetico, e di alcuni coloranti.
Prima degli anni venti, il benzene era spesso utilizzato come solvente industriale, soprattutto per sgrassare i metalli. Quando la sua tossicità e le sue proprietà cancerogene divennero evidenti, venne rimpiazzato via via da altri solventi meno tossici nelle applicazioni che comportano un'esposizione diretta dell'operaio.
La maggior parte del benzene viene utilizzato come intermedio nella sintesi di altri composti chimici.
┌─ etilbenzene ─── stirene ─── polistirene │ │ ┌─ acetone ┌─ policarbonato ├─ cumene ─┤ ┌─ bisfenolo A ────┤ │ └─ fenolo ─┤ └─ Resine epossidiche │ └─ resine fenoliche │ benzene ┼─ nitrobenzene ─── anilina │ ├─ clorobenzene │ │ ┌─ acido adipico ─── nylon 6,6 └─ cicloesano ─┤ └─ caprolattame ─── nylon 6
- Alcuni dei composti chimici prodotti a partire dal benzene
I derivati del benzene che sono stati prodotti in quantità maggiore nel 1981 sono:[48]
- etilbenzene (49,1%): a partire dal quale viene prodotto lo stirene, a sua volta utilizzato per la produzione di materie plastiche;
- cumene (18,4%): dal quale viene prodotto il fenolo, utilizzato a sua volta per fabbricare resine, adesivi e colle;
- cicloesano (15,1%): usato per fabbricare vari tipi di nylon;
- nitrobenzene (4,5%);
- anidride maleica (2,8%);
- clorobenzene (2,5%).
Una quantità minore del benzene prodotto viene inoltre destinato alla fabbricazione di pneumatici, lubrificanti, coloranti, detergenti, medicine, esplosivi, gomme e fitofarmaci.[48]
Negli anni ottanta i principali derivati del benzene erano:
- l'etilbenzene (intermediario per la fabbricazione dello stirene), che utilizzava il 48% di tutto il benzene prodotto;
- il cumene, che ne utilizzava il 18%
- il cicloesano, che ne utilizzava il 15%
- il nitrobenzene, che ne utilizzava solo il 7%.
Aggiunto alla benzina, il benzene permette di aumentare il numero di ottano, agendo come antidetonante. Infatti, fino agli anni cinquanta, la benzina conteneva una bassa percentuale di benzene, che in seguito fu sostituito dal piombo tetraetile, meno cancerogeno, ma con gli stessi effetti antidetonanti. Comunque, a seguito dell'eliminazione del piombo nelle benzine, molti paesi sono ritornati all'utilizzo del benzene come antidetonante a causa delle strette regolamentazioni sull'uso del piombo tetraetile. Negli Stati Uniti e nell'Unione europea, le preoccupazioni sui suoi effetti nocivi sulla salute (saturnismo) e la possibilità di inquinare le falde freatiche hanno condotto a una severa regolamentazione, che fissa il limite di concentrazione di piombo tetraetile vicino all'1%.
Viene inoltre usato nella produzione del napalm.
Il benzene è una sostanza cancerogena riconosciuta, e per questo molti esperimenti descritti nei libri di chimica sono stati riscritti per evitare il contatto degli studenti col benzene. In molti casi, quando usato come solvente, può essere validamente sostituito dal toluene, molto meno nocivo.
Reattività
modificaL'aromaticità del benzene lo rende differente dal punto di vista della reattività da altri idrocarburi insaturi.
Per esempio, la maggior parte degli alcheni possono essere idrogenati (il legame doppio viene trasformato in due legami semplici mediante addizione di idrogeno) in condizioni blande di temperatura e pressione (temperatura ambiente e pressione atmosferica), utilizzando nichel come catalizzatore. Nel caso del benzene, questa stessa reazione, per avvenire con velocità di reazione paragonabili al caso precedente, deve essere svolta a una temperatura di 180 °C e una pressione di 2 000 atm.
Questa differenza sostanziale tra le condizioni in cui si svolgono i due processi (idrogenazione degli alcheni e idrogenazione del benzene) è dovuta al fatto che l'idrogenazione fa perdere il carattere aromatico, provocando una destabilizzazione del composto.
Il benzene quindi predilige le reazioni di sostituzione rispetto alle reazioni di addizione, in quanto tali reazioni di sostituzione conservano il carattere aromatico della molecola.[50]
A temperature superiori ai 600 °C dimerizza in bifenile liberando idrogeno.[7]
2 φ-H → φ-φ + H2
Sostituzione elettrofila aromatica
modificaCon il termine sostituzione elettrofila aromatica si indica una generica reazione nella quale uno degli atomi di idrogeno è sostituito da un altro gruppo funzionale. Durante questa reazione, il benzene si comporta da nucleofilo, reagendo con un elettrofilo.
Il meccanismo di reazione comporta la delocalizzazione della carica positiva portata dall'intermediario della reazione (chiamato intermediario di Wheland) per effetto della mesomeria, che tende a stabilizzare il carbocatione del benzene. Questa reazione necessita in genere di un acido di Lewis con la funzione di catalizzatore (si parla quindi di "catalisi acida").
Alchilazione di Friedel-Crafts
modificaL'alchilazione di Friedel-Crafts porta alla formazione di alchilbenzeni (ovvero composti aventi formula generale ArR[51]).
L'alchilazione di Friedel-Crafts è simile all'acilazione, tranne per il fatto che comporta l'alchilazione di un composto aromatico (quale il benzene) da parte di un alogenuro alchilico. Deve essere anch'essa catalizzata da un acido di Lewis forte.[52]
Acilazione di Friedel-Crafts
modificaL'acilazione di Friedel-Crafts porta alla formazione di acilbenzeni (ovvero composti aventi formula generale ArCOR[51]).[53] Essa è un caso particolare di sostituzione elettrofila aromatica. Questa reazione è l'acilazione di un composto aromatico, come il benzene, da parte del cloruro acilico. Questa reazione deve essere catalizzata da un acido di Lewis forte (come ad esempio AlCl3).
Derivati del benzene
modificaUn gran numero di composti chimici di rilievo nelle industrie vengono ottenuti dalla sostituzione di uno o più atomi di idrogeno del benzene da parte di altri gruppi funzionali. Nel seguito ne vengono elencati alcuni.
Sostituzione da parte del gruppo alchile
modifica- Toluene: C6H5CH3
- Etilbenzene: C6H5CH2CH3
- Xilene: C6H4(CH3)2
- Mesitilene: C6H3(CH3)3
Sostituzione da parte di altri gruppi
modifica- Fenolo: C6H5-OH
- Anilina: C6H5-NH2
- Clorobenzene: C6H5-Cl
- Nitrobenzene: C6H5-NO2
- 1,2,3-trinitrobenzene: C6H3N3O6
- Acido picrico: C6H2(OH)(NO2)3
- Trinitrotoluene: C6H2(CH3)(NO2)3
- Acido benzoico: C6H5-COOH
- Acido salicilico: C6H4(OH)COOH
- Acido acetilsalicilico: (principio attivo dell'aspirina): C6H4(O-CO-CH3)COOH
- Paracetamolo: HO-C6H4(NH-CO-CH3)
- Fenacetina: C6H4(NH-CO-CH3)(O-CH2-CH3)
Idrocarburi policiclici aromatici
modificaComposti eterociclici
modificaNei composti eterociclici sono uno o più atomi di carbonio dell'anello a essere sostituiti da altri elementi (in genere azoto, ossigeno e zolfo). In alcuni casi vengono sostituiti sia atomi di carbonio sia atomi di idrogeno.
Effetti sulla salute
modificaL'intossicazione provocata dal benzene o dai suoi derivati (ad esempio toluene, xileni o fenoli) è detta benzolismo.[54]
L'inalazione di un tasso molto elevato di benzene può portare al decesso; un'esposizione da cinque a dieci minuti a un tasso di benzene nell'aria al 2% (ovvero 20 000 ppm) è sufficiente a condurre un uomo alla morte.[48] Dei tassi più bassi possono generare sonnolenza, vertigini, tachicardia, mal di testa, tremori, stato confusionale o perdita di coscienza. La dose letale per ingestione è di circa 50÷500 mg/kg (milligrammo di sostanza ingerita rispetto al peso dell'individuo espresso in chilogrammi).[48] L'ingestione di cibi o bevande contenenti tassi elevati di benzene possono scatenare vomito, irritazione gastrica, vertigini, sonnolenza, convulsioni, tachicardia, e nei casi più gravi provocare la morte.
Il principale effetto di un'esposizione cronica al benzene è il danneggiamento dei tessuti ossei e la diminuzione delle cellule del midollo osseo, che può causare una diminuzione del tasso di globuli rossi nel sangue e un'anemia aplastica o una leucemia. Può anche dare origine a coaguli, difficoltà di coagulazione del sangue e indebolimenti del sistema immunitario.
Il benzene è stato classificato dall'IARC come agente carcinogeno del gruppo 1.[55] La sua cancerogenicità è legata al suo comportamento da agente intercalante: esso infatti "scivola" tra i nucleotidi di un acido nucleico (come il DNA) provocando errori di lettura o scrittura del codice genetico; ciò danneggia la sintesi proteica e rende incontrollata la riproduzione cellulare (portando al cancro). Danneggia soprattutto le cellule germinali[56].
Non tutti i composti planari sono necessariamente cancerogeni. Ad esempio, l'acido benzoico, molto simile al benzene, perfettamente planare (sia l'anello sia il gruppo carbossilico sono planari), non è cancerogeno (viene trasformato in acido ippurico) e i suoi sali di sodio e potassio vengono utilizzati come conservante alimentare. Allo stesso modo, la fenilalanina, un amminoacido essenziale, comprende nel suo residuo un gruppo fenile (un anello benzenico), non è assolutamente cancerogena, anzi, la mancata assunzione di tale sostanza può provocare seri problemi.
Alcune donne esposte a livelli elevati di benzene per molti mesi hanno avuto anomalie nel ciclo mestruale e una diminuzione del volume delle ovaie. Studi condotti su animali hanno dimostrato che l'esposizione al benzene durante la gravidanza porta a nascite sotto peso, ritardi nello sviluppo osseo e danni al midollo osseo.
L'effetto del benzene sulla fertilità dell'uomo o il corretto sviluppo del feto non è conosciuto, ma uno studio recente fatto su di un campione di 271 donne incinte e non fumatrici ha mostrato un aumento del rischio della riduzione del piede del bebè alla nascita e della circonferenza cranica se la mamma è stata esposta al benzene e agli altri inquinanti a esso legato. Queste madri, giunte alla ventisettesima settimana di gravidanza, hanno portato degli apparecchi in grado di dosare e misurare la quantità degli inquinanti nell'aria. Il risultato è stato che sono state esposte mediamente a 1,8 µg/m3, con dei tassi oscillanti tra 0,5 e 7,5 µg/m3. Questo studio ha dimostrato anche che il limite di 5 µg/m3, proposto dall'UE come obiettivo per il 2010 è stato superato nel 10% dei casi.[senza fonte]
Per purificare l'ambiente interno, possono essere usate delle piante (soprattutto la gerbera, il crisantemo, la sansevieria e l'edera), che hanno la capacità di utilizzare il benzene dell'aria per il loro metabolismo.
È possibile misurare l'esposizione al benzene dosandone la concentrazione nelle urine, nel sangue e nell'aria espirata, sebbene vi siano delle limitazioni a tali metodologie dovute alla trasformazione dei metaboliti del benzene.[57] Il trans,trans-acido muconico è un metabolita del benzene nell'uomo. La determinazione della sua concentrazione nelle urine è pertanto usata come biomarcatore dell'esposizione al benzene. Nel caso dell'analisi delle urine, l'esame può essere però falsato dal fatto che i prodotti di degradazione metabolica del benzene sono gli stessi derivati dal metabolismo di altre sostanze. Negli altri due casi, le analisi vanno eseguite in tempi brevi dopo l'esposizione, dato che il benzene viene metabolizzato abbastanza rapidamente.
Benzene e leucemie
modificaA causa del suo uso nell'industria della gomma, della plastica, delle vernici e petrolchimica, il benzene rappresenta un contaminante ambientale molto diffuso. La sua inalazione cronica negli umani si associa inizialmente a discrasia ematologica, che può degenerare nel corso degli anni in anemia aplastica e leucemia mieloide acuta.[58][59] Per poter esercitare azione mutagena e cancerogena, il benzene deve andare incontro a metabolismo ossidativo e trasformarsi in intermedi reattivi (detti "metaboliti"). Questi includono lo stesso fenolo, l'idrochinone, il catecolo, l'1,2,4-benzentriolo, il benzene-1,2-diidrodiolo e l'acido muconico.[59]
Esperimenti in vitro e in vivo hanno dimostrato la presenza di addotti covalenti nel midollo osseo in seguito all'esposizione a benzene.[58] Tali addotti vengono formati dai metaboliti del benzene.
Gli studi al riguardo sono stati confermati anche dieci anni dopo e sono stati aggiornati da varie scoperte:[senza fonte]
- l'anione superossido è responsabile della catalisi ossidativa dell'anello del benzene;
- la contemporanea presenza dell'enzima superossido dismutasi (SOD), neutralizza l'ossidazione del benzene da parte del superossido;
- lo ione rame bivalente (Cu2+) catalizza il "cycling" ossidoriduttivo delle forme idrossi-chinoniche e la sua azione può essere bloccata dalla SOD o dalla catalasi;
- gli studi di risonanza paramagnetica elettronica (EPR) e di intrappolamento di spin ("spin-trapping") suggeriscono che la specie radicalica che danneggia il DNA per auto-ossidazione del benzene-1,2,4-triolo non è il radicale idrossile (OH•).
- l'intervento degli enzimi ferro-dipendenti citocromo P450 è fondamentale perché il fenolo venga convertito in idrochinone.[58]
La rilevanza biologica di queste scoperte è supportata dalle osservazioni che l'esposizione di topi a benzene (per inalazione) porta a riarrangiamenti cromosomici del tipo scambio cromatidico (SCE o sister chromatid exchange). Mutazioni analoghe e altre aberrazioni sono state ritrovate nei soggetti che sono stati esposti al benzene.[60]
Metabolismo del benzene
modificaIl benzene, essendo molto volatile, viene facilmente assorbito dall'organismo in seguito a inalazione, contatto dermico o ingestione.[61]
Il modo più pericoloso per assorbire il benzene è tramite inalazione, in quanto, una volta arrivato negli alveoli polmonari viene assorbito dai fitti capillari.
L'assorbimento per via cutanea può avvenire solo se il benzene è presente allo stato liquido. La velocità di assorbimento cutaneo nell'uomo è pari a 0,4 mg/cm2·h.[61]
L'assorbimento per ingestione è teorizzato intorno al 100%, in seguito a un esperimento su cavie da laboratorio.[61]
Molti autori sostengono che la frazione di benzene eliminato mediante l'espirazione di un soggetto contaminato varia tra il 10 e il 50%, mentre per via urinaria viene espulso, senza modifiche, una quota inferiore all'1%.
La rimanente parte, quella ancora presente nel corpo, viene metabolizzata dal sistema delle monossigenasi del citocromo microsomiale P-450 2E1 (CYP2E1) per ottenere benzene epossido (agente cancerogeno e mutageno). L'ossidazione del benzene viene svolta dagli enzimi CYP2E1 e la reazione tra il benzene e un radicale idrossile formando un radicale idrossicicloesadienile intermedio rappresentano i principali sistemi metabolici utilizzati dal corpo per eliminare il benzene.[61]
Il benzene epossido può anche reagire con il glutatione dando acido S-fenilmercapturico, abbreviato con S-PMA, eliminato con le urine. Il metabolismo completo del benzene porta alla formazione di tre differenti classi di composti: metaboliti con anello idrossilato, metaboliti con anello dimerico e metaboliti ad anello aperto.
I metaboliti ad anello idrossilato, come fenolo, p-idrochinone, catecolo e 1,4-benzentriolo, formano soprattutto solfati e coniugati glucuronidici, sempre espulsi per via urinaria, inoltre tali metaboliti possono essere ulteriormente ossidati ai rispettivi semichinoni per reagire con le macromolecole cellulari.[61]
Fonti di emissione e contromisure ambientali
modificaIl benzene è annoverato nella lista degli inquinanti atmosferici redatta nel documento del Clean Air Act,[62] e come inquinante delle acque nel Clean Water Act.[48]
Il benzene è presente nei gas di scarico delle vetture: ad esempio è stato stimato che in provincia di Bolzano il 75% delle emissioni di benzene sia attribuibile al traffico dei veicoli.[63]
Uno dei luoghi in cui si hanno maggiori esposizioni al benzene del pubblico e dei lavoratori sono le stazioni di servizio,[48] in quanto è inevitabile che una certa quantità di benzene, che è contenuto nella benzina come additivo, si disperda durante le operazioni di rifornimento. Infatti, al momento del rifornimento, la manichetta può lasciare scappare una piccola quantità di benzene che a causa della sua estrema volatilità si disperde nell'aria, venendo inalato dal benzinaio e dal cliente.
Per questo motivo, in alcuni Stati (ad esempio in California) le manichette sono provviste di opportune "protezioni" che minimizzano tali emissioni di benzene.[senza fonte] Nel 2008, la Commissione europea ha proposto un progetto con lo scopo di rendere obbligatorio il recupero dei vapori della benzina durante il rifornimento. Il recupero è già obbligatorio nell'UE per lo stoccaggio e la consegna alle stazioni di servizio.[senza fonte]
Altre vie di esposizione al benzene sono: le industrie di produzione e utilizzo del benzene stesso, il fumo di tabacco e le acque inquinate da idrocarburi.[48]
Limiti di sicurezza
modificaL'EPA (Environmental Protection Agency, agenzia di protezione ambientale statunitense) ha fissato il tasso limite di benzene nelle acque potabili a 5 µg/L,[48] e ha posto l'obbligo di denunciare versamenti accidentali di benzene nell'ambiente superiori a 10 libbre (circa 4,5 kg).[senza fonte]
Il limite TLV-TWA è fissato a 0,5 ppm per un'esposizione prolungata di 8 ore al giorno e a 2,5 ppm per esposizioni non superiori ai 15 minuti.[48]
Secondo il cosiddetto MSAT2 (Mobile Source Air Toxics rule) dell'EPA, pubblicato nel 26 febbraio 2007, a partire dal 2011 le aziende che raffinano e importano benzina devono sottostare a un contenuto limite di benzene pari allo 0,62% in volume.[64]
Frasi di rischio e frasi di sicurezza
modificaIl benzene è un composto chimico molto pericoloso, e necessita quindi di molte precauzioni. Deve essere conservato tra i 15 e 25 °C.
Scheda internazionale di rischio
modificaFrasi R
modifica| Frasi R | Rischio |
|---|---|
| R: 11 | Facilmente infiammabile. |
| R: 48/23/24/25 | Tossico: pericolo di gravi danni alla salute in caso di esposizione prolungata per inalazione, a contatto con la pelle e per ingestione. |
| R: 45 | Può provocare il cancro. |
| R: 46 | Può provocare alterazioni genetiche ereditarie. |
| R: 36/38 | Irritante per gli occhi e la pelle. |
| R: 65 | Nocivo: può causare danni ai polmoni in caso di ingestione. |
Frasi S
modifica| Frasi S | Sicurezza |
|---|---|
| S: 45 | In caso d'infortunio o di malore, consultare immediatamente un medico (recare possibilmente con sé l'etichetta). |
| S: 53 | Evitare l'esposizione, procurarsi istruzioni particolari prima dell'utilizzazione. |
Contaminazioni da benzene
modifica- In seguito all'esplosione di un'azienda petrolchimica nella città di Jilin nella Repubblica Popolare Cinese il 13 novembre 2005, una quantità di benzene stimata alle cento tonnellate si è riversata nel fiume Songhua, un importante affluente del fiume Amur. Questo incidente ha causato numerosi tagli nella distribuzione dell'acqua nelle città situate a valle, come Harbin (3,8 milioni di abitanti).[65][66]
- Nel 2008 è stata ritrovata in nove confezioni di colori a tempera provenienti principalmente dalla Cina una percentuale di benzene superiore alla concentrazione limite stabilita dal decreto del Ministero della salute del 29 luglio 1994.[67][68]
- In seguito a un incendio di ingenti proporzioni presso uno stabilimento di vernici situato nel comune di Brendola, alte percentuali di benzene sono state rilevate dall'ente regionale ARPAV. (120/115 microgrammi/m3).[69]
Il benzene nell'universo
modificaNel corso degli anni sono state svolte diverse indagini per stabilire la presenza di benzene e di altri idrocarburi sui corpi del sistema solare. L'importanza di tali indagini risiede nel fatto che un'atmosfera ricca di idrocarburi e altre sostanze è una prerogativa dell'origine della vita, per cui lo studio di tali condizioni può aiutarci a comprendere come la vita si sia originata e ad avanzare ipotesi sulla probabile esistenza della vita fuori dal nostro pianeta.
- Nel 1985, nell'ambito dell'esperimento Voyager 1 IRIS, sono state riscontrate tracce di benzene sul pianeta Giove.[70]
- I risultati della missione spaziale Cassini-Huygens hanno confermato la presenza di benzene e altri idrocarburi all'interno dell'atmosfera di Titano (un satellite naturale del pianeta Saturno).[71]
- All'interno del meteorite marziano ALH 84001 sono stati ritrovati dei globuli di carbonato contenenti idrocarburi policiclici aromatici (tra cui benzene).[72]
Immagini 3D del benzene
modificaNote
modifica- ^ a b c Mariangela Spagnoli et al, Foglio di approfondimento - Benzene (PDF), su ispesl.it, Istituto superiore per la prevenzione e la sicurezza del lavoro, 2006. URL consultato il 3 luglio 2013 (archiviato dall'url originale il 5 luglio 2011).
- ^ (EN) BENZENE, su pubchem.ncbi.nlm.nih.gov.
- ^ a b c Villavecchia, p. 599.
- ^ a b c d e f (EN) National Institute of Standards and Technology - Benzene, Phase change data
- ^ (EN) National Institute of Standards and Technology - Benzene, Gas phase thermochemistry data
- ^ a b c d (EN) National Institute of Standards and Technology - Benzene, Condensed phase thermochemistry data
- ^ a b c d e (EN) BG-Institute for Occupational Safety and Health - Benzene Archiviato il 13 agosto 2011 in Internet Archive.
- ^ (EN) Haz-map Archiviato il 21 marzo 2010 in Internet Archive.
- ^ scheda del benzene su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Il benzene infatti può essere visto come un fenile (" " o " ") a cui è legato un atomo di idrogeno.
- ^ Solomons, p. 51.
- ^ A. Post Baracchi e A. Tagliabue, Chimica, progetto modulare, Andrea Bulgarini (progetto grafico, videoimpaginazione, esecuzione disegni), Torino, S. Lattes & C. Editori SpA, 2003, p. 561, ISBN 978-88-8042-337-9.
- ^ "fenile" nel vocabolario Treccani, su treccani.it. URL consultato il 18 aprile 2017 (archiviato il 19 marzo 2021).
- ^ Agenzia regionale per la protezione ambientale, Dall'a-mianto.. alla z-anzara, su arpa.veneto.it, ARPA (Veneto), 2004. URL consultato il 3 luglio 2013 (archiviato dall'url originale il 3 luglio 2013).
- ^ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ^ U.S. Environmental Protection Agency, Control of Hazardous Air Pollutants From Mobile Sources, su epa.gov, 27 giugno 2008, p. 15853. URL consultato il 29 marzo 2006 (archiviato dall'url originale il 5 dicembre 2008).
- ^ Villavecchia, p. 598.
- ^ (EN) Chemistry explained Archiviato il 19 marzo 2021 in Internet Archive.
- ^ Solomons, p. 404.
- ^ (EN) Enciclopedia Britannica, Benzene Archiviato il 19 marzo 2021 in Internet Archive.
- ^ Con il nome "benzino" ci si riferisce ad un altro composto chimico (vedi benzino), da non confondere con il benzene.
- ^ Complete Dictionary of Scientific Biography.
- ^ (EN) Enciclopedia Britannica, Pierre-Eugène-Marcellin Berthelot Archiviato il 19 marzo 2021 in Internet Archive..
- ^ a b c Shipley, p. 45.
- ^ Si racconta che August Kekulé venne ispirato da un sogno in cui aveva immaginato sei scimmiette che tenendosi la coda formavano un cerchio. Una volta sveglio immaginò che le scimmiette fossero in realtà gli atomi di carbonio disposti sui vertici di un esagono regolare. Con la tecnica della diffrazione ai raggi X e la teoria degli orbitali ibridi la teoria venne ufficialmente confermata.
- ^ J. Dewar, On the Oxidation af Phenyl Alcohol, and a Mechanical Arrangement adapted to illustrate Structure in the Non-saturated Hydrocarbons, in Proc. Royal Soc. Edinburgh, 6,62, 1867, p. 96.
- ^ E. E. Van Tamelen, S. P. Pappas, Bicyclo [2.2.0]hexa-2,5-diene, in J. Am. Chem. Soc., vol. 85, n. 20, 1963, pp. 3297-3298, DOI:10.1021/ja00903a056.
- ^ Il legame covalente, su venus.unive.it. URL consultato il 31 dicembre 2009 (archiviato dall'url originale il 16 dicembre 2009).
- ^ T.J. Katz, E.J. Wang, N. Acton, Benzvalene synthesis, in J. Am. Chem. Soc., vol. 93, n. 15, 1971, pp. 3782-3783, DOI:10.1021/ja00744a045.
- ^ Solomons, p. 406.
- ^ Solomons, p. 405.
- ^ K. Lonsdale, The Structure of the Benzene Ring in Hexamethylbenzene, in Proceedings of the Royal Society, 123A, 1929, p. 494.
- ^ K. Lonsdale, An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method, in Proceedings of the Royal Society, 133A, 1931, pp. 536-553. URL consultato l'8 marzo 2010 (archiviato il 19 marzo 2021).
- ^ A. Post Baracchi, A. Tagliabue, Chimica. Progetto Modulare Archiviato il 23 febbraio 2013 in Internet Archive., ISBN 978-88-8042-414-7, pag. 606
- ^ Marco Guglielmino, Idrocarburi aromatici, su oilproject.org, Oilproject, 14 novembre 2012. URL consultato il 28 giugno 2013 (archiviato dall'url originale il 27 giugno 2013).
- ^ Solomons, p. 409.
- ^ Unicode Character 'BENZENE RING' (U+232C), su fileformat.info. URL consultato il 16 gennaio 2009 (archiviato il 19 marzo 2021).
- ^ Unicode Character 'BENZENE RING WITH CIRCLE' (U+23E3), su fileformat.info. URL consultato il 16 gennaio 2009 (archiviato il 19 marzo 2021).
- ^ G. E. Bacon, N. Curry e S. Wilson, A Crystallographic Study of Solid Benzene by Neutron Diffraction, in Proceedings of the Royal Society of London. Series A, Mathematical and Physical Sciences, vol. 279, n. 1376, 12 maggio 1964, pp. 98-110, Bibcode:1964RSPSA.279...98B, DOI:10.1098/rspa.1964.0092, JSTOR 2414835.
- ^ Moran D, Simmonett AC, Leach FE, Allen WD, Schleyer PV, Schaefer HF, Popular Theoretical Methods Predict Benzene and Arenes To Be Nonplanar, in Journal of the American Chemical Society, vol. 128, n. 29, 2006, pp. 9342-3, DOI:10.1021/ja0630285, PMID 16848464.
- ^ David L. Cooper, Joseph Gerratt e Mario Raimondi, The electronic structure of the benzene molecule, in Nature, vol. 323, n. 6090, 1986, pp. 699-701, Bibcode:1986Natur.323..699C, DOI:10.1038/323699a0.
- ^ Linus Pauling, Electronic structure of the benzene molecule, in Nature, vol. 325, n. 6103, 1987, p. 396, Bibcode:1987Natur.325..396P, DOI:10.1038/325396d0.
- ^ Richard P. Messmer e Peter A. Schultz, The electronic structure of the benzene molecule, in Nature, vol. 329, n. 6139, 1987, p. 492, Bibcode:1987Natur.329..492M, DOI:10.1038/329492a0.
- ^ Richard D. Harcourt, The electronic structure of the benzene molecule, in Nature, vol. 329, n. 6139, 1987, pp. 491-492, Bibcode:1987Natur.329..491H, DOI:10.1038/329491b0.
- ^ Solomons, pp. 407-408.
- ^ (EN) NMR Benzene Archiviato il 18 giugno 2010 in Internet Archive.
- ^ Solomons, pp. 481 e 485.
- ^ a b c d e f g h i j k l m (EN) Hazardous Substances Data Bank
- ^ È possibile effettuare il processo anche a temperature più elevate.
- ^ Solomons, p. 434.
- ^ a b Il simbolo "Ar" in questo ambito indica un gruppo fenile, mentre "R" indica un qualsiasi radicale idrocarburico.
- ^ Solomons, p. 442.
- ^ Solomons, p. 441.
- ^ Corriere della sera.it - Dizionario della salute, su corriere.it. URL consultato il 13 marzo 2010 (archiviato il 19 marzo 2021).
- ^ Agenzia provinciale per la protezione dell'ambiente della provincia di Trento, su appa-agf.net. URL consultato l'8 marzo 2010 (archiviato dall'url originale il 10 maggio 2006).
- ^ (EN) Benzene-induced histopathological changes and germ cell population dynamics in testes of Sprague Dawley rats, su ncbi.nlm.nih.gov, NCBI, PubMed. URL consultato il 29 aprile 2019 (archiviato il 19 marzo 2021).
- ^ Agency for Toxic Substances and Disease Registry. (2007). Benzene: Patient information sheet. (PDF), su atsdr.cdc.gov. URL consultato l'8 marzo 2010 (archiviato dall'url originale il 2 febbraio 2015).
- ^ a b c (EN) Carcinogenic Effects of Benzene: An Update Archiviato il 19 marzo 2021 in Internet Archive.
- ^ a b A. Neri, S. Dragoni, G. Franco, M. Valoti, Tossicità di metaboliti del benzene a carico di diverse tipologie cellulari, su sitox.org. URL consultato il 9 marzo 2010 (archiviato dall'url originale il 30 luglio 2013).
- ^ Erexson.
- ^ a b c d e Assorbimento, metabolismo ed escrezione del benzene (PDF), su tesionline.com. URL consultato il 17 aprile 2010 (archiviato il 19 marzo 2021).
- ^ (EN) Clean Air Act, Hazardous air pollutants
- ^ Relazione sanitaria, su provincia.bz.it.
- ^ Control of Hazardous Air Pollutants From Mobile Sources:Early Credit Technology Requirement Revision
- ^ AsiaNews.it - Solo una multa per la fabbrica che ha versato benzene nel Songhua
- ^ (EN) Chinese Petrochemical Explosion Spills Toxics in Songhua River
- ^ Interrogazione parlamentare n. 4-00551
- ^ ADUC - Cina. Pennarelli per bambini cancerogeni
- ^ Società Editrice Athesis S.p.A, Benzene elevato Arpav indaga sulle diossine, su Il Giornale di Vicenza.it. URL consultato il 1º luglio 2019 (archiviato dall'url originale il 1º luglio 2019).
- ^ S. J. Kim, J. Caldwell, A. R. Rivolo, R. Wagner, Infrared Polar Brightening on Jupiter III. Spectrometry from the Voyager 1 IRIS Experiment, in Icarus, vol. 64, 1985, pp. 233-48, DOI:10.1016/0019-1035(85)90201-5. URL consultato il 28 agosto 2008.
- ^ La missione Cassini-Huygens: 4 anni in orbita attorno a Saturno Archiviato il 3 marzo 2012 in Internet Archive.
- ^ Albino Carbognani, Il pianeta Marte Archiviato il 1º dicembre 2008 in Internet Archive.
Bibliografia
modifica- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, ISBN 88-08-09414-6.
- (EN) Harry Shipley Fry, The Electronic Conception of Valence and the Constitution of Benzene, Read Books, 2007, ISBN 1-4067-0001-0.
- Vittorio Villavecchia, Gino Eigenmann, Nuovo dizionario di merceologia e chimica applicata, Volume 2, Hoepli editore, 1977, ISBN 88-203-0529-1.
- (EN) Philip M. Parker, The 2007-2012 World Outlook for Benzene, Toluene, Xylene, and Other Aromatics Made in a Refinery for Use As a Chemical Raw Material, ICON Group International, 2006, ISBN 0-497-28628-9.
- (EN) Thomas Morris Berry, The alkylation of benzene, toluene and naphthalene and the chorlination of acetylene.., BiblioBazaar, 2009, ISBN 1-113-95051-X.
- (EN) Gregory L. Erexson, James L. Wilmer, Andrew D. Kligerman, Sister Chromatid Exchange Induction in Human Lymphocytes Exposed to Benzene and Its Metabolites in Vitro, in Cancer Research, vol. 45, giugno 1985, pp. 2471-2477. URL consultato il 17 aprile 2010.
- (EN) Complete Dictionary of Scientific Biography - "Mansfield, Charles Blachford", 2008.
Voci correlate
modificaAltri progetti
modifica- Wikizionario contiene il lemma di dizionario «benzene»
- Wikimedia Commons contiene immagini o altri file sul benzene
Collegamenti esterni
modifica- Benzene, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
- benzene, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Francis A. Carey, benzene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- APAT - Emissioni di benzene in Italia dal 1990 al 2000 (PDF) [collegamento interrotto], su apat.gov.it.
- (EN) Benzene, su phc.vcu.edu. URL consultato l'8 marzo 2010 (archiviato dall'url originale il 2 febbraio 2007).
- (EN) Benzene - Product and technical information (PDF), su sunocochemicals.com. URL consultato il 9 marzo 2010 (archiviato dall'url originale il 28 novembre 2010).
- (EN) USEPA Summary of Benzene Toxicity., su epa.gov.
- (EN) MSAT Regulations and Remedies. (PDF), su processengr.com. URL consultato l'8 marzo 2010 (archiviato dall'url originale l'8 ottobre 2010).
- (EN) Calcolo della tensione di vapore e della densità del benzene.
- (FR) Fiche internationale de sécurité., su cdc.gov. URL consultato il 31 dicembre 2009 (archiviato dall'url originale il 24 marzo 2010).
- (FR) Fiche de sécurité de l'INRS. (PDF), su inrs.fr. URL consultato il 31 dicembre 2009 (archiviato dall'url originale il 24 marzo 2004).
- (FR) Ineris : Fiche de données toxicologiques et environnementales. (PDF), su chimie.ineris.fr. URL consultato il 31 dicembre 2009 (archiviato dall'url originale il 9 dicembre 2008).
- (FR) Données sur le benzène et ses dérivés sur le site de la Société française de chimie., su sfc.fr. URL consultato il 31 dicembre 2009 (archiviato dall'url originale il 2 dicembre 2008).
| Controllo di autorità | Thesaurus BNCF 22850 · LCCN (EN) sh85013229 · GND (DE) 4144541-7 · BNF (FR) cb120494267 (data) · J9U (EN, HE) 987007283270005171 · NDL (EN, JA) 00560611 |
|---|