Immidi
Le immidi sono composti organici appartenenti alla famiglia dei derivati degli acidi carbossilici, affini alle anidridi, dove però al posto dell'atomo di ossigeno a ponte troviamo un atomo di azoto. Il gruppo funzionale immidico è quindi costituito da due gruppi acilici (R-C=O) legati a un gruppo N-H; L'atomo di idrogeno può essere sostituito da un gruppo alchilico (R) o arilico (Ar), dando luogo a immidi N-sostituite.[1][2]
La loro formula di struttura è R-CO–NH–CO-R.[3] Sono composti polari, solubili anche in solventi polari; sono molecole donatrici di legame idrogeno, per il gruppo N-H, e accettrici per l'azoto e i due ossigeni dei carbonili. A differenza delle corrispondenti anidridi, resistono bene all'idrolisi e possono anche essere ricristallizzate da soluzioni acquose. Le immidi vengono generalmente preparate a partire da anidridi (o anche da alogenuri acilici) per condensazione con ammoniaca o ammine primarie. Facendo condensare ammoniaca o sali di ammonio con anidridi carbossiliche in condizioni disidratanti si ottengono le immidi:[4]
R-CO–O–CO-R + NH3 → R-CO–NH–CO-R + H2O
Queste reazioni procedono attraverso la formazione intermedia dell'ammide. Impiegando ammine primarie R'-NH2 in luogo dell'ammoniaca si ottengono le immidi N-sostituite con gruppi alchilici o arilici.
La reazione di un alogenuro acilico con un'ammide di un acido carbossilico permette anche di ottenere un'immide mista:
R-CO–Cl + R'-CO-NH2 → R-CO–NH–CO-R' + HCl ↑
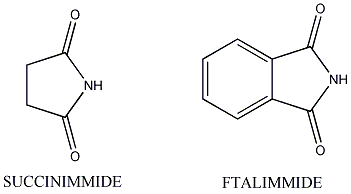
Particolarmente favorita è la preparazioni di immidi cicliche da anidridi cicliche, quali l'anidride succinica e l'anidride ftalica che danno, rispettivamente, la succinimmide e la ftalimmide. Gruppi immidici sono caratteristici del polimero polietereimmide.
Caratteristiche
[modifica | modifica wikitesto]Le immidi hanno una forza acida (Ka ≈ 10-9) decisamente maggiore delle corrispondenti ammidi (Ka ≈ 10-14),[1] che in soluzione acquosa non danno reazione acida; la forza acida delle ammidi è paragonabile a quella dello ione ammonio e quindi sono comunque acidi deboli. Il protone immidico è più acido di quello di un'ammide, in quanto legato a due gruppi carbonilici, che sono elettron-attrattori per effetto mesomero (-M) e sui quali la carica dell'anione viene delocalizzata su due carbonili invece di uno solo nelle ammidi.[5]
Le immidi non reagiscono con il bicarbonato (NaHCO3), ma si sciolgono in NaOH formando sali solubili.[5] La ftalimmide ha una costante acida espressa in pKa pari a 8,30[6] e viene usata, spesso sotto forma di sale di potassio che è commercialmente disponibile, nella preparazione di ammine primarie (Sintesi di Gabriel), con la quale si evita il problema della polialchilazione dell'ammoniaca.
Le immidi non sostituite su N reagiscono con cloro, bromo o iodio a dare le N-aloimmidi [(RC=O)2N-X]; queste, in particolare la N-bromosuccinimide (NBS), sono usate come reagenti alogenanti in quanto sono sorgenti di X+ (X = Cl, Br, I) per rottura eterolitica del legame N-X in ambienti di reazione polari, ma anche come sorgenti di alogeno radicalico, per la relativa debolezza del legame N-X, soggetto per questo a rottura omolitica; in questo caso il radicale più reattivo è quello dell'alogeno (X·), e non quello su N [·N(RC=O)2], che è delocalizzato, per cui i prodotti che si ottengono sono quelli tipici delle alogenazioni radicaliche.
Diffusione e utilizzo
[modifica | modifica wikitesto]Molti polimeri ad alte prestazioni contengono immidi, in particolare le poliimmidi, come il Kapton. In questi materiali la rigidità del gruppo funzionale immide si traduce in resistenza meccanica, alle variazioni di temperatura e agli agenti chimici.
Le immidi hanno anche un alto livello di bioattività, e per questo sono state utilizzate per alterare alcuni meccanismi biologici, a volte con risultati drammatici, come ad esempio nella cicloesimide, la talidomide e in alcuni fungicidi come il Captan.
Note
[modifica | modifica wikitesto]- ^ a b Robert T. Morrison e Robert N. Boyd, ORGANIC CHEMISTRY, 6ª ed., Prentice-Hall of India Private Limited, 2002, p. 672, ISBN 81-203-0765-8.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 76-78.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, p. 138.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=CV11P1028.
- ^ a b R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, p. 66.
- ^ Phthalimide, su chemicalbook.com, Chemical Book.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su immide
Wikimedia Commons contiene immagini o altri file su immide
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) IUPAC Gold Book, "imides", su goldbook.iupac.org.
| Controllo di autorità | GND (DE) 4149447-7 · J9U (EN, HE) 987007540895305171 |
|---|

