Quimica Inorganica
Quimica Inorganica
Enviado por
mauma18Direitos autorais:
Formatos disponíveis
Quimica Inorganica
Quimica Inorganica
Enviado por
mauma18Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Direitos autorais:
Formatos disponíveis
Quimica Inorganica
Quimica Inorganica
Enviado por
mauma18Direitos autorais:
Formatos disponíveis
Curso de Formação
de Técnicos de Operação Jr
do Abastecimento
2ª edição
Química
Aplicada
Geral e Inorgânica
PETROBRAS ABASTECIMENTO 2008 1
QualificAbast
Índice
METODOLOGIA CIENTÍFICA 06
(a) Observação e dados 06
(b) Leis 07
(c) Hipóteses e teorias 08
A MATÉRIA 10
(a) Volume, massa e inércia 10
(b) Estados da matéria 11
(c) Átomos e moléculas 13
(d) A distribuição eletrônica 19
(e) Classificação da matéria 23
TABELA PERIÓDICA 28
LIGAÇÕES QUÍMICAS 31
(a) Ligação iônica 33
(a.1) Substância iônica 34
(b) Ligação covalente 36
(b.1) Polaridade das ligações covalentes 39
(b.2) Substâncias moleculares e covalentes 41
(c) Ligações metálicas 43
(d) Número de oxidação 44
GASES 47
(a) Lei de Boyle-Mariotte: relação pressão x volume 47
(b) Lei de Charles: relação temperatura x volume 48
(c) Lei de Gay-Lussac das combinações dos volumes 48
(d) Equação de estado de um gás ideal 49
(d.1) Gases ideais x gases reais 50
(e) Propriedades de um gás 51
(e.1) Volume molar 52
(e.2) Densidade 52
(e.3) Lei de Dalton das pressões parciais para mistura de gases 55
(e.4) Difusão de um gás 55
(f) Mistura de gases 56
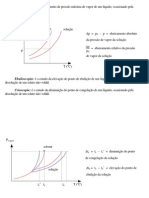
LÍQUIDOS 58
(a) Equilíbrio líquido-vapor 58
(b) Equilíbrio líquido-sólido 61
(c) Densidade relativa dos líquidos 62
SOLUÇÕES 63
(a) Concentração das soluções 64
(a.1) Concentração comum 64
(a.2) Concentração molar 65
(a.3) Molalidade 65
(a.4) Fração e percentagem molar 66
(a.5) Fração mássica 67
(a.6) Parte por milhão – ppm 67
(b) Densidade de misturas 67
(c) Solubilidade 68
(d) Propriedades coligativas 70
(d.1) Redução da pressão de vapor 71
PETROBRAS ABASTECIMENTO 2008 2
QualificAbast
Índice
(d.2) Elevação do ponto de ebulição – ebuliometria 74
(d.3) Diminuição do ponto de congelamento – crioscopia 74
(d.4) Pressão osmótica 74
(e) Fracionamento de Misturas 75
(e.1) Fracionamento de misturas heterogêneas 75
(e.2) Fracionamento de misturas homogêneas 77
FUNÇÕES INORGÂNICAS 79
(a) Ácidos e bases 82
(a.1) Classificação dos ácidos 86
(a.2) Nomenclatura dos ácidos 88
(a.3) Principais ácidos utilizados em uma refinaria 91
(a.4) Nomenclatura das bases 91
(a.5) Classificação das bases 92
(a.6) Principais bases utilizadas em uma refinaria 93
(a.7) Reações ácido-base 93
(a.8) Ação sobre indicadores 94
(b) Sais 94
(b.1) Nomenclatura dos sais 94
(b.2) Classificação dos sais 95
(b.3) Principais sais utilizados em refinarias 96
(c) Óxidos 96
(c.1) Nomenclatura dos óxidos 97
(c.2) Classificação dos óxidos 98
REAÇÕES QUÍMICAS 100
(a) A equação química 100
(a) Classificação das reações químicas 102
(b.1) Reação de oxirredução 102
(b.2) Reação de análise ou decomposição 103
(b.3) Reação de síntese ou composição 104
(b.4) Reação de deslocamento ou simples troca 104
(b.5) Reação de dupla troca 106
(b.6) Reação ácido-base 108
(b.7) Reação exotérmica e endotérmica 108
(b.8) Espontaneidade de uma reação 109
CINÉTICA QUÍMICA 111
(a) Influência da concentração na velocidade de reação 111
(b) Influência da temperatura na velocidade de reação 115
(c) Influência do catalisador na velocidade de reação 116
CÁLCULO ESTEQUIOMÉTRICO 117
EQUILÍBRIO QUÍMICO 119
(a) Deslocamento do equilíbrio químico 119
(b) Constante de equilíbrio 122
(c) Equilíbrio iônico em solução aquosa 123
(c.1) Produto iônico da água 124
(c.2) A escala de pH – potencial hidrogeniônico 125
(c.3) Solução tampão 127
PETROBRAS ABASTECIMENTO 2008 3
QualificAbast
Índice
ELETROQUÍMICA 128
(a) Pilhas ou células galvânicas 128
(b) Potencial–padrão de eletrodo 132
(c) Células eletrolíticas 135
ALGUNS ELEMENTOS IMPORTANTES E SEUS COMPOSTOS 136
(a) Hidrogênio 136
(b) Oxigênio 137
(c) Flúor 138
(d) Cloro 139
(e) Iodo 140
(f) Bromo 140
(g) Enxofre 140
(h) Nitrogênio 142
(i) Fósforo 143
(j) Alumínio 143
(l) Ferro 144
(m) Cobre 144
(n) Cromo 144
(o) Vanádio 145
(p) Titânio 145
REFERÊNCIAS BIBLIOGRÁFICAS 146
ANEXO A 147
ANEXO B 152
TABELAS
METODOLOGIA CIENTÍFICA
Tabela 1 - Dados experimentais para a formulação da Lei de Charles 07
A MATÉRIA
Tabela 1 - Distribuição dos elétrons 20
Tabela 2 - Componentes e fases de alguns sistemas 27
TABELA PERIÓDICA
Tabela 1 - Nomes dos grupos dos elementos representativos 30 APL
LIGAÇÕES QUÍMICAS ICA
Tabela 1 - Nox de alguns elementos 46 DA
SOLUÇÕES
Tabela 1 - Exemplos de soluções 63
FUNÇÕES INORGÂNICAS
Tabela 1 - Classificação quanto ao nº. de hidrogênios ionizáveis 87
Tabela 2 - Indicadores ácido-base 94
CINÉTICA QUÍMICA
Tabela 1 - Cinética de reação 112
ELETROQUÍMICA
Tabela 1 - Potenciais-padrão de eletrodo 133
PETROBRAS ABASTECIMENTO 2008 4
QualificAbast
Índice
FIGURAS
METODOLOGIA CIENTÍFICA
Figura 1 - Esquema de desenvolvimento de um método científico 09
A MATÉRIA
Figura 1 - Estrutura didática do átomo 14
Figura 2 - Eletrosfera e níveis atômicos 19
Figura 3 - Distribuição eletrônica 20 APL
Figura 4 - Camada e elétron de valência do átomo de potássio (K) 21 ICA
Figura 5 - Clasificação da matéria 23 DA
Figura 6 - Eletrólise da água 24
Figura 7 - Formas alotrópicas do carbono 25
Figura 8 - Gás liquefeito de petróleo (GLP), uma mistura de C3H8 e C4H10 26
TABELA PERIÓDICA
Figura 1 - Classificação periódica dos elementos 28
Figura 2 - Subnível mais energético de cada grupo da tabela periódica 29
LIGAÇÕES QUÍMICAS
Figura 1 - Formação do sólido iônico 35
Figura 2 - Estrutura do NaCl 36
Figura 3 - Nuvem eletrônica em estrutura metálica 44
LÍQUIDOS
Figura 1 - Gráfico de pressão de vapor para o éter dietílico, etanol e água 59
SOLUÇÕES
Figura 1 - Variação da solubilidade com a temperatura 68
Figura 2 - Redução da pressão de vapor 71
Figura 3 - Pressão de vapor – (a) parcial para a substância 1; (b)
73
parcial para a substância 2; e (c) total da solução
Figura 4 - Aparelhagem de laboratório para destilação fracionada 78
FUNÇÕES INORGÂNICAS
Figura 1 - Ensaio de condutibilidade elétrica de soluções 80
REAÇÕES QUÍMICAS
Figura 1 - Ordem de reatividade de metais e não-metais 105
CINÉTICA QUÍMICA
Figura 1 - Cálculo da velocidade instantânea de uma reação 113
Figura 2 - Energia de ativação 115
EQUILÍBRIO QUÍMICO
Figura 1 - Escalas de pH e pOH 126
ELETROQUÍMICA
Figura 1 - Corrosão do ferro da esponja de aço 129
Figura 2 - Pilha ou célula galvânica de zinco/cobre 131
PETROBRAS ABASTECIMENTO 2008 5
QualificAbast
PETROBRAS ABASTECIMENTO 2008 6
QualificAbast
[Metodologia científica
Todos os processos de desenvolvimento científico (e conseqüentemente
tecnológico) são em sua grande maioria concebidos à luz do método científico.
O método científico, como o próprio nome enaltece, é constituído de procedimentos
rigorosos de observação e registro de dados, a partir dos quais hipóteses, teorias e
leis são definidas, comprovadas, publicadas e utilizadas em busca do avanço da
humanidade.
(a) Observação e dados
O processo do método científico tem início a partir da observação de algum
fenômeno. Embora essas observações sejam algumas vezes acidentais, elas devem
ser feitas sob condições rigorosamente controladas para terem validade dentro do
método científico. Essas obser vações podem ser de cunho qualitativo ou
quantitativo. As observações qualitativas não estão em busca de números ou
quantidades, mas buscam observar outros aspectos, tais como cor, odor, liberação
ou absorção de calor, reatividade ou não. Por exemplo, a química analítica qualitativa
utiliza a caracterização de substâncias através da cor que elas apresentam após
reagirem com substâncias já conhecidas. Por sua vez, as observações e testes
quantitativos procuram quantificar com números os fenômenos observados. Pode-
se, então, utilizar um instrumento para obter o valor numérico do comprimento de
onda refletido por uma superfície que apresente uma cor e, dessa maneira,
determinar exatamente (quantitativamente) a cor desta superfície.
PETROBRAS ABASTECIMENTO 2008 7
QualificAbast
A seqüência do método científico se dá com os registros das observações,
os quais são chamados de dados. É através dos dados que se pode definir
uma lei ou basear a formulação de uma teoria. Os dados das observações
quantitativas são freqüentemente dispostos em tabelas numéricas e podem
também ser representados por relações matemáticas e gráficos. Para a ob-
tenção de equações matemáticas, normalmente se lançam os dados tabela-
dos em um gráfico, com base na curva traçada, obtém-se a equação utili-
zando-se algum método matemático (geralmente métodos numéricos).
(b) Leis
A análise dos dados pode indicar uma relação intrínseca entre eles, que se revela
através de uma tendência ou uma constante que os relaciona. Essas relações
entre os dados são descritas como leis. Vamos tomar como exemplo a Lei de
Charles. De acordo com essa lei, o volume de um gás é diretamente proporcional
à sua temperatura absoluta, sob pressão constante. Em outras palavras, um
aumento na temperatura provoca um aumento no volume do gás, de acordo com
uma constante. Observe a Tabela 1. Nessa tabela estão registrados os dados
observados em sucessivos experimentos realizados com um gás, semelhantemente
ao experimento de Charles. Nesse experimento, mostra-se que variando a
temperatura de um gás contido em um recipiente, o volume que este gás ocupa
é proporcional a essa variação de temperatura.
Tabela 1 – Dados experimentais para a formulção da Lei de Charles
Experimento Temperatura (K) Volume (L) Temperatura/Volume (K/L)
1 273 14,92 18,3
2 283 15,46 18,3
3 293 16,01 18,3
4 303 16,56 18,3
PETROBRAS ABASTECIMENTO 2008 8
QualificAbast
A razão entre a temperatura do gás e o volume ocupado por este gás é uma
constante. Este mesmo experimento, realizado para outros gases, também mostrou
que a razão mantinha-se constante. Essa conclusão sobre a relação entre os
dados observados está enunciada sob a Lei de Charles.
(c) Hipóteses e teorias
Após a observação e registro de dados científicos, pode-se então procurar a
relação entre eles e enunciar-se uma lei que descreva esse fenômeno. Entre-
tanto, a lei não explica por que os eventos ocorrem dessa maneira. Então, o
levantamento de hipóteses (tentativas de respostas ou previsões) é feito para
explicar “Por quê?”, “Como?”, “Qual a razão desse resultado?”, observado
para esse fenômeno. As respostas que se sustentam após vários experimentos
são chamadas de teorias.
O sucesso de uma teoria reside no fato de ela conseguir prever, com certa
confiabilidade, resultados de diferentes experimentos sob a mesma ótica para a
qual foi desenvolvida. Caso os novos experimentos concordem com os resultados
previamente prescritos pela teoria, esta é aceita e torna-se ainda mais confiável.
Caso os resultados práticos observados não estejam de acordo com a teoria, esta
é modificada para conseguir explicar os novos resultados ou então é inteiramente
abandonada, sendo necessário o desenvolvimento de uma nova teoria.
A teoria, então, é constituída de um modelo, que busca primeiramente explicar os
dados observados e posteriormente prever novos resultados. Dessa maneira, o
método científico constitui-se de um processo lógico de descrição e compreensão
da natureza, e o Homem, através da Química, Física e outras ciências, segue sua
evolução. Temos, então, um ciclo fechado, como mostra a Figura 1, que apresenta
as relações entre observações, dados, leis, teorias propostas e novos experimentos.
Devemos considerar, no entanto, que por mais bem-sucedido e consistente que
seja um modelo teórico, ele é apenas a descrição idealizada do fenômeno,
PETROBRAS ABASTECIMENTO 2008 9
QualificAbast
tendo sido formulado por pessoas, em uma determinada época, e não des-
creve perfeitamente a realidade. Portanto, dependendo do avanço tecnológico,
teorias que antes pareciam ilustrar a realidade podem ser superadas.
Figura 1 – Esquema de desenvolvimento de um método científico
PETROBRAS ABASTECIMENTO 2008 10
QualificAbast
[A matéria
A matéria pode ser definida como tudo aquilo que ocupa lugar no espaço e que
possui massa. Então, tudo que tenha volume e massa, por menores que sejam,
é definido como matéria.
(a) Volume, massa e inércia
O conceito de massa é um pouco mais complexo que o conceito de volume.
Volume, como bem sabemos, é o lugar geométrico que um corpo ocupa no
espaço e pode ser definido em função dos eixos de coordenadas cartesianas.
A massa de um corpo exprime a capacidade deste mesmo corpo em se manter
no estado de inércia. Inércia é a resistência de um corpo em modificar seu
estado de repouso ou movimento uniforme na presença de uma força aplicada
sobre si. Um objeto em repouso e um objeto em movimento com determinada
velocidade e direção tendem a permanecer nessas condições indefinidamente.
Desse modo, dois corpos com massas diferentes serão perturbados de maneira
diferente (atingirão velocidades e alcance distintos) se sobre eles for aplicada
uma força de igual intensidade e direção.
Através da observação, o célebre físico Isaac Newton descobriu que a força
aplicada sobre um corpo é proporcional à aceleração experimentada por este
corpo, tendo como constante de proporcionalidade a sua massa. Assim,
F = m.a
onde m é a massa kg, a é a aceleração m/s2 e F é a força em N.
PETROBRAS ABASTECIMENTO 2008 11
QualificAbast
A massa de um objeto é determinada através de instrumentos de medição que
comparam o objeto a ser pesado (o termo pesado é erroneamente utilizado e a
seguir será explicado o porquê) com um outro objeto ou conjunto de objetos com
a massa já conhecida (um padrão). Esses instrumentos são as balanças, que são
usadas em laboratórios (onde é necessário medir massas tão pequenas, que até
a gordura presente nos dedos do analista, se em contato com o recipiente que
contém o material a ser pesado, interfere no valor real), em indústrias (onde são
necessários medir toneladas de materiais), passando pelo nosso dia-a-dia, quando,
por exemplo, compramos batatas em um supermercado.
Como citado anteriormente, o conceito de massa ao longo dos tempos tem sido
erroneamente confundido com o conceito de peso. Peso é a medida da força com
que uma massa atrai a outra. Por exemplo, no planeta Terra, o peso de um
objeto é a intensidade com que a força gravitacional da Terra atrai o objeto. O
peso de um corpo depende então da massa do objeto a ser atraído, da massa da
Terra e da distância que este corpo se encontra do centro da Terra. Um corpo tem
no nível do mar um peso maior do que se estivesse no topo da mais alta montanha
do mundo, o Monte Everest. Porém, a massa do corpo é a mesma. Dessa maneira,
fica claro que os conceitos de massa e peso são diferentes e devem ser distinguidos
de modo que quando essas grandezas forem mencionadas em um artigo ou na
aprendizagem de um novo conceito, sejam compreendidas no seu sentido científico
e não no sentido coloquial.
(b) Estados da matéria
As propriedades físicas dos corpos permitem que sejam definidos três estados
físicos da matéria. Esses estados dependem basicamente das condições de
temperatura e pressão sob as quais o corpo está submetido.
Sólidos: possuem forma e volume próprios, pois as moléculas que os constituem
estão fortemente unidas por forças intermoleculares, organizadas na grande
maioria dos sólidos em retículos cristalinos. Alterações na pressão e temperatura
PETROBRAS ABASTECIMENTO 2008 12
QualificAbast
(desde que não haja transformação de estado físico) provocam pequenas modi-
ficações de contração ou expansão, podendo ser em muitos casos desprezadas,
dependendo da aplicação. Um sólido apresenta uma estrutura extremamente
compacta, na qual as partículas estão fortemente ligadas.
Líquidos: suas moléculas não estão organizadas em estruturas definidas e não
se encontram fortemente interligadas, possuindo um certo grau de mobilidade.
Por isso, os líquidos não apresentam forma própria e se adaptam à forma do
recipiente que os contém. Em contrapartida, possuem volume definido, sendo a
variação deste em relação à pressão e temperatura pouco considerável (desde
que não haja transformação de estado físico).
Gases: não possuem forma definida nem volume próprio. As moléculas dos ga-
ses estão muito mais distanciadas umas das outras do que no caso dos estados
líquido e sólido. O gás toma a forma do recipiente que o contém e seu volume é
fortemente dependente da pressão e da temperatura em que se encontra.
As forças que mantêm unidos sólidos e líquidos são chamadas de forças
intermoleculares, e serão tratadas adiante.
A matéria pode assumir qualquer um desses estados, que dependem da tempe-
ratura e pressão. Existem diagramas de fase ou de estado físico que descrevem
o comportamento das substâncias em relação a essas variáveis. É de extrema
importância o conhecimento do comportamento das substâncias em relação à
temperatura e pressão, pois vários processos na indústria, inclusive no
processamento de petróleo, são baseados nessas condições.
Os gases e os líquidos, ao contrário dos sólidos, podem ser agrupados na definição
de fluidos, pois estes dois estados físicos da matéria têm a capacidade de fluir. O
estudo sobre o fluxo de fluidos constitui um extenso campo de estudo do qual se
ocupa a Mecânica dos Fluidos, área extremamente importante na Engenharia e,
conseqüentemente, na aplicação dos conhecimentos físicos e químicos na indústria.
PETROBRAS ABASTECIMENTO 2008 13
QualificAbast
(c) Átomos e moléculas
A palavra átomo tem origem na Grécia antiga, e significa “indivisível”. Ainda que
se saiba que os átomos são constituídos de partículas subatômicas, esta
denominação permaneceu até hoje. A química moderna observa os fenômenos
químicos, interpreta seus dados e formula teorias baseando-se fielmente no
conceito de que a matéria se apresenta de uma forma descontínua, formada por
entidades denominadas de átomos.
Hoje em dia são conhecidos 112 tipos de átomos, sendo 90 naturais e o restante
artificial (produzido em laboratório mediante aceleração de partículas). A
combinação desses átomos de diversas maneiras forma toda a espécie de matéria
existente.
As diferentes combinações entre átomos resultam em grupamentos denominados
moléculas. Dois ou mais átomos do mesmo ou de diferentes tipos compõem
uma molécula. Em uma molécula, os átomos permanecem unidos por forças
que são denominadas ligações químicas. É importante salientar que as moléculas
de uma determinada substância podem estar juntas umas das outras, unidas
por forças intermoleculares, como nos estados sólido ou líquido, ou afastadas,
como no estado gasoso. Porém, os átomos que compõem a molécula estão sempre
ligados quimicamente. As forças intermoleculares não são ligações químicas.
A estrutura atômica dos átomos como conhecemos hoje em dia foi sendo
gradativamente formulada por hipóteses e teorias que eram constantemente
reformuladas e agregadas de novos dados, à medida que os experimentos
investigativos em torno do átomo foram avançando. Vários modelos foram descritos
e chegou-se hoje em dia a uma estrutura tão complexa, que toda a ciência
precisou ser reformulada e vista com outros olhos para que a estrutura atômica,
recheada de partículas e subpartículas, fosse descrita. Esse estudo pertence à
Mecânica Quântica, e envolve uma matemática e conhecimentos físicos
extremamente sofisticados. Para o nosso propósito, ficaremos com o modelo que
PETROBRAS ABASTECIMENTO 2008 14
QualificAbast
explica a grande maioria dos eventos físicos e químicos e que se encontra
representado na Figura 1
Figura 1 – Estrutura didática do átomo
Fonte: SARDELLA e MATEUS, 1991 – Adaptação.
Nesse modelo, o átomo é composto por três tipos de partículas: prótons, nêutrons
e elétrons.
O núcleo de um átomo é composto por prótons e nêutrons. Os elétrons orbitam na
eletrosfera que se encontra ao redor do núcleo. Vários experimentos foram realizados
ao longo do tempo para que esta configuração fosse adotada. Porém, ela é
meramente didática, pois o núcleo de um átomo é milhares de vezes menor que o
seu tamanho, sendo que a maior parte do átomo é a eletrosfera. Outra aproximação
é a forma como os elétrons são representados. Na verdade, a Mecânica Quântica
caracterizou o que realmente os elétrons são. Os elétrons se comportam como
ondas e como partículas, e não há como precisar sua posição e seu momento no
espaço; por isso, o conceito de órbita foi substituído pelo conceito de densidade de
probabilidade de se encontrar o elétron, o que chamamos de orbital.
A seguir, serão apresentadas características sobre essas partículas, que foram
determinadas por vários cientistas e seus métodos bem-sucedidos de experimentos
e conclusões acerca dos dados observados.
PETROBRAS ABASTECIMENTO 2008 15
QualificAbast
O próton e o elétron possuem carga. O próton possui carga positiva e o elétron
carga negativa. O nêutron, como o nome sugere, é neutro. É dessas cargas dos
prótons e elétrons que as interações entre átomos ocorrem. Um átomo pode ser
neutro (como o é em seu estado fundamental) ou pode constituir um íon (se o
átomo ou um aglomerado deles possui carga, positiva ou negativa). O próton e o
nêutron possuem massa, sendo a massa deles quase idêntica, e ambas
aproximadamente igual à unidade de massa atômica. O elétron não possui massa,
ou melhor, a massa do elétron representa 1/1 837 vezes a massa de um próton,
sendo desprezível até para as dimensões dos átomos.
Átomos do mesmo tipo são os que possuem o mesmo número de prótons, e são
denominados isótopos quando o número de nêutrons varia. Como o número de
prótons define o elemento químico ao qual o átomo pertence, esse número passou
a ser chamado de número atômico, e é simbolizado pela letra Z.
Número de prótons = Número atômico = Z
Então, com base nessa definição, podemos citar como exemplos:
HIDROGÊNIO – qualquer átomo que possui 1 próton.
CARBONO – qualquer átomo que possui 6 prótons.
OXIGÊNIO – qualquer átomo que possui 8 prótons.
Cada elemento químico, isto é, cada conjunto de átomos de mesmo número
atômico, é representado por um nome e um símbolo, que pode ser uma letra
maiúscula ou uma letra maiúscula seguida de outra minúscula. Alguns nomes
são derivados do latim, e por isso o símbolo que o representa não é a letra inicial
do nome do elemento.
Massa atômica
Massa atômica é a massa de um átomo, e é, por definição, o número que indica
quantas vezes a média ponderal (inclui a abundância entre os isótopos) da massa
dos isótopos desse átomo é mais pesada que uma unidade de massa atômica. A
massa de um átomo é expressa em unidades de massa atômica.
PETROBRAS ABASTECIMENTO 2008 16
QualificAbast
Um exemplo de isótopo bastante conhecido é o carbono 14 (14C); porém o isótopo
mais abundante é o carbono 12 (12C). A média ponderal da massa dos dois isótopos
é a massa tabelada. A água “pesada” ou “deuterada” é a molécula de água com
um hidrogênio que possui um nêutron, chamado de deutério (2H). Na natureza,
geralmente, os elementos químicos apresentam formas isotópicas em proporções
bastante distintas. Portanto, a média ponderal proveniente das massas dos isótopos
em relação às suas proporções na natureza é a massa atômica tabelada.
Unidade de massa atômica
É uma unidade extremamente pequena, e é simbolizada pela letra u. Uma unidade
de massa atômica corresponde a 1/12 da massa do isótopo mais abundante de
carbono, o 12
C. Então, o isótopo 12
C tem massa igual a 12 vezes a unidade de
massa atômica. Porém, na tabela periódica encontraremos que a massa atômica
do elemento carbono é 12,011. Como dissemos anteriormente, essa é a massa
da média entre os isótopos de carbono existentes.
Número de massa
Praticamente toda a massa do átomo está concentrada no núcleo. O núcleo é por
sua vez constituído de prótons e nêutrons. Então, o número de massa, representado
pela letra A, é definido como a soma do número de prótons (Z) mais o número de
nêutrons (N).
A=Z+N (1)
Por exemplo, o átomo de oxigênio (16O) tem 8 prótons (Z = 8) e 8 nêutrons
(N = 8). Então, o número de massa do oxigênio é igual a 16.
A = Z + N = 8 + 8 = 16
Para calcular a massa atômica, devemos somar as parcelas correspondentes à
multiplicação do número de massa de cada isótopo pela percentagem desse isótopo
existente no planeta, ou seja, efetuar o cálculo da média ponderal dos respectivos
números de massa. Portanto, número de massa é diferente de massa atômica.
PETROBRAS ABASTECIMENTO 2008 17
QualificAbast
Mol e o Número de Avogadro
Um único átomo é tão pequeno e sua massa é tão insignificante, que uma peque-
na amostra de uma substância contém uma quantidade muito grande de átomos.
Se utilizássemos as medidas usuais de massa, expressaríamos a massa dos áto-
mos com números tão pequenos, que não seria prático. Por isso, foi definida uma
unidade de quantidade de matéria, chamada mol, que representa um número.
Assim como a dúzia representa 12 unidades, a dezena representa 10 unidades,
temos na química o mol para representar também um número que expressa
quantidade. Podemos ter então 1mol de átomos, 1mol de moléculas, 1mol de
íons, 1mol de canetas, ou seja, o mol representa uma quantidade, um número.
Esse número representado pelo mol, porém, é um número que não condiz com
nada que se possa comparar na nossa vida cotidiana. O mol representa o chamado
número de Avogadro. Esse número é igual a 6,02.1023.
1mol = 6,02.1023
Esse é um número muito, mas muito grande. Porém, é coerente com as grandezas
que queremos medir, pois como veremos a seguir, 12g de 12C possuem 1mol de
átomos desse elemento, isto é, um átomo de 12C pesa 12u, e 6,02.1023 átomos de
12
C pesam 12g.
Daqui vem então o conceito de massa molar, representada pela letra M. A massa
molar representa a massa de 1mol de alguma espécie química. Como já foi dito, a
massa de 1mol de 12C é 12g, portanto sua massa molar é M = 12g/mol. A massa
molar do 16O é M =16g/mol, pois sua massa atômica é 16u. Para as moléculas, a
massa molar é igual à soma das massas molares dos átomos que a constituem.
PETROBRAS ABASTECIMENTO 2008 18
QualificAbast
Exemplos:
· 1mol de 1H = 6,02 . 1023 átomos de 1H = 1g de 1H
· 1mol de 16 S = 6,02 . 1023 átomos de 16S = 16g de 16S
· 1mol de 35,45 Cl = 6,02 . 1023 átomos de 35,45Cl = 35,45g de 35,45
Cl
· 1mol de H2O = 6,02 . 10 23 moléculas H2O = 18g de H2O
pois: 2mols de 1H = 2g
1mol de 16O = 16g
O exemplo acima com a molécula de água (H 2O) nos mostra então que em 1mol
de água, temos 2mols de átomos de hidrogênio (1H) e 1mol de átomos de oxigênio
(16O). Não devemos confundir átomos de hidrogênio (H), com moléculas de
hidrogênio (H2), nem tampouco átomos de O com moléculas de O2. A água é
formada por dois átomos de hidrogênio e um átomo de oxigênio. Porém, a
decomposição da água em seus elementos constituintes forma sempre moléculas
de H2 e de O2, pois, pela teoria do orbital molecular, estas são as formas mais
estáveis (e conseqüentemente mais prováveis) de se encontrar estas substâncias.
Existe então uma maneira de se calcular quantos mols de uma substância existem
em uma certa massa desta mesma substância. Representando-se o número de
mols por n, temos:
massa [g]
n= = [mol] (2)
massa molar g
[ mol ]
Então, 18g de água contêm 1mol de moléculas de água, pois a massa = 18g e
M = 18g/mol:
18[g]
n= = 1mol
18[g/mol]
PETROBRAS ABASTECIMENTO 2008 19
QualificAbast
(d) A distribuição eletrônica
Os elétrons não são partículas da maneira como são tratados. Como já menciona-
mos anteriormente, os elétrons são encontrados em regiões de densidade de carga
que possuem formas esféricas, de halteres, e outras mais complexas, sendo todas
explicadas e previstas pela teoria da Mecânica Quântica. Porém, para nossos
objetivos, o modelo simplificado, representado na Figura 2, é bastante útil.
Podemos considerar os elétrons como sendo partículas que orbitam (giram) em
torno do núcleo do átomo. Como o núcleo é composto por prótons (carga +) e
nêutrons (carga nula) e o número de elétrons (carga -) é igual ao número de
prótons, o átomo está em equilíbrio eletrostático, quando se encontra no estado
fundamental. Os elétrons habitam uma região que se chama eletrosfera. A
eletrosfera representa quase todo o tamanho do átomo, sendo o tamanho do
núcleo muito pequeno.
Figura 2 – Eletrosfera e níveis atômicos
Fonte: SARDELLA e MATEUS, 1991 – Adaptação.
Cada nível ou camada representa um nível de energia que o elétron ocupa, e é
representado por letras que vão de K até Q (poderiam continuar, caso existissem
átomos com quantidade de elétrons superior à quantidade que esta distribuição
suporta), ou representado por números. À medida que se avança do nível mais
interno para o mais externo, a energia da camada eletrônica é maior.
Cada nível ou camada é subdividido em subníveis de energia. Os subníveis são
simbolizados por letras características.
PETROBRAS ABASTECIMENTO 2008 20
QualificAbast
1º subnível – s (1 orbital)
2º subnível – p (3 orbitais)
3º subnível – d (5 orbitais)
4º subnível – f (7 orbitais)
Sabe-se também que cada subnível é dividido em orbitais, que representam
onde os elétrons estão alocados. Cada orbital pode comportar até 2 elétrons.
Depois do 5º nível (camada O), os subníveis poderiam continuar aumentando,
porém já não existem átomos na natureza que possuam elétrons suficientes para
completar estes subníveis. Dessa maneira, podemos montar a Tabela 1, que
nos apresenta como a eletrosfera está organizada para a distribuição dos
elétrons dos átomos conhecidos.
Tabela 1 – Distribuição dos elétrons
Nível Subnível Orbitais Nº de elétrons
K – 1 s 1 2
L – 2 s–p 4 8
M – 3 s–p–d 9 18
N – 4 s–p–d–f 16 32
O – 5 s–p–d–f 16 32
P – 6 s–p–d 9 18
Q – 7 s 1 2
A maneira como devemos distribuir
os elétrons foi dada por Linus Pauling
através do Diagrama de Pauling,
representado na Figura 3.
Figura 3 – Distribuição eletrônica
Fonte: SARDELLA e MATEUS, 1991
PETROBRAS ABASTECIMENTO 2008 21
QualificAbast
Esta distribuição nos dá a ordem de energia dos subníveis, e podemos perceber
que existem situações em que elétrons de níveis inferiores têm energia superior
à energia de alguns elétrons de camadas superiores, porque o subnível também
influi na energia do elétron.
Na Figura 4 está representado o átomo de potássio (Z = 19), cuja distribui-
ção eletrônica é dada por 1s2 2s2 2p6 3s2 3p6 4s1.
Figura 4 – Camada e elétron de valência do átomo de potássio (K)
Podemos notar que o elétron do subnível 4s é o mais energético e também o
elétron de valência, pois a distribuição eletrônica “terminou em 4s1”, e a camada
de valência é justamente a camada N.
Nem sempre o elétron de valência será o elétron mais energético. Vejamos o exem-
plo do átomo de Sc (Z = 21). Sua distribuição eletrônica é dada por 1s2 2s2 2p6
3s2 3p6 4s2 3d1. Nesse caso, os elétrons de valência são os do subnível 4s (cama-
da N), mas o elétron mais energético se encontra no subnível 3d (camada M).
A formação de íons
Os átomos, quando estão em seu estado fundamental, possuem o número de
prótons igual ao número de elétrons. Dessa forma, o total de cargas positivas
(prótons) anula o total de cargas negativas (elétrons), isto é, o átomo encontra-se
eletricamente neutro. Porém, os átomos podem ganhar ou perder elétrons (o que
pode ocorrer durante a formação de uma ligação química ou em outras situações
PETROBRAS ABASTECIMENTO 2008 22
QualificAbast
especiais), sem que seu núcleo, composto de prótons e nêutrons, sofra alguma
alteração. Nesses casos, haverá diferença entre o número de cargas negativas e
positivas, formando o que chamamos de íon.
Vamos observar os exemplos a seguir.
O átomo de cloro (17Cl) em seu estado fundamental possui 17 prótons e 17
elétrons. Ao ganhar um elétron, fica com 17 prótons e 18 elétrons, e passa a ser
um íon negativo com carga -1. Todos os íons negativos são denominados de
ÂNIONS.
O átomo de sódio (23Na) tem em seu estado fundamental 11 prótons e 11 elétrons.
Ao perder um elétron, fica com os mesmos 11 prótons, porém com 10 elétrons,
e passa a ser um íon positivo com carga +1. Todos os íons positivos são chamados
de CÁTIONS.
Podemos perceber pelas figuras que o íon não possui o mesmo tamanho que o
átomo que lhe deu origem. Quando o átomo de cloro recebeu um elétron, passou
PETROBRAS ABASTECIMENTO 2008 23
QualificAbast
a ser o ânion cloreto, que é maior do que o átomo de cloro. Em contrapartida, o
átomo de sódio quando perdeu um elétron, passou a ser o cátion sódio, que é
menor do que o átomo de sódio. Os elétrons causam um efeito que é denominado
blindagem do núcleo atômico. Eles provocam uma blindagem eletrônica das
cargas positivas que estão no núcleo, e ao serem retirados, o núcleo consegue
atrair os elétrons remanescentes com maior intensidade, fazendo com que seu
raio diminua. De outro lado, se um elétron é adicionado ao átomo, o núcleo
perde força na atração dos elétrons e o raio atômico aumenta.
Os íons podem ser átomos ou um agrupamento de átomos, como, por exemplo,
o íon sulfato (SO4 2-), que possui cinco átomos e duas cargas negativas. Mais
adiante, quando os conceitos de ligações químicas e de soluções eletrolíticas
forem abordados, voltaremos a falar sobre íons.
(e) Classificação da matéria
A matéria pode ser classificada de acordo com sua composição em substâncias
puras ou misturas. As substâncias puras, por sua vez, podem ser simples ou
compostas e as misturas podem ser homogêneas ou heterogêneas, conforme está
ilustrado na Figura 5. A seguir trataremos de cada uma dessas classificações.
Figura 5 – Classificação da matéria
PETROBRAS ABASTECIMENTO 2008 24
QualificAbast
Substância pura
É a espécie química constituída por átomos ou moléculas quimicamente iguais.
As substâncias puras podem ser de dois tipos: simples ou compostas.
SUBSTÂNCIA SIMPLES SUBSTÂNCIA COMPOSTA
Toda substância formada por Toda substância formada por
apenas um elemento químico. dois ou mais elementos
Exemplos: Fe, O2 e O3 químicos.
Exemplos: H2O, CaCO3 e NaCl
As substâncias puras compostas, ao contrário das substâncias puras simples,
podem ser decompostas, através de processos químicos, em duas ou mais
substâncias diferentes. A Figura 6 mostra a eletrólise da substância pura água.
Neste processo a água é decomposta, sob a ação de uma corrente elétrica, em
duas substâncias puras simples, o hidrogênio (H2) e o oxigênio (O2).
Figura 6 – Eletrólise da água
Fonte: SARDELLA e MATEUS, 1991
Um fenômeno interessante e muito importante que ocorre com certos elementos
químicos é a alotropia, que significa a capacidade que alguns elementos possuem
de formar mais de uma substância pura simples. Por exemplo, por qual elemento
você supõe que a mina de grafite (essa mesma de que é feita o seu lápis) seja
formada? E o diamante?
PETROBRAS ABASTECIMENTO 2008 25
QualificAbast
Parece estranho, mas as duas substâncias citadas anteriormente são compostas
exatamente pelo mesmo elemento, o carbono. Tanto a grafite quanto o diamante
são formas alotrópicas do mesmo elemento. A explicação desse fenômeno está
na forma como os átomos de carbono estão dispostos na estrutura (arranjo
cristalino) que forma a substância. Na Figura 7 temos as estruturas cristali-
nas do carbono nas formas alotrópicas de diamante e grafite.
O oxigênio, o fósforo e o enxofre são exemplos de elementos que apresentam alotropia,
sendo que seus pares de formas alotrópicas são, respectivamente, o oxigênio atmosfé-
rico (O2) e o ozônio (O3), o fósforo branco e o vermelho, o enxofre rômbico e o monoclínico.
Figura 7 – Formas alotrópicas do carbono
Fonte: SARDELLA e MATEUS, 1991
Mistura
Uma mistura consiste em um conjunto de substâncias puras colocadas juntas. As
misturas podem ser sólidas, líquidas ou gasosas, e ser separadas por processos
físicos, de acordo com as propriedades das substâncias que as compõem. Elas
podem apresentar as mais variadas composições, dependendo da quantidade de
cada substância presente. As propriedades físicas da mistura (ponto de fusão,
ponto de ebulição, densidade, etc.) são função de sua composição. Um exemplo de
mistura de grande complexidade é o petróleo, que é formado por inúmeros
hidrocarbonetos, entre outros compostos. O leite, o granito, a água do mar, o ar e o
gás liquefeito de petróleo (ilustrado na Figura 8) são outros exemplos de misturas.
PETROBRAS ABASTECIMENTO 2008 26
QualificAbast
Figura 8 – Gás liquefeito de petróleo (GLP), uma mistura de C 3H 8 e C4H10
.
Fonte: SARDELLA e MATEUS, 1991
As misturas podem ser homogêneas ou heterogêneas, dependendo do número
de fases que possuem.
Fase é cada região ou aspecto da mistura, distinta das demais, na qual todas as
propriedades são as mesmas. As fases podem ser sólidas, líquidas ou gasosas.
Pode haver uma mistura com duas ou mais fases distintas no mesmo estado
físico (por exemplo, água e óleo), ou as fases podem estar em estados físicos
diferentes (mistura de água e areia, por exemplo). As misturas podem ser
classificadas de acordo com o número de fases que apresentam.
Monofásicas – apresentam uma única fase. Exemplos: solução de sal em água,
GLP, ar atmosférico, gasolina, bronze, etc.
Bifásicas – apresentam duas fases. Exemplos: óleo e água, areia e limalha de
ferro, água e éter.
Trifásicas – apresentam três fases. Exemplo: um sistema contendo ar, água e
areia. Temos a fase gasosa (o ar), a fase líquida (água) e a fase sólida (areia).
Polifásicas – apresentam quatro ou mais fases. Exemplo: um sistema contendo
nitrogênio, água, azeite e serragem. Temos uma fase gasosa (o nitrogênio), duas
fases líquidas (água e azeite) e uma fase sólida (serragem).
PETROBRAS ABASTECIMENTO 2008 27
QualificAbast
As misturas monofásicas são chamadas de misturas homogêneas. Uma mistu-
ra homogênea é também chamada de solução. Pode-se distinguir uma solução
de uma substância pura (as duas apresentam apenas uma fase) verificando a
estabilidade da temperatura durante a mudança de estado físico. Para uma
substância pura, a temperatura permanece constante durante a mudança de
estado; no caso de uma solução, a temperatura varia durante a mudança de
estado, em função da concentração da solução. Para exemplificar, vamos consi-
derar os seguintes sistemas – água pura e uma mistura de água e sal. A água
pura entra em ebulição sob temperatura constante, enquanto que na mistura de
água e sal observa-se uma faixa de temperatura onde ocorre a ebulição.
Todas as misturas em que possam ser distinguidas duas ou mais fases são
chamadas de mistura heterogênea. Uma situação interessante é a distinção
entre fases e componentes em um sistema. Um sistema composto pela mesma
substância pode possuir mais de uma fase. A Tabela 2 mostra esta diferença.
Tabela 2 – Componentes e fases de alguns sistemas
SISTEMA FASES
1 – á gua 1 – água (líquida)
2 – á gua e sal 1 – solução de água sa lga da (líquida)
2 – á gua e areia 2 – água (líquida) e are ia (sólida )
2 – óleo e á gua 2 – água e óleo (líquidas)
2 – óleo, água 3 – água (líquida), gelo (á gua sólida ) e óle o
(líquida)
3 – água (l íquida), gelo (sólida) e gá s carbônico
2 – á gua e gás carbônico
(gaso sa)
4 – óleo, água, sa l, granito 6 – óleo (líq.), sol. de á gua sa lga da (líq.), gelo,
quartzo, mica e feldspato (sólida s)
A compreensão do que é uma mistura e dos processos de separação que podemos
utilizar para isolar seus componentes é de fundamental importância para o
entendimento do que ocorre em uma refinaria de petróleo.
PETROBRAS ABASTECIMENTO 2008 28
QualificAbast
[Tabela periódica
A Tabela Periódica, representada na Figura 1, apresenta os 112 elementos
químicos conhecidos, dispostos em ordem crescente de número atômico e
representados por seus símbolos.
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
Figura 1 – Classificação Periódica dos elementos
As sete linhas horizontais são denominadas de períodos e as dezoito linhas verticais
são chamadas de grupos ou famílias. Dentro de cada período todos os elementos
possuem o mesmo número de camadas eletrônicas. Assim, os elementos do
primeiro período possuem uma camada eletrônica (camada K), os do segundo
PETROBRAS ABASTECIMENTO 2008 29
QualificAbast
período duas camadas eletrônicas (camadas K e L), os do terceiro período três
camadas eletrônicas (camadas K, L e M), e assim por diante.
Dentro de cada grupo ou família, os elementos possuem propriedades químicas
semelhantes. Isso se deve à semelhança de configuração eletrônica entre os
elementos pertencentes a um determinado grupo. A Figura 2 apresenta o
tipo de subnível mais energético que os elementos de cada grupo possuem.
Figura 2 – Subnível mais energético de cada grupo da tabela periódica
Os elementos também costumam ser classificados de acordo com o tipo de
subnível mais energético. Assim, o elemento cujo subnível mais energético é do
tipo s ou p é chamado de elemento representativo. Aquele que apresenta o
subnível mais energético do tipo d é chamado de elemento de transição ou
elemento de transição externa, enquanto que o que possui subnível mais
energético do tipo f é chamado de elemento de transição interna.
Alguns grupos da classificação periódica possuem nomes especiais. A Tabela 1
apresenta esses nomes e também a indicação mais antiga, mas ainda muito
usada, para designar tais grupos.
PETROBRAS ABASTECIMENTO 2008 30
QualificAbast
Tabela 1 – Nomes dos grupos dos elementos representativos
Nº do grupo Nº antigo do grupo Nome
1 1A Metal alcalino
2 2A Metal alcalino-terroso
13 3A Família do boro
14 4A Família do carbono
15 5A Família do Nitrogênio
16 6A Calcogênio
17 7A Halogênio
18 zero Gás Nobre
Os elementos também podem ser divididos de acordo com as suas características
metálicas em:
· Não-metais: B, C, N, O, F, Si, P, S, Cl, As, Se, Br, Te, I, At.
· Metais: todos os demais elementos.
Existe uma classificação mais antiga que considera também os elementos B, Si,
Ge, As, Sb, Te e Po como semimetais.
O Anexo B, no fim da apostila, traz a Classificação Periódica com os respectivos
valores de massa atômica dos elementos.
PETROBRAS ABASTECIMENTO 2008 31
QualificAbast
[Ligações químicas
Por que os compostos químicos são formados?
Quais os mecanismos que envolvem a formação de uma substância?
Essas são perguntas que sempre nos fazemos quando estamos estudando química.
Sabe-se que na natureza tudo tende a um estágio de menor acúmulo de energia.
Portanto, partindo dessa visão, e baseando-se em inúmeros experimentos,
concluímos que há uma tendência de os elementos reagirem, buscando um
estado energético mais favorável, mais estável.
Essa condição de estabilidade foi desenvolvida por Lewis, Kossel e Langmuir
mais ou menos na mesma época (1916), e está baseada na estabilidade
observada nos elementos conhecidos como elementos (ou gases) nobres, que
são os elementos que se encontram na última coluna da Tabela Periódica. Eles
postularam que os elétrons de valência dos elementos químicos (elétrons da
última camada) teriam a capacidade de ser doados ou compartilhados entre
átomos, adquirindo, desse modo, uma configuração eletrônica igual à de um gás
nobre, que possui oito elétrons na camada de valência (s2 p6), com exceção do
hélio, que possui apenas dois (s2). Os gases nobres são os únicos elementos que
são encontrados na natureza na forma de átomos isolados, e são praticamente
inertes, só reagindo quimicamente sob severas condições experimentais.
Essa teoria, chamada de teoria eletrônica de valência (lembrem-se do conceito
de teoria, que é uma aproximação da realidade), seria baseada então na Regra
do Octeto, na qual toda ligação química busca a estabilidade eletrônica de um
gás nobre, com oito elétrons na camada de valência. Dentro dessa percepção,
PETROBRAS ABASTECIMENTO 2008 32
QualificAbast
distinguem-se, então, dois tipos de ligação química - as ligações iônicas e as
ligações covalentes. É bom salientar que existem vários compostos estáveis que
não seguem a Regra do Octeto, isto é, cujos átomos que os formam não
apresentam oito elétrons na camada de valência. Teorias mais modernas a respeito
das ligações químicas foram então desenvolvidas, mas não serão aqui abordadas
porque envolvem modelos muito complexos para o objetivo de nosso curso.
Antes de conceituarmos a ligação iônica e a ligação covalente, vamos definir alguns
conceitos que são extremamente importantes para o entendimento do assunto.
Potencial de ionização: é a energia necessária para se retirar um elétron de um
átomo no estado gasoso e transformá-lo em um íon (no caso, um cátion). Este
valor é representativo da estabilidade da estrutura eletrônica do átomo. Quanto
maior o potencial eletrônico, mais difícil é de se retirar o elétron de valência e
mais dificilmente o átomo tende a formar um íon. Experimentalmente, verificou-
se que os metais têm maior tendência em perder estes elétrons da camada de
valência, pois possuem baixo potencial de ionização. Uma análise mais profunda
da configuração eletrônica nos mostra que os metais alcalinos perdendo um
elétron adquirem configuração de um gás nobre. Já os metais alcalino-terrosos
precisam perder dois elétrons e, de fato, o potencial de ionização para se retirar
o segundo elétron de um metal alcalino-terroso é muito menor do que para se
retirar o segundo elétron do metal alcalino.
Afinidade eletrônica: é energia liberada quando um átomo no estado gasoso
recebe um elétron em sua camada de valência. Esse valor também é representativo
da estabilidade do átomo, pois quanto menor a energia liberada, menor é a
capacidade deste átomo em receber o elétron. Os átomos que possuem maior
afinidade eletrônica são os não-metais (ficam à direita na tabela periódica), pois
ao receberem elétrons se aproximam da configuração eletrônica do gás nobre.
Eletronegatividade: representa a capacidade de um átomo atrair para si a
densidade eletrônica de uma ligação química. Considerando-se dois átomos que
estabelecem uma ligação química, pode-se afirmar que quanto menor for o valor
PETROBRAS ABASTECIMENTO 2008 33
QualificAbast
do potencial de ionização e da afinidade eletrônica de um desses átomos, e quanto
maior for o potencial de ionização e a afinidade eletrônica do outro átomo, maior
será a diferença de eletronegatividade entre os dois átomos que formam a ligação.
Desse modo, as ligações químicas podem ser classificadas em ligação iônica
(grande diferença de eletronegatividade entre os átomos envolvidos) ou ligação
covalente (baixa diferença de eletronegatividade entre os átomos envolvidos).
Existe ainda um outro tipo de ligação, chamada de ligação metálica, que será
abordada mais adiante.
(a) Ligação iônica
A ligação iônica ocorre quando a diferença de eletronegatividade entre os átomos
envolvidos é bastante grande. Como vimos antes, a relação entre os valores dos
potenciais de ionização e da afinidade eletrônica define a eletronegatividade. Vamos
tomar como exemplo o composto iônico NaCl. O cloreto de sódio é um composto
formado por uma ligação iônica entre os íons Na+ e Cl-. Mas como isto ocorre?
O átomo de sódio (Na) possui um baixo potencial de ionização (5,14eV – elétron
volt) e uma baixa afinidade eletrônica (0,3eV), ao passo que o átomo de cloro
tem alto potencial de ionização (10eV) e alta afinidade eletrônica (3,62eV). As
configurações eletrônicas desses átomos são a seguintes:
Na – 1s2 / 2s2 2p6 / 3s1 (possui 11 elétrons)
Cl – 1s / 2s 2p / 3s 3p
2 2 6 2 5
(possui 17 elétrons)
Vemos que para o metal Na adquirir uma configuração eletrônica estável (de gás
nobre) ele precisa perder 1 elétron, tornando-se um íon, o cátion Na+. Pelos
valores fornecidos sobre o potencial de ionização e afinidade eletrônica vemos
que é bastante fácil para o sódio perder, ou melhor, doar este elétron. Do mesmo
modo, o Cl para atingir a estabilidade precisa ganhar um elétron, tornando-se
um íon, o ânion Cl-. Vamos equacionar as energias envolvidas:
PETROBRAS ABASTECIMENTO 2008 34
QualificAbast
Na(g) → Na+1(g) + e-1 absorção de 5,14eV/mol
Cl(g) + e → Cl (g)
-1 -1
liberação de 3,60eV/mol
Na (g) + Cl (g) → Na Cl (g)
+1 -1 +1 -1
liberação de 4,66eV/mol
Simplificando: Na(g) + Cl(g) → Na+1Cl-1(g) liberação de 3,12eV/mol
Percebemos que, além das energias envolvidas nos processos de retirada e ganho
de elétrons do sódio e do cloro, respectivamente, existe também uma energia
que é desprendida quando os íons isolados formam o par iônico. O balanço de
energia nos mostra que o processo libera 3,12eV/mol, ou seja, o par iônico
Na+1Cl-1 possui menos energia acumulada e é energeticamente mais estável do
que os átomos originais (Na e Cl).
Os elementos que possuem a característica de perder elétrons são os metais e os
elementos que possuem a característica de receber elétrons são os não-metais;
sendo assim, a ligação iônica é sempre feita entre um metal e um não-metal.
Os átomos que se encontram no grupo 14 (C, Si, Ge, Sn e Pb) apresentam a
configuração eletrônica na camada de valência igual a ns2 np2, ou seja, possuem
quatro elétrons na última camada. Entre eles, o chumbo e o estanho apresentam
tendência a fazer ligação iônica, enquanto os demais costumam fazer ligações
covalentes, principalmente o carbono.
(a.1) Substância iônica
Quando o átomo de um metal doa elétrons para um não-metal, os dois tornam-
se íons e, por atração eletrostática, unem-se formando o que chamamos de
substância iônica ou composto iônico, ou, ainda, sólido iônico. Estes compostos
estão agrupados em aglomerados iônicos, formando os chamados retículos
cristalinos, conforme mostra a Figura 1.
PETROBRAS ABASTECIMENTO 2008 35
QualificAbast
Figura 1 – Formação do sólido iônico
Fonte: SARDELLA e MATEUS, 1991
Num sólido iônico, os cátions e ânions ocupam os pontos do espaço reticular,
sendo difícil a distorção deste retículo, em virtude da grande força da ligação
iônica. Desse modo, o sólido iônico geralmente racha em um plano definido
quando é submetido a um esforço capaz de proporcionar esta ruptura. Os sólidos
iônicos também apresentam elevado ponto de fusão em função da força da
ligação iônica. O NaCl, cuja estrutura cristalina está representada na Figura 2,
tem ponto de fusão de 808ºC.
Os sólidos iônicos são maus condutores de eletricidade. Esta afirmação pode
causar certa contradição inicialmente. Se os sólidos em questão são formados
por íons, como não conduzem eletricidade? Considerando-se que a condução
elétrica é o resultado da movimentação de partículas carregadas, podemos concluir
que, no estado sólido, os íons estão firmemente presos à estrutura cristalina, não
havendo mobilidade. Porém, se os sólidos iônicos forem fundidos ou solubilizados,
os íons passam a apresentar mobilidade, podendo então conduzir a eletricidade
com grande facilidade.
PETROBRAS ABASTECIMENTO 2008 36
QualificAbast
Figura 2 – Estrutura do NaCl
(a) Modelo espacial e (b) modelo de bolas com varetas.
Fonte: RUSSEL, 1994
(b) Ligação covalente
Os não-metais, como visto anteriormente, possuem tendência a formar ânions,
pois possuem potencial de ionização e eletroafinidade elevados. Então, como se
pode explicar o fato de dois átomos não-metálicos se unirem quimicamente?
Explica-se esse tipo de ligação através da teoria da ligação covalente, na qual
dois átomos de uma ligação compartilham um par eletrônico, formado por 1
elétron de cada átomo. Desse modo, os átomos envolvidos na ligação
compartilham tantos pares eletrônicos quantos forem necessários para que possam
adquirir a configuração eletrônica de um gás nobre. Após a formação da ligação,
a nuvem ou densidade eletrônica do par é distribuída entre os dois átomos.
Nesse tipo de ligação, o elétron não é retirado do átomo, mas é apenas deslocado
para formar o par com o elétron do outro átomo. Dessa maneira, os elementos
que precisam ganhar elétrons unem-se entre si compartilhando pares eletrônicos.
A ligação covalente ocorre entre dois não-metais, entre um não-metal e o
hidrogênio, e entre dois átomos de hidrogênio. Observe o exemplo a seguir:
PETROBRAS ABASTECIMENTO 2008 37
QualificAbast
H – 1s1 o hidrogênio precisa receber 1 elétron para adquirir a configuração
eletrônica do gás nobre hélio (1s2).
H• + H • → H •• H
Percebemos que cada átomo de hidrogênio empresta seu elétron para a formação
do par eletrônico, que é compartilhado entre os dois átomos. Dessa forma, cada
um dos átomos possui carga eletrônica mais próxima da carga eletrônica do
hélio, ficando com dois elétrons na última camada.
Um átomo pode compartilhar mais de um elétron para formar pares eletrônicos.
O carbono, por exemplo, pode compartilhar quatro pares eletrônicos, entrando
com um elétron em cada par. O oxigênio, por sua vez, pode compartilhar dois
elétrons para adquirir estabilidade eletrônica.
As moléculas podem ser representadas por três diferentes fórmulas: fórmula
eletrônica (ou fórmula de Lewis), fórmula estrutural e fórmula molecular.
A fórmula eletrônica ou fórmula de Lewis é feita representando-se os símbolos
dos elementos químicos dos átomos que estão se unindo com os elétrons da
última camada desenhados ao redor deles, e envolvendo-se os pares eletrôni-
cos que estão sendo compartilhados. O exemplo mostrado acima da ligação
entre átomos de hidrogênio está representado pela fórmula de Lewis.
A fórmula estrutural plana é representada pelo símbolo dos elementos envolvidos,
unidos por traços que representam os pares eletrônicos compartilhados.
A fórmula molecular mostra apenas os elementos envolvidos na formação
da molécula e suas quantidades. Existem algumas normas que orientam a
maneira de se escrever a fórmula molecular de um composto inorgânico.
1. Escreve-se o elemento menos eletronegativo, seguindo a ordem crescente
de eletronegatividade da esquerda para a direita, sendo que átomos do
mesmo elemento são representados juntos.
PETROBRAS ABASTECIMENTO 2008 38
QualificAbast
2. A quantidade de átomos de cada elemento é mostrada pelo subíndice ao
lado direito do elemento, sendo que o subíndice 1 não deve ser escrito.
Exemplos: H , HCl, CaCO , H SO , CO
2 3 2 4 2
No caso de compostos orgânicos, em geral, representa-se primeiro o átomo de
carbono, depois o de hidrogênio, e em seguida os outros átomos.
Existem casos em que um átomo, após ter compartilhado elétrons e ficado com
a configuração eletrônica de um gás nobre, ainda possui pares de elétrons não
compartilhados, chamado de pares de elétrons livres. Esses pares podem formar
outras ligações covalentes através do compartilhamento com átomos que
ainda não completaram sua camada de valência e necessitam de dois elé-
trons. Esse tipo de ligação covalente é chamado de ligação covalente dativa
ou ligação covalente coordenada. Observe o exemplo abaixo:
CH3
CH3 N: par de elétrons livres
CH3
Existem situações onde dois átomos podem compartilhar mais de um par de
elétrons, originando então as ligações duplas e triplas entre alguns elementos.
Por exemplo, o carbono tem em sua última camada a seguinte distribuição
eletrônica s2 p2, podendo então compartilhar 4 elétrons com outros elementos
em busca de sua estabilidade. Caso o carbono ligue-se à dois átomos de
hidrogênio, ainda sobram dois elétrons para outros compartilhamentos. Desta
forma, o carbono pode utilizar estes elétrons para formar dois pares eletrônicos
com outro carbono que se encontre na mesma situação, ou seja, ligado a
outros dois átomos de hidrogênio. Desta maneira, temos a formação de uma
ligação dupla entre os átomos de carbono. Observe os exemplos abaixo:
PETROBRAS ABASTECIMENTO 2008 39
QualificAbast
H H H H
C : : C ou C C
H H H H
Dessa mesma forma é que se unem os átomos de oxigênio e nitrogênio para
formar as substâncias simples O 2 e N2.
O O N N
(b.1) Polaridade das ligações covalentes
Como já vimos, a eletronegatividade nos dá a capacidade de um átomo em atrair
elétrons de uma ligação química. Caso a ligação seja feita entre dois átomos
iguais, com a mesma eletronegatividade, não há o deslocamento de densidade
eletrônica para nenhum dos dois átomos, não havendo a formação de um dipolo.
Nesse caso temos o que se chama de ligação covalente apolar. Exemplos de
ligações covalentes apolares são as ligações entre carbono e carbono em moléculas
orgânicas, entre os átomos de oxigênio nas ligações da molécula de O2, e muitas outras.
No caso de haver diferença de eletronegatividade entre os átomos envolvidos na
ligação, existe um deslocamento da carga eletrônica para cima de um dos átomos,
havendo a formação de um dipolo. Nesse caso, o átomo com maior
eletronegatividade atrai mais intensamente o par eletrônico. Temos então uma
ligação covalente polar. Como exemplo podemos citar a ligação entre o átomo
de hidrogênio e o átomo de cloro na molécula de HCl.
µ
H Cl
PETROBRAS ABASTECIMENTO 2008 40
QualificAbast
Neste caso, pela ilustração mostrada acima, a parte escura simboliza que a
densidade eletrônica está deslocada para o Cl, por este ser mais eletronegativo
que o hidrogênio. Em cima da representação da molécula, a seta indica este
deslocamento de carga e a letra grega ì (leia-se mi) é o vetor do momento de
dipolo ou momento dipolar, que indica o deslocamento da carga na direção do
elemento mais eletronegativo. Essa grandeza, o momento de dipolo, é uma
grandeza vetorial, e, como tal, possui módulo (intensidade), direção e sentido. A
unidade de medida do momento de dipolo é o debye (D).
A polaridade de uma molécula depende, portanto, do somatório dos momentos
de dipolo das ligações. Como essa grandeza é vetorial, a soma dos vetores depende
de sua direção e sentido, ou em outras palavras, a polaridade da molécula
depende de sua geometria. É importante não confundir polaridade da liga-
ção com polaridade da molécula. O estudo em torno da geometria molecular
é um pouco mais complexo, pois envolve conceitos de repulsão eletrônica de
pares de elétrons livres e hibridização dos orbitais, os quais não serão
abordados neste curso. Entretanto, vamos citar dois exemplos onde a molé-
cula possui ligações polares, mas, devido à sua geometria, a molécula como
um todo pode ou não possuir polaridade. Observe os exemplos abaixo:
Água:
Observe a molécula de água (H2O). O oxigênio é muito mais eletronegativo
que o hidrogênio; portanto, a densidade eletrônica é maior no átomo de
oxigênio. Temos nesse caso duas ligações covalentes polares. Como a geome-
tria da molécula de água é angular, isto é, as ligações não estão no mesmo
PETROBRAS ABASTECIMENTO 2008 41
QualificAbast
eixo, existindo um ângulo entre elas, a soma vetorial dos momentos de
dipolo das ligações fornece um vetor resultante com uma intensidade, dire-
ção e sentido definidos, fazendo com que a molécula de água seja polar.
Dióxido de carbono:
Já a molécula de dióxido de carbono (CO 2) possui quatro ligações polares
(devido à diferença de eletronegatividade entre o oxigênio e o carbono). No
entanto, dois a dois, os vetores momento de dipolo têm a mesma intensidade
e direção, mas estão em sentidos opostos, fazendo com que a soma vetorial
seja nula. Assim, a molécula de dióxido de carbono é apolar. Esses conceitos
de polaridade explicam vários fenômenos químicos, como a solubilidade e o
deslocamento da molécula em relação a um campo elétrico, por exemplo.
Este material não tem a intenção de esgotar o assunto sobre ligações químicas.
Os dois modelos estudados até agora mostram apenas conceitos básicos a respeito
das ligações químicas. Existem muitas situações que não podem ser explicadas
ou previstas por essa teoria. Outros modelos têm sido propostos, como a teoria
dos orbitais moleculares, que apresenta uma visão mais abrangente do assunto.
(b.2) Substâncias moleculares e covalentes
As substâncias que são formadas a partir da união de átomos por ligações
covalentes podem ser classificadas como substâncias moleculares e substâncias
covalentes.
PETROBRAS ABASTECIMENTO 2008 42
QualificAbast
As substâncias moleculares são constituídas por moléculas discretas, apre-
sentam ponto de fusão e ebulição baixo, não conduzem a corrente elétrica
em nenhum estado físico, e podem apresentar-se nos estados sólido, líquido
ou gasoso, à temperatura ambiente, dependendo da polaridade das molécu-
las, de seu tamanho e formato. São exemplos de substâncias moleculares:
H2O, Cl2, I2, C2H5OH, etc.
As substâncias covalentes são constituídas pela união covalente de um
número muito grande de átomos, normalmente indeterminado, formando
macromoléculas, e diferentemente das substâncias moleculares, possuem
ponto de fusão e ebulição muito altos, elevada dureza e péssima
condutibilidade. São exemplos de substâncias covalentes: o diamante (Cn),
a grafite (Cn), a sílica [(SiO2)n] e o carbeto de silício (SiC), utilizado como
abrasivo e como material cerâmico em peças de motor, refratários e
queimadores.
Os sólidos covalentes possuem átomos nos pontos reticulares, os quais estão
unidos por ligações covalentes. Num sólido molecular, quem ocupa as posições
definidas no retículo cristalino são moléculas. Essas moléculas permanecem
unidas, formando o sólido, através de forças intermoleculares.
As forças intermoleculares são muito mais fracas que a força da ligação química
que une os átomos que formam a molécula, e só são sentidas nos estados sólido
e líquido. No estado gasoso, as moléculas estão tão afastadas umas das outras,
que estas forças são desprezíveis. As forças intermoleculares são classificadas
como forças de Van der Waals (ou interações dipolo induzido-dipolo induzido),
forças de dipolo permanente (ou interações dipolo-dipolo) e ligação hidrogênio
(ou ponte de hidrogênio).
As forças de Van der Waals ocorrem em moléculas apolares, como Br2, CO2 e
CCl4, e são muito fracas. Elas se devem à formação momentânea de um
dipolo induzido na molécula. Pode acontecer, por exemplo, que num dado
instante o par de elétrons da molécula de bromo se aproxime mais de um
PETROBRAS ABASTECIMENTO 2008 43
QualificAbast
dos dois átomos de bromo, gerando um dipolo momentâneo que induzirá
nas moléculas próximas outros dipolos, no sentido de aproximar polarida-
des de carga oposta. Esses fenômenos duram muito pouco tempo, e a
tendência é de retornarem à condição inicial. Essas forças são responsáveis
por encontrarmos moléculas apolares nos estados líquido e sólido, pois
caso não existissem forças intermoleculares nessas espécies, todas seriam
gasosas.
As forças de dipolo permanente ocorrem em moléculas polares, como o HCl, HBr
e CHCl 3, e são mais fortes que as forças de Van der Waals. Como essas
moléculas apresentam um dipolo permanente, estão organizadas de modo
que as cargas parciais de sinais opostos estejam próximas e as de mesmo
sinal afastadas, gerando um arranjo relativamente ordenado, mesmo no
estado líquido.
A ligação hidrogênio ou ponte de hidrogênio consiste em um caso extremo
de atração dipolo-dipolo, que ocorre quando temos na molécula átomos de
hidrogênio (que possuem eletronegatividade baixa) e átomos de flúor, oxigê-
nio ou nitrogênio (que possuem eletronegatividade muito alta), gerando uma
atração muito forte devido à grande diferença de eletronegatividade entre
esses átomos. Essa força intermolecular é muito mais forte que as demais, e
as substâncias que a apresentam costumam ter ponto de fusão e ebulição
muito acima do esperado.
(c) Ligações metálicas
Os metais são sólidos cristalinos que possuem uma rede formada por átomos
idênticos. Na realidade, são os cátions dos metais que ocupam os pontos reticulares
na estrutura cristalina, pois devido à grande eletropositividade dos metais,
ocorre uma liberação parcial dos elétrons mais externos. Esses elétrons livres
(ou semilivres), isto é, que possuem mobilidade na estrutura metálica cristali-
na, mas não abandonam o cristal, envolvem a estrutura como uma nuvem
PETROBRAS ABASTECIMENTO 2008 44
QualificAbast
eletrônica, fazendo com que os metais sejam bons condutores de eletricidade,
mesmo no estado sólido. A Figura 3 apresenta um esquema ilustrativo da
ligação metálica.
Figura 3 – Nuvem eletrônica em estrutura metálica
Fonte: BUENO etal, 1978
A condução de eletricidade se dá através da nuvem eletrônica. Um modelo
baseado na teoria dos orbitais moleculares explica a condução de eletricida-
de tanto nos condutores quanto nos semicondutores e a não-condutância
nos isolantes. Não vamos entrar nesta teoria. A intenção aqui é simples-
mente mostrar como os metais estão ligados na sua estrutura e como esta
ligação feita através da nuvem eletrônica está diretamente relacionada com
a condução de eletricidade.
(d) Número de oxidação
Número de oxidação (N ox) é a carga real ou parcial que um átomo adquire quando
participa de uma ligação química. Quando a ligação é iônica, essa carga é real.
Quando a ligação é covalente, essa carga significa uma maior ou menor densidade
de carga, em função da diferença de eletronegatividade dos átomos que fazem a
ligação. O átomo mais eletronegativo recebe, então, a carga negativa, e o menos
eletronegativo fica com a carga positiva. Pode-se assim determinar o número de
oxidação de cada átomo em uma espécie química, analisando cada ligação.
PETROBRAS ABASTECIMENTO 2008 45
QualificAbast
Existe uma outra maneira, mais prática, de calcular o número de oxidação, sem
precisar analisar cada ligação existente em um composto. Nesse caso, calcula-
se o número de oxidação médio do átomo, utilizando as seguintes regras:
1. Substâncias simples – possuem Nox igual a 0 (zero);
2. Íons monoatômicos – possuem N ox igual ao valor de sua carga;
3. Substâncias compostas – a soma algébrica dos Nox de cada átomo deve
ser igual a 0 (zero);
4. Íons poliatômicos – a soma algébrica dos Nox de cada átomo deve ser igual
à carga do íon.
A Tabela 1 mostra o N ox de alguns elementos que possuem número de
oxidação fixo, quando formam substâncias compostas.
Para calcular o Nox de um átomo, deve-se utilizar as regras citadas anteriormente
e os valores dos números de oxidação dos elementos que possuem N ox fixo,
listados na Tabela 1. Vejamos alguns exemplos.
· Qual o Nox do C na molécula de CO2?
O CO2 é uma substância composta, logo a soma dos N ox dos átomos deve ser
igual a zero. Sabe-se pela Tabela 1 que o oxigênio tem Nox = -2, portanto:
Nox do C x + -2.(2) = 0
x = +4
Deve-se levar em consideração o número de átomos existentes na molécula
e multiplicar o Nox do elemento conhecido pelo número de átomos.
Qual o Nox do Cr no sal K2Cr2O7?
Nox do Cr 2 (+1) + 2x + -2.(7) = 0
x = +6
PETROBRAS ABASTECIMENTO 2008 46
QualificAbast
Tabela 1 – Nox de alguns elementos
Elementos Condições Nox Exemplos
Metais alcalinos Em qualquer substância +1 Na2SO4
(Li, Na, K, Rb, Cs, Fr) composta Nox Na = +1
Em qualquer substância +1 H2 O
Hidrogênio composta, exceto em hidretos Nox do H = +1
NaH
Hidrogênio Hidretos -1 Nox do H = -1
Metais alcalinos terrosos Em qualquer substância +2 Ca3(PO4)2
(Be, Mg, Ca, Sr, Ba, Ra) composta Nox do Ca = +2
Em qualquer substância +1 AgNO3
Prata
composta
Em qualquer substância +2 ZnSO4
Zinco
composta
Em qualquer substância +3 Al2(SO4)3
Alumínio composta
Nos peróxidos -1 Na2O2, H2O2
Nos superóxidos - 0,5 Na2O4
Oxigênio
Nos fluoretos +1 ou +2 O2F2, OF2
No restante das -2
substâncias (a maioria) KNO3, H2SO4
Enxofre Em qualquer monossulfeto -2 CaS
Halogênios Em qualquer halogeneto -1 NaCl
(F, Cl, Br, I)
PETROBRAS ABASTECIMENTO 2008 47
QualificAbast
[Gases
Pelo fato de um gás ocupar todo o volume do recipiente que o contém, expandindo-
se espontaneamente, as propriedades termodinâmicas que definem o estado de
um gás são pressão, temperatura e volume.
Vários físicos e químicos estudaram a dependência de um gás em relação às
variações das propriedades termodinâmicas. Estas observações foram enunciadas
em forma de leis.
(a) Lei de Boyle-Mariotte: relação pressão x volume
Robert Boyle e Edme Mariotte, no século XVII, estudaram, independentemente,
a relação entre a pressão exercida sobre um gás e o volume que este ocupa,
mantendo-se constante a temperatura e a quantidade de matéria (número de
mols). A relação matemática deduzida por eles foi:
k (3)
P.V = k ou V =
P
onde P é a pressão exercida sobre o gás, V é o volume que este ocupa e k é um
valor constante, resultado do produto entre P . V, para uma temperatura mantida
constante. Esta lei nos diz que o volume ocupado por um gás é inversamente
proporcional à pressão aplicada.
Pode-se calcular o volume ou a pressão final de um gás conhecendo-se o volume
e a pressão inicial medidas para este gás da seguinte maneira
P1.V1 = P2.V2 (4)
onde o subíndice 1 indica o estado inicial e o subíndice 2 o estado final.
PETROBRAS ABASTECIMENTO 2008 48
QualificAbast
(b) Lei de Charles: relação temperatura x volume
Jacques Charles e Joseph Gay-Lussac, dois físicos franceses, por volta de 1800,
pesquisaram a variação do volume de um gás em função da variação da
temperatura, mantendo-se constante a pressão exercida sobre o gás e a quantidade
de matéria. A expressão matemática para essa lei é dada por:
V = c.T (5)
onde V é o volume ocupado pelo gás, T é a temperatura termodinâmica ou
absoluta dada em Kelvin e c é a constante de proporcionalidade resultante
da razão entre V e T, sob pressão constante.
(c) Lei de Gay-Lussac das combinações dos volumes
Para uma reação em que os reagentes e produtos se encontram no estado gasoso,
Gay-Lussac definiu que, “sob as mesmas condições de temperatura e pres-
são, os volumes dos reagentes e produtos gasosos de uma reação estão em
razões de números pequenos e inteiros.”
Considere, por exemplo, a reação entre nitrogênio e hidrogênio para formar
NH3.
A relação entre os volumes medidos, sob a mesma temperatura e pressão, é:
PETROBRAS ABASTECIMENTO 2008 49
QualificAbast
Esta relação nos mostra que, sob pressão e temperatura constantes, a relação
entre o número de mols das substâncias é igual à relação volumétrica entre estas
substâncias. Esta constatação foi explicada por Amadeo Avogadro, em 1811, e
é enunciada sob o Princípio de Avogadro. Segundo Avogadro, volumes iguais de
gases diferentes contêm o mesmo número de moléculas quando medidos sob a
mesma temperatura e pressão. Dessa maneira, define-se que o volume é
proporcional ao número de moléculas, ou ao número de mols, representado pela
letra n:
V α n
(d) Equação de estado de um gás ideal
Considere as três proporcionalidades relativas às leis de Boyle e Charles e ao
Princípio de Avogadro representadas abaixo.
Lei de Boyle-Mariotte: V α 1
P
Lei de Charles: VαT
Princípio de Avogadro: V α n
A combinação dessas relações nos dá que V α 1 .n.T
P
Essa equação mostra a proporcionalidade entre o volume de um gás e as variáveis
pressão, temperatura e número de mols do referido gás. A constante de
proporcionalidade é dada pela constante do gás ideal, simbolizada pela letra R.
Desse modo, a equação que define o estado de um gás é:
V = R. 1 .n.T ou P.V = n.R.T (6)
P
Essa equação é conhecida como Lei dos Gases Ideais.
PETROBRAS ABASTECIMENTO 2008 50
QualificAbast
A constante R pode assumir vários valores, dependendo das unidades com
que se está trabalhando. Assim, temos que:
R = 0,082atm.L/mol.K = 8,314J/mol.K = 8,314kPa.L/mol.K =
1,987cal/mol.K = 10,73psia.ft3/lb.mol.
(d.1) Gases ideais x gases reais
O gás ideal é aquele que obedece rigorosamente às leis e fórmulas que acabamos
de deduzir, em quaisquer condições de pressão e temperatura e que também se
encaixa perfeitamente no modelo descrito pela teoria cinética dos gases. Essa
teoria baseia-se em um modelo, que em linhas gerais diz que:
· Todo gás é formado por partículas minúsculas (átomos, moléculas, íons) em
movimento livre, desordenado e com alta velocidade.
· As partículas de um gás estão muito afastadas umas das outras, o que torna a
atração entre elas desprezível.
· As partículas de um gás se chocam de forma perfeitamente elástica entre si e
contra as paredes do recipiente que o contém, isto é, sem perder energia.
· A energia cinética média das partículas de um gás é diretamente proporcional
à temperatura absoluta, isto é, a maior ou menor temperatura de um gás é a
medida da maior ou menor agitação de sua partículas.
Na prática, entretanto, um gás comum, isto é, um gás real, pode se afastar do
comportamento do gás ideal, principalmente a pressões muito altas e temperaturas
muito baixas, pois nesses casos as moléculas de um gás apresentam maior
interação intermolecular. Para tanto, outras equações foram definidas para se
corrigir esse desvio e tentar aproximar os resultados teóricos dos resultados obtidos
na prática. Não entraremos na discussão desta parte da matéria, pois na
disciplina de termodinâmica este assunto será abordado com mais profundi-
dade.
PETROBRAS ABASTECIMENTO 2008 51
QualificAbast
(e) Propriedades de um gás
Para que as propriedades dos gases possam ser calculadas, é necessário que
estados-padrão de temperatura e pressão sejam definidos. Existem estados-padrão
especificados arbitrariamente.
As condições de estado-padrão mais utilizadas são as seguintes:
CNTP – Condições Normais de Temperatura e Pressão.
Temperatura = 273,15K (0°C)
Pressão = 101 325Pa (1atm padrão)
CNTP atual – Condições Normais de Temperatura e Pressão atuais e que
devem ser utilizadas.
Temperatura = 273,15K (0°C)
Pressão = 100 000Pa (0,987atm)
SC – Standard Conditions. São usadas na indústria americana de petróleo
e gás natural e bastante difundidas em livros e artigos.
Temperatura = 60°F (15,556°C)
Pressão = 14,7psia (1atm padrão)
BR ou PETROBRAS – É uma condição de estado-padrão utilizada por
algumas indústrias brasileiras, principalmente a Petrobras.
Temperatura = 293,15K (20°C)
Pressão = 101 325Pa (1atm padrão)
PETROBRAS ABASTECIMENTO 2008 52
QualificAbast
(e.1) Volume molar
O volume molar de um gás é definido nas CNTP atual, como sendo o volume
ocupado por 1mol de um gás qualquer. Calcula-se o volume molar utilizando-se
a equação de estado do gás ideal:
Portanto, 1mol de qualquer gás nas condições normais de temperatura e pres-
são atuais ocupa o volume de 22,71L, que é o volume molar um gás ideal.
(e.2) Densidade
Toda matéria, independente do estado físico em que se encontra (sólido, líquido
ou gasoso), é dotada de uma propriedade chamada de densidade (ou massa
específica), simbolizada pela letra grega ρ (lê-se rô).
A densidade é definida como a relação entre a massa do material e o volume
ocupado por este material.
(7)
Para substâncias que se encontram em estado sólido ou líquido, podemos
considerar desprezível a variação de volume diante das variações de pressão ou
temperatura. Desse modo, a densidade da matéria nestes dois estados não se
altera de forma significativa diante da alteração destas variáveis. Os gases, por
serem compressíveis, têm sua densidade muito alterada sob variações de pressão
e temperatura. A densidade de um gás pode ser calculada pela equação de
estado de um gás ideal, conhecendo-se a massa molar do gás. Sabendo-se que:
PETROBRAS ABASTECIMENTO 2008 53
QualificAbast
onde n é o número de mols e M é a massa molar da substância, a equação de
estado pode ser reescrita da seguinte forma:
Dessa maneira, reorganizando-se a equação de estado dos gases ideais, temos que:
(8)
Podemos agora introduzir o conceito de densidade relativa de uma substância.
A densidade relativa é a relação entre a densidade de duas substâncias, sendo
uma delas tomada como padrão. Para gases, a substância-padrão é o ar, e a
densidade relativa é calculada dividindo-se a densidade do gás pela densidade
do ar, nas mesmas condições de temperatura e pressão. A equação abaixo mostra
o cálculo a ser efetuado para a obtenção da densidade relativa de um gás.
(9)
A densidade relativa irá nos indicar se o gás em questão é mais “leve” ou mais
“pesado” do que o ar. Entenda-se por gás “mais leve do que o ar ” aquele que
possui menor densidade em relação ao ar, ou seja, que tem menos massa para
o mesmo volume em questão; e entenda-se por gás “mais pesado que o ar ”
aquele que possui maior densidade que o ar.
Exemplo: Qual a densidade do etano (C2H6) no SI, sob uma temperatura de
40°C e pressão de 200kPa?
PETROBRAS ABASTECIMENTO 2008 54
QualificAbast
Com base na fórmula molecular do etano, calculamos a sua massa molar (M):
C – 12,011g/mol H – 1,0079g/mol M do etano = 30,07g/mol
ρ = P.M / R.T = 200[kPa].30,07[g . mol ] / 8,314[kPa.L.mol-1.K-1] = 2,31g.L-1
-1
ρ = 2,31kg/m3
Outro exemplo prático seria o cálculo da densidade relativa de um gás. Vamos
supor que etano tenha escapado de uma tubulação e tenha sido liberado para o
ambiente. É importante saber se este gás irá permanecer junto ao solo, forman-
do um bolsão de gás, ou se irá subir, dissipando-se pela atmosfera. Para tanto, o
valor da densidade relativa deve ser conhecido, pois ela nos indicará se o gás é
mais ou menos denso que o ar naquelas condições. Supondo que o gás etano
esteja sob as mesmas condições de pressão e temperatura que o ar atmosférico,
a seguinte simplificação pode ser feita:
Os volumes molares do etano e do ar, sob as mesmas condições, são iguais,
permitindo a simplificação. Basta então conhecermos as massas molares dos
dois gases e dividi-las. Considerando o ar como uma mistura de mols, sendo
21% de O2 e 70% de N2, temos que,
Desse modo, como a densidade do etano é muito próxima à do ar, ele não se
acumula junto ao solo, mas também não se dissipa rapidamente pela atmosfera.
PETROBRAS ABASTECIMENTO 2008 55
QualificAbast
(e.3) Lei de Dalton das pressões parciais para mistura de gases
Os gases misturam-se perfeitamente entre si, em qualquer proporção, sendo
total a miscibilidade. Em uma mistura de gases ideais, as partículas dos gases
não interagem entre si, sendo que a pressão exercida por cada gás, chamada de
pressão parcial, é independente da presença do outro gás.
Assim, para uma mistura de dois gases A e B, podemos escrever que
PT = P A + P B (10)
onde PT é a pressão total exercida pela soma das pressões parciais P A e PB.
(e.4) Difusão de um gás
Difusão é a mobilidade ou deslocamento que uma substância tem através de
outra. A difusão ocorre muito mais facilmente em gases do que em líquidos ou
sólidos (apesar de também ocorrer nestes outros estados). Quando sentimos o
cheiro de uma substância, é porque partículas gasosas desta substância
difundiram-se através do ar até o nosso nariz. Na engenharia, este fenômeno é
tratado de forma muito mais completa nos fenômenos de transporte de massa.
Agora, trataremos da difusão apenas qualitativamente.
A velocidade de difusão de um gás é inversamente proporcional à raiz quadrada
da densidade do gás. Ou seja, quanto maior a densidade do gás, menor é a
velocidade de difusão deste gás em um meio gasoso.
PETROBRAS ABASTECIMENTO 2008 56
QualificAbast
Como para uma dada temperatura e pressão a densidade de um gás ideal é
diretamente proporcional às massas molares, essa equação também pode
ser escrita como:
(f) Mistura de gases
A pressão que uma mistura de gases exerce em um recipiente corresponde à
soma das pressões que cada gás exerceria se estivesse sozinho no recipiente.
Por sua vez, a pressão exercida por cada gás é proporcional à sua fração molar
(ou volumétrica) no recipiente, de modo que podemos escrever:
PA = PT.yA (13)
onde PA é a pressão parcial do gás A, P T é a pressão total e y A é a fração molar do
gás A na mistura.
Veja o exemplo:
Uma mistura de mols com 23,2% de H2, 35,4% de N2 e 41,4% de
CO2 à pressão de 200kPa e temperatura de 150°C ocupa o volume
de 10m3. Considerando-se o comportamento ideal da mistura, cal-
cule a pressão exercida por cada gás.
PETROBRAS ABASTECIMENTO 2008 57
QualificAbast
Para uma mistura ideal, basta multiplicar a pressão total pela fração molar para
se obter as pressões parciais:
Pressão parcial de H2 = 200(kPa) . 0,232 = 46,4kPa
Pressão parcial de N 2 = 200(kPa). 0,354 = 70,8kPa
Pressão parcial de CO2 = 200(kPa) . 0,014 = 82,2kPa.
PETROBRAS ABASTECIMENTO 2008 58
QualificAbast
[Líquidos
De certo modo, o líquido é universalmente aceito como o estado intermediário
entre os estados sólido e gasoso. A maneira mais simples de um sólido passar
para a forma gasosa, é passando pela forma líquida. A maioria das propriedades
dos líquidos é intermediária entre as propriedades do estado sólido e do estado
gasoso. A conformação estrutural dos líquidos está organizada de modo que as
moléculas do líquido encontram-se bastante próximas umas das outras, quase
tanto quanto nos sólidos, porém se encontram em movimento desordenado quase
igual ao dos gases.
A seguir, trataremos sucintamente da relação de equilíbrio entre as fases líquida
e vapor. Na disciplina de Calorimetria e Transferência de Calor as relações de
equilíbrio entre todas as fases serão abordadas com mais profundidade.
(a) Equilíbrio líquido-vapor
Um líquido, quando colocado em um ambiente aberto, está constantemente se
evaporando. Podemos notar isso nos fatos da vida cotidiana. A roupa recém-
lavada seca ao ar livre, ou seja, a água evapora. Uma poça d’água formada
depois de um dia de chuva some após algum tempo. Como podemos explicar
esta passagem do estado líquido para o vapor?
Quando um líquido está em um recipiente fechado, as moléculas que saem da
superfície do líquido para o vapor estão limitadas pelo recipiente, não podendo
difundir-se infinitamente, acumulando-se sobre o líquido. Nesse caso a evaporação
é incompleta ou limitada. Se o líquido é posto em um ambiente aberto, as
moléculas não encontram resistência e difundem-se através do ar.
PETROBRAS ABASTECIMENTO 2008 59
QualificAbast
No primeiro caso, em que o líquido é contido por um recipiente, as moléculas
que vão evaporando produzem uma pressão sobre as paredes do recipiente e a
mesma pressão sobre a superfície do líquido. A evaporação ocorre até que o
sistema composto por líquido e vapor do mesmo líquido atinja o equilíbrio, ou
seja, para uma quantidade de moléculas que evaporam, a mesma quantidade
de moléculas se condensam.
Essa pressão onde o equilíbrio é atingido é chamada de pressão de vapor do
líquido, ou apenas pressão de vapor. A pressão de vapor de uma substância
depende das forças intermoleculares que agem entre as moléculas da substância.
Quanto maior for essa força, menor é a tendência das moléculas escaparem do
estado líquido para o estado gasoso. Quanto maior a pressão de vapor de um
líquido, sob determinada temperatura, mais volátil ele é. Mas por que sob
determinada temperatura? Porque a temperatura provoca um enfraquecimento
das forças intermoleculares, pois aumenta a energia cinética das moléculas,
fazendo com que elas vibrem mais. Então, o fato de aumentar a temperatura faz
com que mais moléculas passem para o estado gasoso, aumentando-se a pressão
de equilíbrio entre líquido e vapor, ou seja, a pressão de vapor aumenta com o
aumento de temperatura. O gráfico da Figura 1 mostra a dependência da pres-
são de vapor em relação à temperatura para algumas substâncias.
Figura 1 – Gráfico de pressão de vapor para o éter dietílico, etanol e água
Fonte: RUSSEL, 1994.
PETROBRAS ABASTECIMENTO 2008 60
QualificAbast
Vemos claramente que as curvas possuem forma exponencial e que existe uma
grande diferença nas pressões de vapor das três substâncias, para uma mesma
temperatura. Vemos que o éter dietílico é a substância mais volátil dentre as
três, enquanto que a água é a menos volátil. O éter atinge uma determinada
pressão de vapor em temperatura inferior à temperatura necessária para que a
água alcance essa mesma pressão de vapor. Isso quer dizer que, na mesma
temperatura, o éter dietílico evapora mais facilmente que a água.
O gráfico da Figura 1 também nos mostra a temperatura em que cada uma das
substâncias teria ao atingir a pressão de vapor de 1atm (ou 760mmHg). Um
líquido entra em ebulição (isto é, ferve completamente, desprendendo bolhas)
apenas quando a sua pressão de vapor atinge o valor da pressão ambiente, que
ao nível do mar é de 1,00atm. Quando a pressão de vapor de uma substância
atinge então esse valor, ela entra em ebulição. O ponto de ebulição normal é
definido como a temperatura a que uma substância deve ser levada para que
sua pressão de vapor se iguale à pressão atmosférica normal. Pelo gráfico da
Figura 1, concluímos que o ponto de ebulição do éter dietílico é 34,6°C, o do
etanol é 78,4°C e o da água é 100°C.
Um exemplo do nosso cotidiano que exemplifica bem a variação da pressão de
vapor com a temperatura e com a ebulição ocorre quando aquecemos água em
uma panela de pressão. Dentro do sistema fechado que é a panela, à medida
que a água vai se aquecendo, ela evapora e a pressão dentro da panela sobe,
pois, diferentemente de um sistema aberto, as moléculas em fase de vapor não
têm como sair do sistema. Desse modo, a pressão sobre a fase líquida aumenta,
e uma temperatura mais elevada é necessária para que a água entre em ebulição.
Assim, a água deve atingir temperaturas maiores do que 100°C para entrar em
ebulição.
No entanto, aumentando-se a pressão sobre o líquido, aumenta-se a temperatura
de ebulição deste; se diminuirmos a pressão, ocorre o inverso, isto é, a temperatura
de ebulição deve ser menor, pois as moléculas que estão na superfície do líquido
encontram mais facilidade de escapar para a fase gasosa. Dois fatos evidenciam
PETROBRAS ABASTECIMENTO 2008 61
QualificAbast
este fenômeno: (1) a temperatura de ebulição da água em locais mais altos que
o nível do mar é mais baixa, pois em locais mais altos a pressão atmosférica é
menor; (2) durante o refino de petróleo, após a destilação atmosférica, a corrente
mais pesada é fracionada novamente, sob vácuo (pressão menor que a
atmosférica). A redução de pressão faz com que os componentes daquela corrente
possam entrar em ebulição e ser separados sob temperaturas menores do que
aquelas nas quais seriam normalmente submetidos.
O calor que deve ser fornecido a um mol de uma substância para que ela vaporize,
à pressão de 1atm, é chamado de calor de vaporização. Quanto maior o calor de
vaporização de uma substância, mais forte é a interação entre suas moléculas e
menos volátil ela é.
(b) Equilíbrio líquido-sólido
Ao contrário da vaporização de um líquido, em que deve ser fornecido calor para
que este líquido passe à fase de vapor, para se solidificar um líquido, deve-se
retirar calor do sistema até que a temperatura atinja a temperatura de solidificação.
A ação contrária, ou seja, a fusão do sólido, também ocorre na mesma
temperatura, porém nesse caso a substância deverá ser aquecida. A temperatura
de fusão ou de solidificação é a temperatura na qual os estados sólido e líquido
encontram-se em equilíbrio.
Diferentemente do equilíbrio líquido-vapor, o equilíbrio entre líquido-sólido não é
muito influenciado pela variação de pressão, porém esta influência existe. O
calor necessário para fundir um mol de uma substância sólida é chamado de
calor de fusão molar. O calor de fusão nos indica a intensidade da força com que
o sólido mantém unidas suas partículas (átomos, íons ou moléculas) no retículo
cristalino. Como já foi estudado anteriormente, compostos iônicos possuem
elevadas temperaturas de fusão e conseqüentemente elevado calor de fusão,
pois as forças iônicas que mantêm unida a estrutura cristalina são maiores que
as forças intermoleculares que mantêm unida a estrutura sólida dos compostos
PETROBRAS ABASTECIMENTO 2008 62
QualificAbast
moleculares. Exemplo: o NaCl, um sólido altamente iônico, tem uma temperatura
de fusão em torno de 808°C e o calor de fusão de 28,2kJ/mol; já o metano
(CH4), composto molecular, tem uma temperatura de fusão de -182°C e o calor
de fusão de 0,941kJ/mol.
(c) Densidade relativa dos líquidos
As definições de densidade e densidade relativa já foram mencionadas
anteriormente. Porém, diferentemente dos gases, os líquidos não possuem uma
equação de estado que relacione as propriedades termodinâmicas. Vamos, então,
rapidamente mostrar como se calcula a densidade de uma substância líquida. A
densidade dos líquidos, longe das condições críticas, é função apenas da
temperatura, pois o líquido é praticamente incompressível.
Para o cálculo da densidade relativa, a substância-padrão é a água, cuja densidade
é máxima a 4°C e tem o valor de 1 000kg/m3. Deve-se, então, especificar a
temperatura do líquido e do padrão (água). Desse modo, temos que
Nos EUA, a temperatura-padrão adotada para os líquidos é de 60°F, tanto para
um líquido qualquer quanto para a referência, e a densidade é dada em d 60/60°F.
PETROBRAS ABASTECIMENTO 2008 63
QualificAbast
[Soluções
As misturas homogêneas são também denominadas de soluções, e o processo de
misturar duas substâncias para formar uma solução é chamado de dissolução.
Em uma solução, o componente que está em maior quantidade é chamado de
solvente e o(s) que está(ão) em menor quantidade é(são) chamado(s) de soluto(s).
Suas propriedades físicas não são independentes para cada componente como
em uma mistura heterogênea, ou seja, elas dependem do tipo de solução e da
concentração da solução. A presença de uma substância interfere em propriedades
físicas da outra.
As soluções podem ser classificadas de acordo com seu estado físico em sólidas,
líquidas e gasosas. A Tabela 1 mostra exemplos de soluções e seus estados
físicos:
Tabela 1 – Exemplos de soluções
Solvente Soluto Solução Exemplo
gás gás gasosa ar
líquido gás líquida água-oxigênio
líquido líquido líquida água-metanol
líquido sólido líquida água-sal
sólido líquido sólida zinco-mercúrio
sólido gás sólida paládio-hidrogênio
sólido sólido sólida liga de zinco-cobre
PETROBRAS ABASTECIMENTO 2008 64
QualificAbast
As soluções também podem ser classificadas em eletrolíticas e não-eletrolíticas
(ou moleculares), em função da condução ou não de eletricidade.
Concentraremos nosso estudo nas soluções líquidas e gasosas, que são as mais
comuns.
(a) Concentração das soluções
Uma solução é composta pelo soluto e pelo solvente, em função da quantidade
com que os componentes estão presentes. O que está presente em menor
quantidade é o soluto. A solução, em relação ao soluto, pode ser diluída ou
concentrada. Essa classificação é relativa e tem sido usada para dar uma indicação
da concentração, isto é, uma solução é dita mais diluída que outra quando o
soluto está presente em menor quantidade nela do que na outra. Do mesmo
modo uma solução é considerada mais concentrada quando a sua massa de
soluto for maior do que a massa de soluto da outra solução.
Para determinar quantitativamente quanto de soluto está disperso no solvente,
ou seja, para calcular a concentração ou composição de uma solução, são
utilizadas as unidades de concentração. Essas unidades podem ser expressas de
várias formas. A seguir, descreveremos algumas unidades de concentração.
(a.1) Concentração comum
É a unidade de concentração mais simples. É expressa pela letra C, e calculada
da seguinte maneira:
onde m é a massa de soluto e V é o volume da solução. A unidade é dada em
gramas por litro (g/L).
PETROBRAS ABASTECIMENTO 2008 65
QualificAbast
(a.2) Concentração molar
É a unidade de concentração mais utilizada para soluções aquosas. Antigamente
era chamada de molaridade, mas hoje se prefere o termo concentração molar. É
definida como o número de mols de soluto dissolvido em um litro de solução.
Assim, podemos escrever
onde nA é o número de mols do soluto A. O volume é dado em litros (L), por isso
a concentração molar é dada em mol/L. Deste modo, se uma solução contém
0,5mol de NaCl dissolvido em um litro de solução, diz-se que a solução tem
concentração de 0,5mol/L.
(a.3) Molalidade
É definida como o número de mols de soluto dissolvido em 1kg de solvente (note
a distinção entre solvente e solução), e simbolizada pela letra m. Então, a
molalidade de uma solução em relação a um soluto A é:
Uma solução que contenha 2,3mols de soluto por quilograma de solvente é dita
uma solução 2,3molal ou 2,3m.
A vantagem de expressar a concentração de uma solução dessa forma é que a
molalidade não depende da temperatura como a molaridade. Uma variação de
temperatura da solução provoca expansão ou contração térmica, alterando o
volume da solução e conseqüentemente alterando a concentração expressa em
função do volume da solução.
PETROBRAS ABASTECIMENTO 2008 66
QualificAbast
(a.4) Fração e percentagem molar
A fração molar, simbolizada pela letra x, é definida como sendo a razão entre o
número de mols do componente A e o número total de mols presentes. É utilizada
quando existem vários solutos, ou quando não há distinção entre soluto e solvente,
isto é, quando a quantidade dos componentes presentes na solução é semelhante.
Suponha que uma solução tenha i componentes. A fração molar do componente
A é dada por:
Logicamente, as frações molares não possuem unidades e sua soma é sempre
igual a 1. Veja:
Essa forma de expressar a concentração também é muito utilizada, principalmente
em balanços materiais na indústria química e petroquímica.
A percentagem molar nada mais é do que a fração molar multiplicada por 100%.
Se a fração molar é a fração correspondente a um dos componentes dentro de
toda a solução, essa fração multiplicada por 100% nos dá a percentagem do
componente.
Por exemplo, se a fração molar de propano em uma solução de etano, propano,
n-butano, isobutano for de 0,48, isto quer dizer que 48% dos mols existentes
naquela solução são de propano. Se a solução possuir 100mols, 48 são de
propano. É bom lembrar que a fração molar é diferente da fração mássica.
Então, na solução em questão, a fração em massa do propano será outra, diferente
de 0,48.
PETROBRAS ABASTECIMENTO 2008 67
QualificAbast
(a.5) Fração mássica
Semelhantemente ao conceito de fração molar, a fração mássica de um
componente representa a razão entre a massa desse componente e massa total
da solução. Existe ainda a fração volumétrica, mas esta é a menos utilizada. As
frações mássica e volumétrica, quando multiplicadas por 100%, nos dão a
percentagem mássica e volumétrica, respectivamente.
(a.6) Parte por milhão – ppm
É uma forma de expressar a concentração de soluções muito diluídas, onde se
relaciona quantas partes do soluto estão contidas em um milhão de partes da
solução. É calculada assim:
É entendida como a massa em miligramas de soluto contida em um quilograma de
solução. Se a densidade da solução for 1,00kg/L, então 1mg/L é igual a 1ppm.
Logo:
1 ppm = 0,0001% = 10-4%
se ρ = 1,00 kg/L, temos que
1 ppm = 1 mg/kg = 1 0mg/L
(b) Densidade de misturas
As misturas de líquidos são consideradas ideais quando não há contração nem
expansão do volume final da mistura. Por exemplo, uma mistura de 1L de água
e 1L de etanol não terá exatamente 2L. Terá menos de dois litros, pois as interações
intermoleculares entre esses dois elementos contribuirá para a redução do volume
PETROBRAS ABASTECIMENTO 2008 68
QualificAbast
final. Porém, em algumas situações pode-se considerar que a mistura é ideal,
como no caso de uma mistura de hidrocarbonetos. Nesse caso, pode-se determinar
a densidade da mistura, pois ela é aditiva em base volumétrica.
A massa específica ou densidade da mistura é dada pela massa da mistura
dividida pelo volume da mistura ou, então, pelo somatório do produto entre a
densidade de cada componente e sua fração volumétrica.
(c) Solubilidade
A solubilidade de uma substância é definida como sendo a concentração de satu-
ração sob determinada temperatura, dada geralmente em gramas de substância
por cada 100g de água. A solubilidade é fortemente dependente da temperatura,
e para a maioria das substâncias é diretamente proporcional à variação da tempe-
ratura. Poucas exceções existem para esta regra, tal como o sal Li SO , que é mais
2 4
solúvel a frio do que a quente. O gráfico da Figura 1 apresenta a variação da
solubilidade com a temperatura para algumas substâncias.
Figura 1 – Variação da solubilidade com a temperatura
Fonte: RUSSEL, 1994.
PETROBRAS ABASTECIMENTO 2008 69
QualificAbast
A maioria das reações de solubilização é endotérmica, isto é, no caso de aumento
da temperatura favorece-se a solubilização. No caso do sal de lítio, a reação é
exotérmica, e o aumento de temperatura desloca o equilíbrio para o lado do sal
não-dissociado, e não para a solubilização.
A solubilidade de um soluto está diretamente ligada às forças intermoleculares
que existem entre soluto-soluto, solvente-solvente e soluto-solvente. Quando ocorre
a dissolução, as forças que existem entre as partículas de soluto e as forças que
existem entre as partículas de solvente são substituídas pelas forças entre soluto
e solvente. Uma maneira de se prever se um soluto é solúvel em um solvente é
baseada na observação de que semelhante dissolve semelhante, sendo essa
semelhança dada em relação à polaridade do soluto e do solvente.
Polar dissolve polar
Apolar dissolve apolar
Um fator que ajuda a explicar algumas exceções a esta regra de solubilidade é a
ligação hidrogênio, ou ponte de hidrogênio. A ligação hidrogênio é uma interação
mais fraca que a ligação química iônica ou covalente, porém mais forte que outras
interações intermoleculares. Um exemplo de que pontes de hidrogênio promovem
a solubilidade contrariando a regra das polaridades é o caso da solubilização do
álcool etílico (C2H5OH) em água e a solubilização do cloreto de etila (C2H5Cl) em
água. O álcool, apesar de possuir um momento dipolar menor que o cloreto de
etila (1,70D e 2,05D, respectivamente) e sendo, portanto, menos polar, é total-
mente miscível em água, enquanto a solubilidade do cloreto é bem mais baixa.
Como explicar isso se temos como base que polar solubiliza polar?
A explicação está na ponte de hidrogênio formada entre o elemento oxigênio de
umas das moléculas com o hidrogênio ligado ao oxigênio da outra espécie,
enquanto que nenhum elemento faz ponte de hidrogênio no cloreto de etila.
De acordo com a solubilidade dos solutos, uma solução pode ser classificada em:
PETROBRAS ABASTECIMENTO 2008 70
QualificAbast
· Solução saturada – é a solução que está em equilíbrio com o excesso de
soluto precipitado. É a maior concentração de soluto que pode estar solúvel, sob
determinada temperatura e pressão. Se o precipitado fosse retirado por filtração,
a solução ainda teria a concentração de saturação.
· Solução insaturada – quando a concentração de soluto está abaixo da
concentração de saturação. A adição de mais soluto não causa a precipitação ou
dissolução do soluto.
· Solução supersaturada – quando a concentração do soluto é maior do que
a concentração de saturação. Uma solução supersaturada é instável e o soluto
tende a precipitar. Se mais soluto é adicionado, ele se precipita imediatamente.
Alguns solutos são solúveis em qualquer proporção com o solvente, sendo infinita-
mente solúveis. Em outros, a solubilidade é tão baixa, que são ditos insolúveis.
A solubilidade de sais é de extrema importância em refinarias, porque sais pouco
solúveis são responsáveis por incrustações em equipamentos e tubulações,
causando transtornos na operação. Outra grande aplicação da solubilidade é a
extração por solvente, uma operação unitária muito utilizada industrialmente,
em que um solvente extrai um soluto de uma solução. Para isso, o soluto deve
possuir mais afinidade com o solvente da extração do que com o solvente original
da solução.
(d) Propriedades coligativas
Algumas propriedades físicas das soluções são alteradas em função da
concentração do soluto, não importando o tipo ou natureza da solução. As
propriedades alteradas são chamadas de propriedades coligativas de uma solução,
e são as seguintes:
PETROBRAS ABASTECIMENTO 2008 71
QualificAbast
· Pressão de vapor
· Ponto de ebulição
· Ponto de fusão
· Pressão osmótica
(d.1) Redução da pressão de vapor
Considere um recipiente que contenha solvente puro. A pressão exercida
internamente nesse recipiente é igual à pressão de vapor desse solvente sob
determinada temperatura. Agora, considere uma solução diluída em que o soluto
é não-volátil (não tem tendência a escapar da solução). A pressão exercida no
recipiente é menor, pois o soluto não-volátil diminui a pressão de vapor desse
solvente. Isso se explica pelo fato de que o soluto, por não ter tendência a escapar
para a fase gasosa, faz com que o número de moléculas de solvente que estão na
fase gasosa, sobre a solução, seja menor do que a quantidade de moléculas de
solvente que estavam na fase gasosa quando havia apenas solvente puro, pois
na solução o solvente não ocupa sozinho a superfície da solução. Observe a
Figura 2 a seguir:
Figura 2 – Redução da pressão de vapor
PETROBRAS ABASTECIMENTO 2008 72
QualificAbast
Vemos que existem menos moléculas do solvente na fase gasosa em função da
concentração do soluto. Se existem menos moléculas exercendo força contra a
parede, a pressão é menor. Portanto, a presença de um soluto não-volátil reduz
a pressão de vapor do solvente. É muito importante que se leve em consideração
neste momento a não-volatilidade do soluto. Adiante, trataremos da mistura de
duas substâncias voláteis.
A equação que relaciona o abaixamento da pressão de vapor e a concentração
da solução ideal é dada pela Lei de Raoult (físico e químico francês do século
XIX). Uma solução é considerada ideal quando não há interação intermolecular
entre as moléculas do solvente com as do soluto. Essa é uma situação que só
pode ser obtida em soluções diluídas ou em certas espécies químicas, tais como
os hidrocarbonetos leves. Em concentrações mais elevadas, a equação sofre um
desvio da idealidade, devendo ser corrigida por um fator de correção característico
de cada mistura. A Lei de Raoult para soluções ideais é dada por:
onde P1 é a pressão de vapor parcial do solvente na solução, x é a fração molar
1
do solvente na solução e P1 0 é a pressão de vapor do solvente puro. Para o
soluto, temos uma equação semelhante, onde
sendo P2 a pressão de vapor parcial do soluto na solução, x a fração molar do
soluto na solução e P2 0 a pressão de vapor do soluto puro. Porém,
2 como o soluto
é não-volátil, P 0 é aproximadamente zero, o que torna o termo P também nulo.
2 2
Pela Lei de Dalton, a pressão exercida por dois gases depende da pressão parcial
exercida por cada um deles independentemente, então
(21)
PETROBRAS ABASTECIMENTO 2008 73
QualificAbast
onde PT é a pressão total do sistema, P é a pressão parcial exercida pelo solvente
1
e P2 é a pressão parcial exercida pelo soluto.
Portanto, a pressão da solução quando o soluto é não-volátil é a igual à pressão
de vapor do solvente P , pois P é nula. No caso de termos uma mistura de duas
1 2
substâncias voláteis, a pressão de vapor da solução é a soma das pressões
parciais. Nesse caso, o composto que tem maior pressão de vapor no estado
puro tem sua pressão de vapor rebaixada e o composto que tem menor pressão
de vapor no estado puro tem sua pressão de vapor elevada. Essas conclusões
podem ser retiradas dos gráficos da Figura 3.
Figura 3 – Pressão de vapor – (a) parcial para a substância 1; (b) parcial
para a substância 2; e (c) total da solução
Fonte: RUSSEL, 1994.
PETROBRAS ABASTECIMENTO 2008 74
QualificAbast
(d.2) Elevação do ponto de ebulição – ebuliometria
Como foi definido anteriormente, o ponto de ebulição de uma substância é atingido
quando a pressão de vapor desta solução atinge o valor da pressão do ambiente
que a cerca. Portanto, se a pressão de vapor de uma substância diminui quando
a ela é adicionada uma quantidade de soluto não-volátil, é razoável pensar que
será necessário uma temperatura maior para que a solução atinja o valor da
pressão ambiente. Desse modo, a temperatura de ebulição sofre um aumento.
Porém, caso as duas substâncias sejam voláteis, a pressão de vapor da mistura
é maior que a pressão de vapor de um dos compostos puros. Isso faz com que a
solução entre em ebulição antes do ponto de ebulição deste composto. Esse
fenômeno ocorre de maneira muito explícita na destilação de misturas miscíveis
e é importante o seu entendimento para aplicações posteriores.
(d.3) Diminuição do ponto de congelamento – crioscopia
A adição de um soluto diminui a capacidade do solvente escapar tanto para a
fase gasosa quanto para a fase sólida. Sendo assim, se para alcançarmos o
ponto de ebulição devemos aumentar a temperatura, para solidificarmos o solvente,
devemos resfriar abaixo do ponto de fusão.
(d.4) Pressão osmótica
Se um recipiente contendo apenas solvente puro for separado de outro recipiente
contendo uma solução desse solvente com algum soluto, apenas por uma
membrana semipermeável (que deixa passar apenas solvente), existe uma
tendência de as moléculas do solvente puro passarem para o recipiente da solução,
através da membrana. O fluxo de moléculas de solvente ocorre nos dois sentidos,
porém o resultado líquido é a transferência de solvente do menos concentrado
para o mais concentrado. Esse fenômeno está baseado na mesma explicação
PETROBRAS ABASTECIMENTO 2008 75
QualificAbast
das outras propriedades coligativas, isto é, reside na dificuldade que o soluto
impõe ao solvente para deixar a fase em que se encontra. Na presença do soluto,
o solvente tem mais dificuldade em atravessar a membrana. A força provocada
pelo movimento das moléculas é denominada de pressão osmótica.
(e) Fracionamento de misturas
O fracionamento de misturas é uma operação corriqueira e indispensável nas
plantas industriais. Existe um ramo da engenharia química, chamado de Operações
Unitárias, que estuda os processos de separação e os equipamentos envolvidos
nesses processos. Veremos agora os principais processos utilizados para separar
misturas heterogêneas e homogêneas.
(e.1) Fracionamento de misturas heterogêneas
As misturas heterogêneas, isto é, aquelas que apresentam mais de uma fase,
podem ser separadas geralmente por processos mecânicos. Alguns destes
processos, apesar de parecerem rudimentares, encontram aplicações importantes
nas atividades agroindustriais, na construção civil e na indústria de mineração,
entre outras. Abordaremos a seguir os processos mais comuns.
1. Catação: é um processo bastante rudimentar de separação, baseado na dife-
rença de tamanho e de aspecto das partículas de uma mistura de sólidos granu-
lados. As partículas são separadas manualmente ou com auxílio de pinças. É
aplicada quando as partículas dos sólidos em questão são bastante distintas e
possuem tamanhos razoáveis. Não é aplicado industrialmente.
2. Tamisação ou peneiração: é um processo de separação de sólidos que se
baseia na diferença de tamanho das partículas. A mistura é agitada sobre uma
peneira, e os componentes que possuem grânulos menores que a malha da
PETROBRAS ABASTECIMENTO 2008 76
QualificAbast
peneira atravessam-na e são separados daqueles que apresentam grânulos
maiores. É aplicado em escala industrial.
3. Levigação: é um processo de separação de sólidos que se baseia na diferença
de densidade e tamanho dos componentes da mistura. Emprega-se um fluido,
muitas vezes água, para arrastar o componente menos denso. A densidade do
fluido também influi na separação. Em escala industrial é aplicado com o nome
de elutriação.
4. Dissolução fracionada: é um processo de separação que se baseia na diferen-
ça de solubilidade de um dos componentes da mistura. Acrescenta-se aos sóli-
dos um solvente que dissolva apenas um deles e em seguida filtra-se a mistura.
Quando necessário, evapora-se o solvente para recuperar o componente solúvel.
5. Sublimação: é o processo baseado na capacidade de sublimação de um dos
componentes. Quando um dos componentes sublima mediante aquecimento, a
mistura pode ser separada, recuperando-se o sólido sublimado em um outro
recipiente.
6. Filtração: aplica-se às misturas heterogêneas do tipo sólido-líquido e sólido-
gás. A mistura é forçada a passar sobre uma superfície porosa, que retém os
sólidos e deixa passar o líquido ou o gás. É amplamente utilizada na indústria.
7. Decantação: aplica-se às misturas heterogêneas do tipo sólido-líquido e líqui-
do-líquido e se baseia na diferença de densidade entre os componentes da mis-
tura. No caso de sistemas sólido-líquido, deixa-se o sólido decantar no fundo do
recipiente que contém a mistura, e remove-se a fase líquida sobrenadante. Uti-
liza-se em certas ocasiões agentes aglutinantes, que aumentam o tamanho das
partículas, facilitando a decantação. No caso de separação de dois líquidos
imiscíveis, o líquido mais denso se acomoda abaixo do menos denso e é então
removido. É utilizada industrialmente.
8. Centrifugação: é um processo que também se baseia na diferença de densi-
PETROBRAS ABASTECIMENTO 2008 77
QualificAbast
dade entre os componentes da mistura. Utiliza-se o auxílio de uma força centrí-
fuga bem superior à força da gravidade, obtida pela rotação acelerada do recipi-
ente que contém a mistura, e com isso força-se o componente mais denso a se
depositar no fundo do recipiente. É utilizada industrialmente.
(e.2) Fracionamento de misturas homogêneas
As misturas homogêneas, isto é, aquelas que apresentam uma única fase, não
podem ser separadas por processos mecânicos. Utilizam-se, então, processos
físicos, que se baseiam, sobretudo, em mudanças de fase de agregação.
Abordaremos a seguir os principais processos.
1. Destilação simples: é um processo que se baseia na grande diferença de
pontos de ebulição dos componentes de uma mistura. A separação é feita aque-
cendo-se a mistura e promovendo-se a vaporização do composto mais volátil,
que é, a seguir, condensado em outro recipiente. O componente menos
volátil, em geral um sólido, fica retido no recipiente onde estava a mistura original.
2. Destilação fracionada: utiliza o mesmo princípio da destilação simples, po-
rém não se restringe apenas à separação de compostos com grande diferença de
ponto de ebulição, podendo ser aplicada na separação de compostos com diferença
de ponto de ebulição pequena, dependendo da eficiência da coluna. Emprega-se
uma coluna de fracionamento que tem como objetivo aumentar o número de
estágios de equilíbrio entre o líquido e vapor. Observe a Figura 4. Os vapores que
conseguem ultrapassar a coluna são condensados e a separação é efetivada. Os
produtos mais voláteis são recolhidos primeiramente. Os componentes menos
voláteis podem permanecer no balão, por interrupção do aquecimento após ter
sido recolhido todo o composto mais volátil, ou podem também ser destilados,
dependendo do interesse que se tenha. O processo de destilação do petróleo em
refinarias passa pela mesma sistemática, porém em escala industrial.
PETROBRAS ABASTECIMENTO 2008 78
QualificAbast
Figura 4 – Aparelhagem de laboratório para destilação fracionada
Fonte: SARDELLA e MATEUS, 1991.
Em alguns casos, a mistura homogênea não pode ser completamente separada
por destilação, pois, em certa concentração, a mistura forma um azeótropo.
Essa mistura azeotrópica destila como se fosse uma substância pura, não ha-
vendo a separação. Um exemplo de azeótropo ocorre na mistura de álcool etílico
e água, com concentrações respectivas de 95,5% e 4,5%, que destila a 78,1°C.
Nesta temperatura, os vapores desprendidos na destilação possuem a mesma
concentração que o líquido, não havendo a separação. Para se obter álcool puro,
deve-se apelar para procedimentos químicos. No caso da mistura azeotrópica de
álcool etílico e água, adiciona-se à mistura óxido de cálcio (cal viva), que reage
com a água, formando hidróxido de cálcio Ca(OH)2. A seguir, destila-se o álcool
etílico anidro.
3. Extração: esse processo se baseia na diferença de solubilidade entre os com-
ponentes da mistura. Utiliza-se um solvente apropriado, imiscível com a mistura
e que dissolva preferencialmente o componente que se quer remover. A extração
é um processo bastante utilizado industrialmente.
PETROBRAS ABASTECIMENTO 2008 79
QualificAbast
[Funções inorgânicas
Função química é uma denominação dada a um conjunto de compostos que
apresentam propriedades químicas semelhantes. Os compostos químicos
costumam ser divididos em orgânicos e inorgânicos. Os compostos orgânicos
são formados basicamente por cadeias carbônicas, enquanto que os inorgânicos
são formados por todos os outros elementos existentes, podendo em alguns casos
também possuir átomos de carbono. As funções orgânicas, isto é, aquelas
formadas pelos compostos orgânicos, serão estudadas mais adiante. Iniciaremos
agora o estudo das funções inorgânicas.
As funções inorgânicas englobam os ácidos, as bases, os sais e os óxidos. Existem
também os compostos chamados de hidretos e carbetos; porém, como são grupos
de uso mais restritos, não serão abordados.
Ao longo da história do desenvolvimento da química moderna, várias teorias
foram criadas para conceituar e prever se uma substância possui comportamento
ácido ou básico. Esses conceitos de ácido e base foram formulados com uma
ordem crescente de abrangência. Boyle (Robert Boyle, 1627-1691) e Gay-Lussac
(Joseph Louis Gay-Lussac, 1778-1850) conceituaram, em épocas distintas,
ácidos e bases, porém de uma maneira qualitativa. Ácidos eram substâncias
com sabor azedo e que possuíam a propriedade de mudar a cor de corantes
vegetais e, por sua vez, bases eram substâncias com sabor amargo e que tinham
a capacidade de tornar a pele lisa e escorregadia.
Porém, foi com Arrhenius (Svante August Arrhenius, 1859-1927) que a
conceituação de ácidos e bases foi embasada em conceitos químicos mais
profundos. Antes de mostrarmos a definição de Arrhenius, vamos conceituar a
Teoria de Dissociação Iônica de Arrhenius.
PETROBRAS ABASTECIMENTO 2008 80
QualificAbast
Se você está estudando este material neste momento, é porque já teve contato
com alguns conceitos de química durante sua vida acadêmica. Nesse sentido,
deve estar lembrado de um experimento químico bastante simples, que era o de
verificar a passagem de corrente elétrica em uma solução de água e sal, e perceber
que a corrente não era transmitida caso o circuito elétrico fosse mergulhado em
água pura destilada, nem em uma solução de água destilada e açúcar. A Figura
1 ilustra este experimento.
Figura 1 – Ensaio de condutibilidade elétrica de soluções
Fonte: SARDELLA e MATEUS, 1991.
Este fato nos mostra que existem substâncias que quando dissolvidas em água
se dissociam, formando íons (partículas com carga) e que são capazes de conduzir
a corrente elétrica quando submetidos a uma diferença de potencial. Esse é o
caso do sal de cozinha (NaCl), que é um composto iônico, e quando adicionado
em água tem seu retículo cristalino solvatado (quebrado), liberando os íons. Em
contrapartida, existem substâncias que não se dissociam, e permanecem em
seu estado original, estando apenas solubilizadas na solução. Este é o caso da
molécula de açúcar (C 12H22O11), que permanece intacta, não se dissociando em
íons como o sal.
Dissociação iônica do NaCl
H2 O
NaCl(s) Na +(aq) + Cl-(aq)
PETROBRAS ABASTECIMENTO 2008 81
QualificAbast
Portanto, existem substâncias que quando dissolvidas liberam íons e outras que
não liberam. As substâncias que liberam íons, e portanto conduzem a corrente
elétrica, são chamadas de eletrólitos; e as que não liberam íons, e portanto não
conduzem a corrente elétrica, são chamadas de não-eletrólitos.
A dissociação eletrolítica pode ocorrer em vários tipos de solventes, porém, como
a água é o solvente universal, vamos nos restringir ao estudo da dissociação em
solução aquosa.
Podemos ter dois tipos de eletrólitos. Os eletrólitos iônicos e os eletrólitos
moleculares. Os eletrólitos iônicos já possuem os íons em sua estrutura, isto é, a
ligação que os forma é a ligação iônica. É o caso do sal (NaCl). Esse composto é
um sólido iônico, que quando dissolvido dissocia-se em íons. É interessante
notarmos que todo composto iônico, quando dissolvido, está na forma dissociada.
Porém, nem sempre todo composto iônico está dissolvido ou solubilizado, podendo
uma quantidade estar precipitada. A quantidade que se solubiliza depende da
solubilidade do composto.
Já os eletrólitos moleculares são compostos que possuem apenas ligação covalente
em sua estrutura. Esses compostos podem se dissociar em íons, dependendo da
diferença de eletronegatividade entre os átomos que participam da ligação. Se a
diferença de eletronegatividade for grande, a molécula pode dissociar-se, porém
não totalmente como os compostos iônicos (100% de ionização). As moléculas
que se dissociam ficam em equilíbrio com seus íons. Veja o exemplo do HF
(ácido fluorídrico):
HF(aq) H+1(aq) + F-1(aq)
A molécula de ácido dissocia-se nos íons H+ e F-, porém fica em equilíbrio, não
estando totalmente dissociada.
Com base nesse raciocínio, temos então três classes de solutos: os não-eletrólitos, os
eletrólitos fracos e os eletrólitos fortes:
PETROBRAS ABASTECIMENTO 2008 82
QualificAbast
Não-eletrólitos: São as moléculas que quando em solução não se separam em
íons, sendo apenas dissolvidas, mantendo sua configuração original. Exemplos:
dióxido de carbono (CO2), glicose (C6H12O6), hidrocarbonetos.
Eletrólitos fracos: A molécula não-dissociada e os íons estão em equilíbrio,
coexistindo na solução. No entanto, é pequena a percentagem de moléculas
dissociadas. Essa percentagem aumenta com a diluição da solução e, em geral,
também com o aumento da temperatura. Exemplos: ácido acético (C H O ),
2 4 2
ácido cianídrico (HCN).
Eletrólitos fortes: O equilíbrio está deslocado no sentido dos íons, e em alguns
casos a dissociação é praticamente total. Exemplos: cloreto de sódio (NaCl),
hidróxido de sódio (NaOH), ácido clorídrico (HCl).
(a) Ácidos e bases
Baseado na constatação da existência de íons nas soluções eletrolíticas, de acordo
com a teoria da dissociação, Arrhenius estabeleceu os conceitos de ácidos e
bases:
Teoria de Arrhenius:
Ácidos – substâncias que dissolvidas em água sofrem ionização,
liberando como íon positivo exclusivamente cátions H+.
Bases – substâncias que dissolvidas em água sofrem dissociação
iônica, liberando como íon negativo exclusivamente ânions OH-.
De acordo com esse conceito, todo ácido tem sua fórmula iniciando por H e toda
base tem sua fórmula findando com OH. Veja os exemplos abaixo.
Ácido:
HCl (aq) H+ (aq) + Cl- (aq)
PETROBRAS ABASTECIMENTO 2008 83
QualificAbast
Os íons H+ são apenas prótons (o hidrogênio é constituído de um próton e um
elétron; ao perder seu elétron, torna-se um próton). Na verdade, pelas
características da água (possui par de elétrons livre), esse cátion H+ associa-se a
ela, formando o íon hidrônio (H 3O+). Então, a dissociação do ácido clorídrico HCl
é dada da seguinte maneira:
HCl + H2O H3 O+ + Cl-
Base:
NaOH Na+ + OH-
KOH K+ + OH-
O fenômeno de um composto doar seu próton é explicado pela diferença de
eletronegatividade. O cloro possui uma eletronegatividade muito maior que o
hidrogênio. Por isso a densidade eletrônica da ligação química é deslocada para
cima do cloro, deixando o hidrogênio deficiente de carga eletrônica. Desse modo,
a água, que possui pares eletrônicos livres, consegue retirar esse próton do
ácido.
Porém, essa teoria é bastante restrita, pois trata apenas de substâncias dissolvidas
em água, só explicando a existência de ácidos e bases em meios aquosos. Desse
modo, dois outros importantes conceitos para ácidos e bases foram formulados,
abordando critérios mais amplos. Os conceitos existentes mais conhecidos, além
do de Arrhenius, são os de Brönsted-Lowry (Johannes Nicolaus Brönsted, 1879-
1947, e Thomas Martin Lowry, 1874-1936), através da Teoria Protônica, e o
desenvolvido por Lewis (Gilbert Newton Lewis,1875-1946), através da Teoria
Eletrônica.
PETROBRAS ABASTECIMENTO 2008 84
QualificAbast
A Teoria Protônica conceitua ácidos e bases da seguinte maneira:
Teoria Protônica:
Ácidos – qualquer espécie química (molécula ou íon) que em
uma reação química libera um próton.
Bases – qualquer espécie química (molécula ou íon) que em uma
reação química recebe um próton.
Observe o exemplo abaixo:
O HCl neste caso age como ácido de Brönsted-Lowry, pois doa um próton (H+).
A água age como base de Brönsted-Lowry, pois recebe o próton. Note que do
lado direito da equação química os íons amônio (NH4 + ) e cloreto (Cl-) agem
como ácido e base respectivamente, com o cátion doando o próton para o ânion.
Essa reação é reversível. O ácido clorídrico (HCl) ao doar um próton (H+) para a
amônia (NH3) gera o íon cloreto. Portanto, todo ácido quando doa seu próton
forma uma base. A esse conjunto dá-se o nome de par conjugado. Da mesma
forma a amônia, ao receber o próton do ácido, forma um ácido como seu par
conjugado. Então, podemos concluir que quanto maior é a capacidade de um
ácido em liberar um próton, mais “forte” é esse ácido, e, desse modo, mais fraca
é a base conjugada desse ácido. O mesmo ocorre para a base. Quanto maior a
capacidade da base em receber esse próton, mais forte é essa base e mais fraco
é o seu ácido conjugado.
PETROBRAS ABASTECIMENTO 2008 85
QualificAbast
Dessa maneira, a força de um ácido ou de uma base é um conceito relativo, pois
a força deles depende do meio em que estão diluídos. Um ácido pode ser bastante
forte, ou seja, liberar facilmente seu próton, em um meio, e ser um ácido fraco,
ou até agir como uma base em outro meio. Veja o exemplo abaixo:
No exemplo acima, o ácido acético é um ácido muito mais forte quando o solvente
(que age como uma base) é a amônia, pois a amônia tem muito mais capacidade
de receber o próton liberado pelo ácido acético do que a água. Desse modo,
vemos também que a água é uma base mais fraca que a amônia. Portanto,
numa mistura de água e amônia, a água que até agora era vista como uma base,
passa a atuar como ácido, pois ela tem uma tendência menor que a amônia em
receber um próton. Veja o exemplo:
A outra teoria para explicar os ácidos e as bases é a Teoria Eletrônica de Lewis.
Essa teoria é a mais abrangente de todas e não apresenta a limitação da presença
de hidrogênio na molécula. Ela está baseada no conceito de compartilhamento
de pares eletrônicos entre dois átomos de espécies distintas.
A Teoria Eletrônica conceitua ácidos e bases da seguinte maneira:
Teoria Eletrônica:
Ácidos – qualquer espécie química (molécula ou íon) que em
uma reação química recebe um par eletrônico.
Bases – qualquer espécie química (molécula ou íon) que em uma
reação química doa um par eletrônico.
PETROBRAS ABASTECIMENTO 2008 86
QualificAbast
Observe o exemplo abaixo:
BF 3 + NH 3 → H 3N − BF 3
O boro no BF3 apresenta três pares de elétrons compartilhados, e para adquirir
a configuração de um gás nobre precisaria compartilhar outro par de elétrons. A
amônia (NH3) possui um par de elétrons livres e age, então, como uma base de
Lewis, enquanto que o BF 3 atua como um ácido de Lewis.
Daqui por diante, nos restringiremos aos conceitos de ácidos e bases de Arrhenius,
pois para o estudo em solução aquosa esses conceitos serão suficientes. Vejamos
agora como se classifica um ácido.
(a.1) Classificação dos ácidos
· Quanto à presença de oxigênio na molécula do ácido:
Hidrácidos – ácidos que não possuem oxigênio na molécula.
Exemplos: HCl, H 2S, HCN, HF, HI, H 2Se.
Oxiácidos – ácidos que possuem oxigênio em sua molécula.
Exemplos: HNO2, HCNO, H2SO4.
· Quanto ao número de elementos na molécula:
Binários – 2 elementos na molécula. Ex.: HCl, H S.
2
Ternários – 3 elementos na molécula. Ex.: H2CrO4, H2SO4.
Quaternários – 4 elementos na molécula. Ex.: HOCN, H Fe(CN) .
4 6
· Quanto ao número de hidrogênios ionizáveis na molécula:
A característica que define os ácidos é a liberação de um próton (H+) quando
dissociado em solução aquosa. Porém, nem todos os hidrogênios da molécula
são ionizáveis, isto é, nem todos os H+ são liberados na solução. Nos hidrácidos
todos os hidrogênios são ionizáveis. Nos oxiácidos apenas os hidrogênios ligados
PETROBRAS ABASTECIMENTO 2008 87
QualificAbast
aos átomos de oxigênio são ionizáveis. Veja os exemplos da Tabela 1.
Tabela 1: Classificação quanto ao no de hidrogênios ionizáveis
Monoácidos Diácidos Triácidos Tetrácidos
HCL H2S H3AsO4 H4P2O7
HBr H2SO3 H3PO4 H4SiO4
HI H2SO4 H3BO3 H4Sb2O7
HCN H2CO3
HCIO3 H3PO3
· Quanto à volatilidade:
Ácidos fixos – tem o ponto de ebulição relativamente alto em relação à tempera-
tura ambiente. Ex.: H SO , H PO , H BO , etc.
2 4 3 3 3 3
Ácidos voláteis – tem o ponto de ebulição abaixo ou próximo da temperatura
ambiente. Ex.: HCl, HI, HCN, H 2S, etc.
· Quanto à força do ácido:
Para calcular a força de um ácido, utiliza-se um parâmetro denominado grau de
ionização. Simboliza-se este parâmetro com a letra grega α (alfa). Ele é calcula-
do da seguinte maneira:
(22)
Quanto mais alto o valor de α, mais forte é o ácido. A classificação é a seguinte:
Ácido forte – grau de dissociação maior que 50%.
Ex.: HI (95%), HBr (93,5%), HCl (92,5%), H SO (61%).
2 4
Ácido moderado – grau de dissociação entre 5% e 50%.
Ex.: H2C2O4 (50%), H3PO4 (27%), HF (8,5%).
Ácido fraco – grau de dissociação menor que 5%.
Ex.: H 2S (0,08%), HCN (0,008%).
PETROBRAS ABASTECIMENTO 2008 88
QualificAbast
(a.2) Nomenclatura dos ácidos
1) Hidrácidos:
ácido............................................ídrico
(nome do elemento formador)
Exemplos: HCl – ácido clorídrico.
HBr – ácido bromídrico
HCN – ácido cianídrico
H2S – ácido sulfídrico
2) Oxiácidos:
Diferentemente do que ocorre com os hidrácidos, em geral existe mais de um
oxiácido com o mesmo elemento central. A nomenclatura destes compostos
depende do Nox deste elemento. Os ácidos que apresentam o elemento central
com N ox máximo (o que corresponde ao número do grupo da Classificação
Periódica; por exemplo, para os elementos do grupo 6A, o Nox máximo é +6)
utilizam o sufixo -ico; exceto para os grupos 7A e 7B, que utilizam o sufixo -ico
e o prefixo per- para o ácido que contiver o elemento de Nox +7. Se o elemento
apresentar apenas dois N ox, usa-se o sufixo -oso para o ácido que contiver o
elemento central com menor Nox. Se o elemento central formar mais de dois
ácidos com N oxx diferentes, utilizam-se o prefixo hipo- e o sufixo -oso para o ácido
que contiver o elemento com Nox mínimo. Há casos em que o elemento apresenta
quatro valores distintos para o N ox. Veja como fazer para nomear esses ácidos
nos exemplos abaixo.
Ordem crescente do Nox
ácido hipo .............................................. oso
ácido ..................................................... oso
ácido hipo .............................................. ico
ácido ..................................................... ico
ácido per ............................................... ico
(nome do elemento principal)
PETROBRAS ABASTECIMENTO 2008 89
QualificAbast
Ácido Nox do elemento central Nome
HClO +1 Ácido hipocloroso
HClO2 +3 Ácido cloroso
HClO3 +5 Ácido clórico
HClO4 +7 Ácido perclórico
Ácido Nox do elemento central Nome
H3PO2 +1 Ácido hipofosforoso
H3PO3 +3 Ácido fosforoso
H4P2O6 +4 Ácido hipofosfórico
H3PO4 +5 Ácido fosfórico
Os ácidos H 3PO 2 e H3PO3 apesar de possuírem três hidrogênios são classificados
como monoácido e diácido, respectivamente, pois possuem apenas um e dois
hidrogênios ligados ao oxigênio.
Outra maneira prática de se nomear um ácido consiste em consultar a tabela
com a nomenclatura dos ânions, que se encontra no Anexo A desta apostila. A
partir do nome do ânion é possível se obter o nome do ácido, apenas fazendo-se
a conversão indicada abaixo.
Todo ânion que tiver sufixo Deve ser substituído por
-ETO -ÍDRICO
-ITO -OSO
-ATO -ICO
Os prefixos hipo- e per-, quando presentes na denominação dos ânions, devem
permanecer também no nome do ácido. Assim sendo, toda vez que um ácido
precisar ser nomeado, uma consulta a uma tabela de ânions provavelmente
resolverá o problema.
PETROBRAS ABASTECIMENTO 2008 90
QualificAbast
Exemplos:
Nox do
Ácido Ânion Nome do elemento Nome do ácido
formador ânion central
H 2S S 2- Sulfeto -2 Ácido sulfídrico
H2S2O4 S2O42- Hipossulfito +3 Ácido hipossulfuroso
H2SO3 SO32- Sulfito +4 Ácido sulfuroso
H2S2O6 S2O62- Hipossulfato +5 Ácido hipossulfúrico
H2SO4 SO42- Sulfato +6 Ácido sulfúrico
Note que a valência do ânion indica quantos prótons o ácido terá. O ânion fosfato
(PO 3-) forma o ácido H PO (ácido fosfórico ou ortofosfórico). Precisa-se de três
4 3 4
prótons (H ) para neutralizar as três cargas do ânion.
+
Existe ainda outro critério para a nomenclatura, que é o grau de hidratação, o
qual confere as denominações orto (opcional), meta e piro para os ácidos. A
tabela de ânions já traz estas denominações junto com o ânion.
· Orto – prefixo para o ácido com o maior grau de hidratação.
Ex.: H3PO4 (ácido ortofosfórico).
· Meta – prefixo para o ácido obtido pela retirada de uma molécula de água de
um ácido orto.
Ex.: H3PO 4 - H2O → HPO 3 (ácido metafosfórico).
· Piro – prefixo para um ácido obtido pela condensação de duas moléculas de
ácidos orto com a retirada de uma molécula de água.
Ex.: 2 H3PO4 - H2O → H4P2O7 (ácido pirofosfórico).
PETROBRAS ABASTECIMENTO 2008 91
QualificAbast
(a.3) Principais ácidos utilizados em uma refinaria
O ácido sulfúrico (H2SO4) é um oxiácido fixo. Tem massa molar igual a 98g/mol.
É utilizado na correção do pH de efluentes alcalinos, nas reações de esterificação,
desidratação e alquilação catalítica. Seu consumo total em um país é um dos
indicativos de industrialização.
O ácido clorídrico (HCl) é um hidrácido volátil com massa molar igual a 36,5g/
mol. É utilizado em substituição ao ácido sulfúrico, porém apresenta um custo
mais elevado.
O ácido fluorídrico (HF) é um hidrácido volátil com massa molar igual a 20g/mol.
Utilizado principalmente em reações de alquilação catalítica e como catalisador.
O ácido sulfídrico (H2S) é um dos principais contaminantes do petróleo e deve
ser removido mediante processos de acabamento dos produtos do petróleo.
(a.4) Nomenclatura das bases
Conforme a teoria de Arrhenius, um composto é uma base quando em meio
aquoso se dissocia, liberando íons OH- (íons hidróxidos). Da mesma forma que
os ácidos, as bases quando em solução aquosa também conduzem a corrente
elétrica por estarem dissociadas, isto é, na forma de íons. A nomenclatura das
bases é muito mais simples do que a dos ácidos. Escreve-se o nome do íon
“hidróxido” e na seqüência o nome do cátion formador da base.
hidróxido de.............................................
(nome do cátion formador)
PETROBRAS ABASTECIMENTO 2008 92
QualificAbast
Exemplos: NaOH – hidróxido de sódio.
Ca(OH) 2 – hidróxido de cálcio
Existe, no entanto, situações em que um mesmo elemento pode formar mais de
uma base, ficando com um número de oxidação diferente em cada um dos
compostos. Nesses casos, diferenciam-se os compostos utilizando a seguinte
regra:
Para nomear a base em que o cátion apresenta o menor Nox,
acrescenta-se o sufixo -oso ao nome do cátion formador da base,
ou então se acrescenta o Nox do cátion em algarismo romano.
Para nomear a base em que o cátion apresenta o maior Nox,
acrescenta-se o sufixo -ico ao nome do cátion formador da base,
Exemplos:
Fe(OH)2 – hidróxido ferroso ou hidróxido de ferro ll (Nox do Fe = +2)
Fe(OH)3 – hidróxido férrico ou hidróxido de ferro lll (N ox do Fe = +3)
Sn(OH)2 – hidróxido estanoso ou hidróxido de estanho ll (Nox do Sn = +2)
Sn(OH)4 – hidróxido estânico ou hidróxido de estanho lV (N do Sn = +4)
ox
(a.5) Classificação das bases
· Quanto ao número de íons OH-:
Monobase – apresenta apenas um íon OH-1 na fórmula. Ex.: NaOH, NH 4OH.
Dibase – apresenta dois íons OH-1 na fórmula. Ex.: Ni(OH) , Zn(OH) .
2 2
Tribase – apresenta três íons OH-1 na fórmula. Ex.: Al(OH) , Bi(OH) .
3 3
· Quanto à solubilidade:
Solúveis – os hidróxidos de metais alcalinos e de amônio.
Pouco solúveis – os hidróxidos de metais alcalino-terrosos.
Insolúveis – os demais hidróxidos.
PETROBRAS ABASTECIMENTO 2008 93
QualificAbast
· Quanto à força:
De acordo com o grau de dissociação iônica (α), classificam-se em:
Bases fortes – apresentam o grau de dissociação iônica elevado, próximo de
100%. Ex.: Bases de metais alcalinos e alcalino-terrosos.
Bases fracas – apresentam o grau de dissociação reduzido e inferior a 5%. Ex.:
As demais bases, como NH 4OH, Fe(OH) 2, Fe(OH) 3.
(a.6) Principais bases utilizadas em uma refinaria
O hidróxido de sódio (NaOH) possui o nome comercial de soda cáustica. Tem
massa molar igual a 40g/mol. É utilizada no tratamento MEROX para retirada de
H2S do GLP, nafta e querosene.
O hidróxido de cálcio [Ca(OH)2] possui massa molar igual a 74g/mol. Devido ao
seu baixo custo, é utilizado como alcalinizante no tratamento de águas de
abastecimento e de efluentes industriais.
(a.7) Reações ácido-base
Um ácido em presença de uma base, ou vice-versa, provoca uma reação chamada
de neutralização. A mistura de um ácido de Arrhenius com uma base de Arrhenius
tem como produto sal e água.
NEUTRALIZAÇÃO
Ácido + Base → sal + água
Exemplo:
HCl + NaOH → NaCl + H 2O
PETROBRAS ABASTECIMENTO 2008 94
QualificAbast
(a.8) Ação sobre indicadores
As substâncias podem ser testadas quanto à sua acidez ou basicidade através
do uso de indicadores, que na presença de uma solução com caráter ácido ou
básico apresentam colorações distintas. A Tabela 2 apresenta alguns desses
indicadores.
Tabela 2 – Indicadores ácido-base
INDICADOR Tornassol Fenolftaleína Metilorange
Coloração em Rosa Incolor
presença de ácido Vermelha
Coloração em Azul Vermelha Amarela
presença de base
(b) Sais
Sal é toda substância que se dissocia em solução aquosa, liberando um cátion
diferente de H+ e um ânion diferente de OH-.
Exemplo:
NaCl → Na+ + Cl-
A quantidade de cátions e ânions deve ser tal, que a carga total do sal deve ser
nula.
(b.1) Nomenclatura dos sais
Segue a seguinte regra:
............................................de.............................................
[nome do(s) ânions(s) formador(es)] [nome do(s) cátion(s) formador(es)]
PETROBRAS ABASTECIMENTO 2008 95
QualificAbast
Exemplo:
NaCl – Cloreto de sódio.
CaBrCl – Cloreto-brometo de cálcio.
K2NaPO4 – Fosfato de dipotássio e sódio.
No caso do cátion apresentar mais de um N ox, utiliza-se a mesma regra que foi
utilizada para as bases, com os sufixos -oso e -ico para o menor e maior Nox,
respectivamente, ou com o uso do N ox em algarismo romano. Caso o sal possua
hidrogênio ionizável na fórmula, o prefixo hidrogeno- aparece antes do nome do
ânion.
Exemplos:
NiCO3 – carbonato niqueloso ou carbonato de níquel ll (Nox do Ni = +2)
Ni (CO ) – carbonato niquélico ou carbonato de níquel lll (N do Ni = +3)
2 3 3 ox
NaHSO4 – monoidrogenossulfato de sódio
(NH )H PO – diidrogenofosfato de amônio
4 2 4
(b.2) Classificação dos sais
· Quanto à presença de oxigênio:
Sais oxigenados – apresentam oxigênio. Ex.: CaClO, Na 2SO 4.
Não oxigenados – não apresentam oxigênio. Ex.: AlF3, CuS.
· Quanto ao número de elementos constituintes:
Binários – apresentam dois elementos. Ex.: CaI 2, NaCl.
Ternários – apresentam três elementos. Ex.: MgSO3 , FeCO3.
Quaternários – apresentam quatro elementos. Ex.: KSCN, Na [Fe(CN) ].
3 6
· Quanto à natureza dos íons:
Sal normal – sal formado apenas por um tipo de ânion e um tipo de cátion
diferentes de OH- e H+.
Ex.: NaCl, KNO3, KCl.
PETROBRAS ABASTECIMENTO 2008 96
QualificAbast
Hidrogenossal – sal que apresenta hidrogênio ionizável, devido à reação de
neutralização parcial. Ex.: NaHCO 3, NaHS.
NaOH + H2SO4 → NaHSO4 + H2O
Hidroxissal – sal que apresenta ânion hidróxido, devido à reação de neutralização
parcial. Ex.: Ca(OH)Br, Bi(OH)2Cl.
Ca(OH) 2 + HCl → CaOHCl + H2O
Sal duplo – sal que apresenta mais de um tipo de cátion ou mais de um tipo de
ânion diferente de H+ e de OH-. Ex.: NaKCO 3, CaBrCl.
(b.3) Principais sais utilizados em refinarias
Os sais são utilizados com freqüência em uma refinaria como catalisadores nos proces-
sos de craqueamento e no acabamento dos produtos do petróleo, como por exemplo, o
AlCl3 (cloreto de alumínio), o PbS (sulfeto de chumbo II) e o Na2S (sulfeto de sódio).
Silicatos (SiO4 -4) e carbonatos (CO3 -2) de cálcio (Ca+2 ) e magnésio (Mg+2 ) são
grandes causadores de incrustações, principalmente em equipamentos que
utilizem água e vapor, geralmente os equipamentos geradores e trocadores de
calor. As incrustações são substâncias que por algum motivo tiveram sua
solubilidade reduzida e precipitam da solução onde se encontram, causando
acúmulo em certas regiões do equipamento.
(c) Óxidos
São compostos formados por apenas dois elementos, onde o mais eletronegativo
é o oxigênio. Como o flúor é mais eletronegativo que o oxigênio, os compostos
que possuem apenas flúor e oxigênio não são óxidos, mas sim fluoretos.
PETROBRAS ABASTECIMENTO 2008 97
QualificAbast
São exemplos de óxidos:
CO2 Na2 O H2O SO2
Em todos estes compostos o elemento mais eletronegativo (que atrai a nuvem
eletrônica para si) é o oxigênio.
(c.1) Nomenclatura dos óxidos
Nomeiam-se os óxidos escrevendo-se a palavra óxido seguida da preposição de
e do nome do elemento ligado ao oxigênio.
óxido de...........................................................
(nome do elemento ligado ao oxigênio)
Exemplos: BaO – óxido de bário
Li2O – óxido de lítio
Quando o elemento forma dois óxidos, pode-se usar os sufixos -oso e -ico para o
de menor e maior Nox, respectivamente. Se o elemento forma vários óxidos,
pode-se indicar o Nox do elemento em algarismo romano, após o nome do elemento.
Exemplos:
Cu2O – óxido cuproso ou óxido de cobre I.
CuO – óxido cúprico ou óxido de cobre II.
Fe2O3 – óxido férrico ou óxido de ferro III.
Outra forma de nomear os óxidos consiste em indicar a quantidade de átomos de
oxigênio que está presente no óxido com os prefixos mono-, di-, tri-, tetra-,
penta-, etc. seguida da quantidade de átomos do outro elemento, também indicada
pelos mesmos prefixos. O prefixo mono- antes do nome do elemento ligado ao
oxigênio é opcional.
PETROBRAS ABASTECIMENTO 2008 98
QualificAbast
Exemplos:
N2O – óxido de dinitrogênio
NO – monóxido de nitrogênio
N2O3 – trióxido de dinitrogênio
NO2 – dióxido de nitrogênio
CO – monóxido de carbono
CO2 – dióxido de carbono
(c.2) Classificação dos óxidos
Os óxidos são classificados em:
· Óxidos ácidos – São compostos moleculares formados pela ligação entre oxigê- nio
e elementos não-metálicos ou elementos metálicos com Nox maior que +4.
Podem estar presentes na forma sólida, líquida ou gasosa.
São oriundos da desidratação de um ácido, possuindo então uma nomenclatura opcional.
Ex.: H SO - H O → SO (anidrido sulfúrico)
2 4 2 3
Reagem com água, formando um ácido.
Ex.: SO + H O → H SO
3 2 2 4
Reagem com base, formando sal e água.
Ex.: SO3 + 2NaOH → Na2SO4 + H2O
Exemplos de óxidos ácidos: SO NO , CrO , CO , Mn O , ClO .
2, 2 3 2 2 7 2
· Óxidos básicos – São compostos com acentuado caráter iônico formados pela
ligação do oxigênio com metais de baixa eletronegatividade, como os metais
alcalinos e alcalino-terrosos.
PETROBRAS ABASTECIMENTO 2008 99
QualificAbast
Reagem com água, formando uma base.
Ex.: Na O + H O → 2NaOH
2 2
Reagem com ácido, formando sal e água
Ex.: Na O + 2HCl → 2NaCl + H O
2 2
Exemplos de óxidos básicos: Li2O, CaO, K2O, BaO, CuO.
· Óxidos anfóteros – São óxidos com estrutura iônico-molecular que podem apre-
sentar ora um comportamento de óxido ácido, ora de óxido básico. Não reagem
com água. Reagem com ácido e com base, formando sal e água.
Exemplos: ZnO, Cr2O3, As2O3, Al2O3, MnO2, As2O5, SnO, SnO2, PbO, PbO2,
Sb2O3, Sb2O5.
. Óxidos indiferentes – Não apresentam comportamento ácido nem básico. Não
reagem com água nem com ácidos ou bases.
Exemplos: CO, NO, N2O, H2O.
. Peróxidos – São compostos iônicos sólidos que apresentam o oxigênio com
Nox igual a -1. O H 2O 2 (peróxido de hidrogênio – água oxigenada) é uma
exceção entre eles, pois é um peróxido molecular líquido.
Exemplos: K2O2, CaO2, Na2O2, Ag2O2, BaO2.
. Superóxidos – Compostos iônicos sólidos que apresentam o oxigênio com o
Nox igual a -1/2.
Exemplos: K O , Na O , Li O , CaO , MgO .
2 4 2 4 2 4 4 4
PETROBRAS ABASTECIMENTO 2008 100
QualificAbast
[Reações químicas
(a) A equação química
Representa-se uma reação química através de uma equação química. Você já
deve estar familiarizado com estas equações, pois toda vez que um fenômeno
químico tem de ser ilustrado, utilizam-se estas equações. Considere a equação
química representada abaixo:
C12H22O11 + 24 H2SO4 → 24 SO2 + 12 CO2 + 35 H2O
· As substâncias que estão antes da seta são chamadas de reagentes e as que
estão após a seta são chamadas de produtos, ou seja, os reagentes são as subs-
tâncias que vão reagir para formar os produtos da reação química.
· Os números que antecedem cada substância são os coeficientes
estequiométricos, que são os menores números inteiros que indicam a propor-
ção entre as espécies que estão reagindo e sendo formadas, ou seja, indicam o
balanço estequiométrico da reação química. Na reação acima, para cada molé-
cula de celulose (C 12H22O11), são necessárias 24 moléculas de ácido sulfúrico
(H2SO4) e são formadas 24 moléculas de dióxido de enxofre (SO2), 12 moléculas
de dióxido de carbono (CO ) e 35 moléculas de água (H O). Pode-se também
2 2
utilizar a mesma relação para número de mols, ao invés de número de molécu-
las, o que em geral é mais conveniente.
· A seta que separa os reagentes dos produtos pode ser simples ou dupla. A seta
simples indica que a reação ocorre apenas no sentido indicado; enquanto que a
PETROBRAS ABASTECIMENTO 2008 101
QualificAbast
seta dupla mostra que a reação é reversível, isto é, existe um equilíbrio entre os
dois sentidos da reação.
Sobre ou sob a seta que separa os reagentes dos produtos na equação química,
podem ser indicadas as condições necessárias para que a reação ocorra. Para
isso costumam ser utilizados símbolos. Abaixo estão alguns desses símbolos e
seu significado:
- Calor fornecido à reação;
- Energia luminosa (luz);
Cat. – Catalisador;
· Estado de agregação dos reagentes e produtos é indicado ao lado de cada
substância, entre parênteses, utilizando-se os símbolos s para sólido, l para
líquido, g para gasoso e aq para aquoso. Por exemplo:
Esta representação significa que a água líquida, sob uma descarga elétrica,
decompõe-se em hidrogênio e oxigênio gasosos. É comum também encontrar a
indicação do estado físico em notação subscrita.
· Uma equação química deve estar balanceada, ou seja, deve mostrar que áto-
mos não são criados nem destruídos em uma reação, apenas combinam-se de
formas diferentes. Portanto, a mesma quantidade de átomos de um elemento
que existe nos reagentes deve existir nos produtos da reação. Os coeficientes da
reação nos fornecem a proporção entre os compostos que reagem e os que são
formados, deixando a equação balanceada.
PETROBRAS ABASTECIMENTO 2008 102
QualificAbast
(b) Classificação das reações químicas
As reações químicas podem ser classificadas mediante vários critérios. Vamos
mostrar aqui alguns dos mais importantes.
(b.1) Reação de oxirredução
Reações de oxirredução são aquelas que apresentam transferência de elétrons
entre os reagentes, ou seja, são aquelas onde ocorre variação do N ox de alguns
dos elementos envolvidos na reação.
A oxidação é a perda de elétrons, e a espécie que doa seu elétron se oxida.
Fe+2 – 1e-1 Fe+3
O íon Fe+2 perde um elétron, isto é, sofre oxidação, e passa para a forma Fe+3. O
elemento que se oxida provoca a redução de um outro elemento. Diz-se então
que o elemento que se oxida é o agente redutor, pois provoca a redução de outro
elemento.
A redução é o ganho de elétrons, e a espécie que recebe um elétron se reduz.
Sn+4 + 2e-1 Sn+2
O íon Sn+4 ganha dois elétrons, isto é, sofre redução, e passa para a forma Sn+4.
O elemento que se reduz provoca a oxidação do outro elemento. Diz-se que o
elemento que se reduz é o agente oxidante, que provoca a oxidação em outro
elemento. Portanto:
· o agente oxidante sofre redução, provocando a oxidação da outra espécie
participante da reação.
PETROBRAS ABASTECIMENTO 2008 103
QualificAbast
· o agente redutor sofre oxidação, provocando a redução da outra espécie parti-
cipante da reação.
Observe que não existe uma reação de oxidação sem haver uma reação de redução.
A ocorrência de uma depende, exclusivamente, da ocorrência da outra. São
reações de oxirredução as reações de combustão, de corrosão e várias outras.
Veja o exemplo abaixo da reação de combustão do carbono:
C + O2 → CO2
O carbono (substância simples) passou do N ox 0 para N ox +4, portanto ele perdeu
elétrons, se oxidou e seu Nox aumentou. Já o oxigênio (substância simples também)
passou do N ox 0 para o N ox -2, portanto se reduziu e seu N ox diminuiu. Logo, o
oxigênio (O2) é o agente oxidante, pois causou a oxidação do carbono, e o carbono
(C) é o agente redutor, pois causou a redução do oxigênio.
(b.2) Reação de análise ou decomposição
É o nome dado às reações em que uma única substância é decomposta em uma
ou mais substâncias.
Vejamos alguns exemplos, como a decomposição da água em hidrogênio e
oxigênio, mediante a passagem de uma corrente elétrica, ou a decomposição
térmica do carbonato de cálcio.
PETROBRAS ABASTECIMENTO 2008 104
QualificAbast
Podemos dar nomes para essas reações de decomposição de acordo com a
condição necessária para que a reação ocorra. Assim,
· Pirólise: é a decomposição que ocorre mediante fornecimento de calor;
· Eletrólise: é a decomposição que ocorre pela passagem de corrente elétrica;
· Fotólise: é a decomposição que ocorre por irradiação luminosa.
(b.3) Reação de síntese ou composição
É o nome dado às reações em que duas ou mais substâncias, simples ou
compostas, formam apenas uma substância composta.
Vejamos alguns exemplos:
C + O2 → CO2
CaO + CO2 → CaCO3
Se todos os reagentes forem substâncias simples, a reação é chamada de síntese
total. Se houver pelo menos uma substância composta entre os reagentes, a
reação é de síntese parcial.
(b.4) Reação de deslocamento ou simples troca
É aquela em que uma substância simples reage com uma substância composta,
produzindo outra substância simples e outra substância composta.
Veja este exemplo, em que o ferro, por ser mais reativo, desloca o cobre, gerando
um depósito de cobre metálico.
PETROBRAS ABASTECIMENTO 2008 105
QualificAbast
C + O2 → CO2
Linus Pauling estabeleceu empiricamente a ordem de reatividade química de
metais e não-metais que nos permite prever se uma reação química de
deslocamento irá ocorrer. Esta ordem está apresentada na Figura 1.
Considere a reação de deslocamento, apresentada a seguir, em que o elemento A
deslocou o elemento B:
A + BC → AC + B
Figura 1 – Ordem de reatividade de metais e não-metais
PETROBRAS ABASTECIMENTO 2008 106
QualificAbast
Esta reação ocorre porque A é mais reativo que B. Podemos então dizer que o
elemento A é menos nobre que B, pois é mais reativo. Assim, consultando a
ordem de reatividade, é possível prever a ocorrência de uma reação de
deslocamento.
A reatividade dos elementos metálicos está referendada ao elemento hidrogênio.
Os elementos que estão acima do H na ordem são mais reativos e menos nobres.
Os que estão abaixo do H são menos reativos e mais nobres. Tanto os metais
quanto os não-metais estão dispostos em ordem crescente de reatividade, assim,
quanto mais no início da ordem está o elemento, mais reativo ele é.
Observe o exemplo:
Fe + 2HCl → FeCl 2 + H2
Colocando-se uma chapa de ferro em uma solução de ácido clorídrico, o ferro,
2 por ser mais reativo que o H, desloca-o, produzindo o sal cloreto de ferro II
(FeCl2) e hidrogênio (H2). O sal permanece na solução, pois é solúvel, e o
hidrogênio, por ser um gás, se desprende.
(b.5) Reação de dupla troca
São as reações em que duas substâncias compostas reagem entre si, produzindo
duas outras novas substâncias compostas.
HCl + NaOH → NaCl + H 2O
A reação acima é uma reação de dupla troca, pois há uma permuta entre o
hidrogênio do ácido e o cátion da base, e duas novas substâncias compostas são
formadas. Toda reação de neutralização é uma reação de dupla troca.
PETROBRAS ABASTECIMENTO 2008 107
QualificAbast
Outro exemplo:
NaCl + AgNO 3 → AgCl + NaNO 3
Nessa reação entre cloreto de sódio (NaCl) e nitrato de prata (AgNO3), formam-
se outros dois sais, o cloreto de prata (AgCl) e o nitrato de sódio (NaNO3). Reações
de dupla troca não são reações de oxirredução, pois não há transferência de
elétrons entre as substâncias (calcule o Nox dos elementos envolvidos e confirme).
As reações de dupla troca podem produzir precipitados, ou seja, algum dos
compostos formados pode ser insolúvel na solução. Nesse caso, costuma-se
chamar essas reações de dupla troca de reações de precipitação.
Para se prever se haverá ou não precipitação, é necessário conhecer quais substâncias
têm baixa solubilidade. Algumas regras que generalizam com bastante abrangência a
solubilidade de compostos em solução aquosa serão mostradas a seguir:
1) Sais de cátion amônio (NH4 +) são solúveis.
2) Todos os nitratos (NO 3-) são solúveis.
3) Sais de metais alcalinos são solúveis.
4) Cloretos (Cl-), brometos (Br-), fluoretos (F-) e iodetos (I-) de prata, de chumbo
II, de cobre I e de mercúrio I são insolúveis. Os demais haletos são solúveis.
5) Todos os ácidos inorgânicos são solúveis.
6) A maioria dos acetatos (C2H3O2-) é solúvel (exceção para o de prata e o de mercúrio I).
7) Os sulfatos (SO 4-2) de cálcio, estrôncio, bário, rádio e chumbo II são insolú-
veis. Os demais sulfatos são solúveis.
8) A maioria dos carbonatos (CO 2-), cromatos (CrO 2-), oxalatos (C O 2-), fosfatos
3 4 2 4
(PO33-), sulfetos (S2- ) e sulfitos (SO32- ) são insolúveis (com exceção dos que pos-
suem cátions alcalinos e cátion amônio).
9) A maioria dos hidróxidos é insolúvel (com exceção dos hidróxidos de metais
alcalinos e de amônio).
Desse modo, pode-se prever quais compostos formados precipitarão, permitindo
sua separação da solução mediante processos de separação comuns.
PETROBRAS ABASTECIMENTO 2008 108
QualificAbast
(b.6) Reação ácido-base
Esse tipo de reação já foi apresentado anteriormente quando as funções inorgânicas
foram abordadas. Dentro desse tópico, podemos citar as reações de:
a) Neutralização: reação entre um ácido e uma base, em que sal e água são
formados.
HCl + NaOH → NaCl + H2O
b) Hidrólise: é o processo inverso da neutralização. Sais formados a partir de
ácidos ou bases fracas apresentam reação inversa, isto é, reagem com a água
regenerando o ácido e/ou a base correspondente. Assim, quando esses sais são
dissolvidos em água podem formar soluções com caráter ácido ou básico. As
reações de hidrólise estão sempre em equilíbrio. Observe o exemplo de reação
de hidrólise abaixo, onde prevalece o caráter ácido da solução.
NH4+1 + Cl-1 + H 2O NH4OH + H +1 + Cl-1
NH4+1 + H 2O NH 4OH + H+1
(b.7) Reação exotérmica e endotérmica
Todo sistema apresenta uma tendência natural de caminhar para um estado de
menor energia. Quanto menos energia puder ser gasta para organizar um sistema,
assim a natureza procederá.
O conteúdo de calor de um sistema é chamado de entalpia. A variação de
entalpia ( H), isto é, o conteúdo de calor dos produtos menos o conteúdo de
calor dos reagentes ( H=H -H ), medida a pressão constante, retrata a quanti-
P R
dade de calor liberada ou absorvida na reação. É expressa em unidades de
energia, o quilojoule (kJ), ou em unidade de energia por mol (kJ/mol).
PETROBRAS ABASTECIMENTO 2008 109
QualificAbast
ΔH positiva – o sistema absorve energia
ΔH negativa – o sistema libera energia
Então, quanto ao calor envolvido em uma reação, ela pode ser classificada em:
· Reação exotérmica – são as reações químicas que liberam calor.
· Reação endotérmica – são as reações químicas que absorvem calor.
O calor é representado nestas reações pela variação de entalpia, escrita ao fim da
reação. Se a reação é endotérmica, isto é, absorve calor, a variação da entalpia
é positiva. Se a reação é exotérmica, isto é, libera calor, a variação de entalpia é
negativa. Por exemplo:
Δ
C(s) + O2(g) → CO2(g) ΔH = -393,5kJ
A reação de combustão do carbono é uma reação exotérmica, assim como todas
as reações de combustão. É importante salientar que a reação de combustão,
mesmo sendo exotérmica, necessita de uma fonte inicial de calor para que a
reação se inicie, e é o que está simbolizado sobre a seta.
Note que a reação de combustão está sendo classificada como uma reação que
envolve calor, porém, como vimos anteriormente, ela pode ser enquadrada em
outras classificações. A reação de combustão é uma reação de oxirredução e
também uma reação de síntese.
(b.8) Espontaneidade de uma reação
Para prever a espontaneidade de uma reação química, devemos avaliar não só o
conteúdo de calor do sistema, como também seu grau de desordem, pois há na
Natureza uma tendência de caminhar tanto para um estado de menor energia
quanto para o estado de maior desordem possível. O grau de desordem de um
sistema é chamado de entropia.
PETROBRAS ABASTECIMENTO 2008 110
QualificAbast
A variação de entropia (ΔS), isto é, o grau de desordem dos produtos menos o
grau de desordem dos reagentes (ΔS=S -S ), nos indica o estado de desordem
P R
do sistema. É expressa em unidades de energia por temperatura absoluta (J/K)
ou em unidades de energia por temperatura absoluta por mol (J/K.mol)
ΔS positiva – o sistema aumenta sua desordem
ΔS negativa – o sistema diminui sua desordem
As variações de entalpia e entropia estão relacionadas, para valores de temperatura
e pressão constantes, pela seguinte equação:
(23)
onde o termo ΔG, denominado variação de energia livre de Gibbs, corresponde
à máxima energia útil que é possível retirar de um sistema. Se o valor de ΔG é
negativo, isto indica que a reação química é espontânea, isto é, ocorrerá no
sentido apresentado na equação. Se ΔG é positivo, o processo não é espontâneo
e, por conseguinte, a reação inversa será espontânea.
De acordo com a equação 23, não basta a reação apenas liberar calor (ΔH
negativo) na busca de um estado energético menor. A entropia deve aumentar
também (ΔS positivo). A relação entre estas duas variáveis e o valor da tempe-
ratura em que a reação ocorre nos indica se a reação é espontânea ou não.
PETROBRAS ABASTECIMENTO 2008 111
QualificAbast
[Cinética química
Esta área da química estuda a velocidade com que uma reação química ocorre
e os fatores que influem nessa velocidade. A velocidade de uma reação química
é a medida da rapidez com que se formam os produtos da reação, ou a medida
da rapidez com que os reagentes químicos são consumidos.
Dentre os fatores que influenciam a velocidade de uma reação destacam-se a
natureza dos reagentes, a superfície de contato, a concentração dos reagentes, a
pressão, a temperatura, os catalisadores, entre outros. Abordaremos agora alguns
desses fatores.
(a) Influência da concentração na velocidade de reação
Considere uma reação hipotética homogênea:
A + B → C + D
Considere que os reagentes A e B foram misturados em um reator químico. À
medida que a reação vai se processando, as concentrações de A e B, representadas
por [A] e [B], respectivamente, vão diminuindo e os produtos vão sendo forma-
dos. A Tabela 1 apresenta a variação de [A], em função do tempo de reação
decorrido.
PETROBRAS ABASTECIMENTO 2008 112
QualificAbast
Tabela 1 – Cinética de reação
Tempo (min) [A] (mol/L)
0,0 10,00
2,0 6,69
4,0 4,48
6,0 3,00
8,0 2,00
10,0 1,34
12,0 0,90
14,0 0,60
16,0 0,40
Podemos com base nesses dados calcular a velocidade média da reação
O sinal negativo que antecede a equação tem a função de tornar positivo o valor
calculado para a velocidade, pois a diferença entre [A]2 e [A]1 é sempre negativa,
uma vez que a concentração de A diminui com o tempo.
No exemplo dado acima, a velocidade média da reação é de
Porém, esse valor da velocidade média não é de grande utilidade, pois a velocidade
da reação varia de acordo com a concentração dos reagentes, e a concentração
varia ao longo da reação. A velocidade instantânea (a velocidade para cada
concentração) não é a mesma ao longo da reação. Pode-se fazer uma analogia
PETROBRAS ABASTECIMENTO 2008 113
QualificAbast
com um atleta, que disputa uma corrida. Ao iniciar a prova, há a arrancada do
atleta, e à medida que o tempo passa, ele adquire uma velocidade máxima. A
partir daí, sua velocidade começa a diminuir até ele parar. A velocidade média
do corredor é dada pela razão entre a distância percorrida e o tempo gasto para
se percorrer o trajeto, porém a velocidade dele não foi a mesma em cada ponto
do percurso.
Ao se montar um gráfico de [A] em função do tempo, conforme o representado
na Figura 1, podemos obter a velocidade instantânea, se determinarmos quanto
vale a inclinação da reta tangente à curva naquele ponto específico.
Figura 1 – Cálculo da velocidade instantânea de uma reação
Logo vemos que a inclinação da reta 1 é maior que a inclinação da reta 2. Desse
modo, vemos que a velocidade da reação é maior no início do que quando ela se
aproxima do seu fim, pois a concentração dos reagentes é maior no início do que
próximo ao término da reação.
PETROBRAS ABASTECIMENTO 2008 114
QualificAbast
A Lei Cinética das Reações nos diz que a velocidade de uma reação é diretamente
proporcional às concentrações molares dos reagentes, elevadas a expoentes
determinados experimentalmente. Então, podemos escrever
v = k. [A]x.[B]y.[C]z... (24)
onde x, y, z são expoentes determinados experimentalmente e k é uma constante,
que só depende da temperatura. Mas por que devemos determinar
experimentalmente a velocidade de uma reação?
Porque uma reação pode ocorrer em diversas etapas e muitas vezes ignoramos
essas etapas quando representamos a equação química global de um processo.
Cada etapa da reação é chamada de reação elementar, e chamamos de
mecanismo de reação ao conjunto das reações elementares ou parciais, segundo
as quais a reação se processa. A velocidade de uma reação química é determinada
pela velocidade da etapa mais lenta do mecanismo da reação, a qual é
denominada de “etapa lenta do processo”. Todas as outras reações intermediárias
que ocorrem mais rápido que a reação da etapa lenta não interferem na velocidade
da reação. Assim, apenas as concentrações dos reagentes que participam da
etapa lenta determinam a velocidade da reação.
Vejamos o exemplo da reação abaixo que, quando efetuada a 200oC, ocorre em
duas etapas.
NO2(g) + CO(g) → NO(g) + CO2(g)
1a etapa: 2NO (g) → NO (g) + NO(g) (etapa lenta)
2 3
2a etapa: NO (g) + CO(g) → NO (g) + CO (g) (etapa rápida)
3 2 2
A equação da velocidade para essa reação é dada por
v = k . [NO2 ]2
PETROBRAS ABASTECIMENTO 2008 115
QualificAbast
Apenas a concentração de NO2 determina a velocidade da reação, pois o monóxido
de carbono não participa da etapa lenta.
Assim, a partir da equação de velocidade de uma reação, podemos deduzir a
ordem da reação e a molecularidade. A ordem da reação em relação a um
reagente indica a dependência existente entre a concentração desse reagente e a
velocidade da reação. Logo, na reação exemplificada, a ordem em relação ao
NO 2 é 2 e em relação ao CO é 0. A ordem global da reação corresponde à soma
das ordens em relação a todos os reagentes, e nesse caso também é dois
(2+0=2). A molecularidade indica o número mínimo de partículas reagentes
que precisam colidir para que ocorra cada etapa da reação. No exemplo dado, a
molecularidade é 2, tanto na primeira quanto na segunda etapa.
(b) Influência da temperatura na velocidade de reação
O aumento da temperatura aumenta a velocidade das reações químicas
exotérmicas e endotérmicas, embora favoreça mais intensamente as reações
endotérmicas, pois essas ocorrem com absorção de energia. Observe o gráfico
da Figura 2, que ilustra a variação de energia que ocorre durante uma reação
química exotérmica.
Figura 2 – Energia de ativação
Chamamos de energia de ativação à energia mínima que as moléculas devem
possuir para reagirem ao se chocarem, isto é, para realizarem uma colisão efetiva.
A energia de ativação corresponde à barreira que separa os reagentes do estado
PETROBRAS ABASTECIMENTO 2008 116
QualificAbast
ativado. O aumento da temperatura provoca o aumento da energia cinética das
moléculas e com isso elas “vencem” mais rapidamente essa barreira de energia.
Conseqüentemente, é maior o número de colisões efetivas entre as espécies que
vão reagir, aumentando a velocidade da reação.
(c) Influência do catalisador na velocidade de reação
A velocidade de uma reação química pode ser elevada na presença de um catalisador,
substância adicionada à reação, que não é consumida no processo, mas apenas
aumenta a velocidade da reação. O catalisador é uma substância que age em uma
etapa intermediária do processo, fornecendo um novo mecanismo de reação, o qual
possui uma energia de ativação menor do que o mecanismo sem o catalisador.
Os catalisadores podem ser homogêneos, isto é, podem formar apenas uma fase
com os reagentes, ou podem ser heterogêneos, formando duas ou mais fases distin-
tas. Na reação com um catalisador heterogêneo (geralmente reagente gasoso ou
líquido e catalisador sólido), o catalisador fornece uma superfície sobre a qual os
reagentes podem reagir mais facilmente.
Na catálise heterogênea, a reação começa com a adsorção de uma molécula do
reagente sobre o catalisador, onde os mecanismos de adsorção podem ser físicos
(mais fracos) ou químicos (mais fortes). A quimissorção ocorre principalmente nos
sítios ativos dos catalisadores sólidos. Os sítios ativos correspondem aos locais do
catalisador onde se dá a reação.
Do mesmo modo que existem substâncias que aumentam a velocidade da reação,
existem aquelas que provocam a diminuição da velocidade. Essas substâncias são
chamadas de inibidores. Quando ocorre a inibição de um catalisador pela presença
de uma substância estranha à reação, diz-se que há o envenenamento do catalisador.
Os catalisadores são hoje em dia produtos de grande valor agregado para a indústria,
pois vários processos só são economicamente viáveis em função de sua presença.
PETROBRAS ABASTECIMENTO 2008 117
QualificAbast
[Cálculo estequiométrico
Uma equação química balanceada expressa a quantidade química equivalente
de reagentes e produtos. O cálculo estequiométrico é o cálculo das quantidades
de reagentes e produtos das reações químicas feito com base nas leis das reações.
Desse modo, pode-se calcular a quantidade de produtos formada a partir dos
reagentes ou a quantidade de reagentes necessária para formar determinada
massa de produto, sempre com base na equação química balanceada. Também
se utiliza o cálculo estequiométrico para determinar a eficiência de uma reação e
a pureza das substâncias formadas.
As leis das reações químicas são basicamente as seguintes:
1) Lei de Lavoisier ou Lei da Conservação das Massas: “Na natureza nada se
cria, nada se perde, tudo se transforma”, ou, “Quando uma reação química
ocorre em um ambiente fechado, a massa total antes da transformação é igual à
massa total após a transformação”.
2) Lei de Proust ou Lei das Proporções Constantes: “Uma determinada subs-
tância pura, qualquer que seja sua origem, contém sempre os mesmos elemen-
tos combinados na mesma proporção em massa.”
3) Lei Volumétrica de Gay-Lussac ou Lei das Combinações dos Volumes Gaso-
sos: “Quando medidos nas mesmas condições de temperatura e pressão, os
volumes dos reagentes e produtos gasosos formam uma proporção constante, de
números inteiros e pequenos.”
PETROBRAS ABASTECIMENTO 2008 118
QualificAbast
Com base nas relações expressas nessas três leis e lembrando que
Número de mols = Massa / Massa molar
1mol = 6,02 . 1023
Volume molar de um gás nas CNTP = 22,71L
podemos efetuar inúmeros cálculos estequiométricos.
Vejamos um exemplo de cálculo estequiométrico.
A reação química entre o carbonato de cálcio e o ácido clorídrico segue a seguinte
equação:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Calcule a massa de cloreto de cálcio dissolvido na solução e o volume de gás
carbônico que se forma nas CNTP, a partir de 1kg de CaCO3.
Dados: Massas molares (g/mol): Ca = 40, C = 12, O = 16, Cl = 35,5, H = 1
Cálculo da massa molar de CaCO 3: 40 + 12 + (16 . 3) = 100g/mol.
Cálculo da massa molar de CaCl 2 : 40 + (35,5 . 2) = 111g/mol.
Cálculo da massa de CaCl 2 formada:
100g de CaCO3 formam 111g de CaCl2.
1 000g de CaCO 3 formam xg de CaCl 2.
x = 1 110g = 1,11kg de CaCl2.
Cálculo do volume de CO 2:
100g de CaCO3 formam 22,71L de CO2.
1 000g de CaCO 3 formam yL de CO 2.
y = 227,1L de CO2.
PETROBRAS ABASTECIMENTO 2008 119
QualificAbast
[Equilíbrio químico
Todo sistema busca o seu estado de equilíbrio. O equilíbrio pode ser entre estados
físicos, como o equilíbrio sólido-líquido, líquido-vapor, etc., no qual a quantidade
de moléculas que saem de uma fase é igual à quantidade de moléculas que
entra na outra fase; ou pode ser buscado por uma reação química, na qual
macroscopicamente a reação parece ter terminado, pois a concentração tanto
dos reagentes quanto dos produtos permanece inalterada, porém,
microscopicamente, os reagentes da reação continuam transformando-se em
produtos e os produtos em reagentes.
O equilíbrio químico pode ser classificado em homogêneo e heterogêneo. O
equilíbrio homogêneo é aquele que ocorre em reações nas quais os reagentes e
os produtos se encontram em um sistema homogêneo. O equilíbrio heterogêneo
é aquele que ocorre em reações nas quais os reagentes e os produtos formam
um sistema heterogêneo e, em geral, envolve substâncias sólidas ou gasosas.
(a) Deslocamento do equilíbrio químico
O Princípio de Le Chatelier diz que quando um sistema em equilíbrio é perturbado,
o equilíbrio desloca-se no sentido de minimizar esta perturbação. Desse modo, o
sistema busca uma nova posição de equilíbrio, para a nova situação que foi
imposta pela perturbação. Por exemplo, considere a reação abaixo:
N (g) + 3H (g) 2NH (g)
2 2 3
PETROBRAS ABASTECIMENTO 2008 120
QualificAbast
Supondo que os reagentes tenham sido colocados em um recipiente sob
determinada temperatura, a reação se processa até o equilíbrio ser atingido. A
partir desta situação, as concentrações tanto dos reagentes quanto dos produtos
não se alteram mais.
Influência da variação da concentração
Podemos causar uma “perturbação” desse equilíbrio adicionando uma quantidade
de N2 ao sistema. Desse modo, instantaneamente após a adição do reagente N 2,
a concentração deste aumenta. Porém, o sistema vai buscar uma nova posição
de equilíbrio para minimizar esse aumento da concentração de N2. O que ocorre,
então, é a reação entre o N2 em excesso e uma quantidade de H2 que estava
presente no equilíbrio anterior. Dessa maneira, a quantidade de N 2 colocada a
mais será em parte consumida (não totalmente), a quantidade de H2 que havia
anteriormente será consumida (não totalmente), e a quantidade do produto da
reação (NH3) aumentará. Assim, as concentrações dos reagentes e dos produtos
se alterarão em busca de um novo equilíbrio.
Portanto, quando adicionamos mais reagente a uma reação em equilíbrio, há
tendência em se consumir este reagente em excesso, com formação de mais
produtos, buscando minimizar a perturbação do sistema. Diz-se, então, que o
equilíbrio foi “deslocado para a direita”, que é onde estão representados os produtos
da reação. Quando adicionamos produto a uma reação em equilíbrio, ele é
consumido, aumentando a quantidade dos reagentes. Dizemos, então, que o
equilíbrio foi “deslocado para a esquerda”, isto é, no sentido dos reagentes.
Influência da variação do volume
Quando a reação é homogênea e em fase gasosa, o sistema pode ser perturbado
pelas variações de volume, que, sob temperatura constante, ocasiona uma variação
na pressão do sistema. Desse modo, uma diminuição de volume aumentará a
pressão do sistema, ao passo que o aumento do volume acarreta a diminuição da
pressão. A variação de volume, além de provocar variação da pressão, acarreta a
variação da concentração dos componentes da reação, visto que a concentração
molar é dada pelo número de mols por volume (mol/L).
PETROBRAS ABASTECIMENTO 2008 121
QualificAbast
Como o sistema buscará um novo equilíbrio, buscando minimizar uma variação
de volume causada no sistema?
Voltando ao exemplo da reação anterior, vamos supor que o volume onde se
processa a reação seja diminuído. A maneira de minimizar o conseqüente aumento
de pressão é deslocar o equilíbrio químico no sentido da reação onde o número
de moléculas formadas seja menor. Pelos coeficientes estequiométricos da reação,
vemos que são necessários 4mols de reagentes (1mol de N 2 e 3mols de H 2) para
formar 2mols de produtos (2mols de NH3), ou seja, 2mols de produtos substituem
4mols dos reagentes. Então, o equilíbrio se deslocará para a direita, no sentido
de formação de mais produto (NH3).
A explicação desse fenômeno está no fato de que quantidades iguais de qualquer
gás, sob a mesma pressão e temperatura, ocupam o mesmo volume. Então, se
uma quantidade menor de gás for formada, ou seja, menos mols de gás, o
aumento de pressão é minimizado. Caso o volume da reação fosse aumentado,
a pressão diminuiria. Para minimizar esta redução de pressão, o equilíbrio se
deslocaria no sentido de formação de um maior número de moléculas, que neste
caso seria no sentido da regeneração dos reagentes.
No caso de ser adicionado ao sistema um gás inerte, a pressão aumenta, porém
o volume e conseqüentemente a concentração das substâncias não são alterados.
Desse modo, o equilíbrio não é deslocado em nenhum sentido.
Caso a quantidade de mols dos reagentes seja igual à quantidade de mols dos
produtos formados na reação, o equilíbrio não se desloca diante de uma variação
de volume, pois não há como minimizar a variação da pressão.
Influência da variação da temperatura
Ainda tomando como exemplo a reação de produção de amônia, sabemos que ela
é exotérmica, no sentido de formação de NH3, e endotérmica, no sentido de
formação de N 2 e H2, conforme a variação de entalpia mostrada a seguir.
PETROBRAS ABASTECIMENTO 2008 122
QualificAbast
N (g) + 3H (g) 2NH (g) ΔH = -92,2 kJ
2 2 3
A diminuição da temperatura favorece a reação exotérmica, isto é, desloca o
equilíbrio para formação de amônia. A elevação da temperatura favorece a reação
endotérmica, deslocando o equilíbrio para a formação de nitrogênio e hidrogênio.
(b) Constante de equilíbrio
Dizemos que o equilíbrio químico é atingido quando a concentração das substân-
cias envolvidas na reação não varia mais. Desse modo, é possível calcular uma
constante de equilíbrio para a reação. Considere o seguinte equilíbrio hipotético:
A(aq) + B(aq) C(aq) + D(aq)
Para esta reação, a constante de equilíbrio é definida como:
Esta constante nos mostra quão deslocado é o equilíbrio da reação para uma
dada temperatura. Se a constante for um valor maior que 1, a reação é deslocada
no sentido dos produtos, pois o produto da concentração destes é maior. Se o
valor for menor que 1, a reação é deslocada no sentido dos reagentes, pois o
produto da concentração destes é maior nesta situação.
Para a reação
a A(aq) + b B(aq) c C(aq) + d D(aq)
temos a seguinte expressão para a constante de equilíbrio:
(26)
As letras minúsculas representam os coeficientes estequiométricos da equação.
PETROBRAS ABASTECIMENTO 2008 123
QualificAbast
No caso de termos um equilíbrio heterogêneo, em que uma das substâncias está
no estado sólido ou eventualmente no estado líquido (não confundir estado líquido
com solução aquosa), a concentração da substância não entra como uma variável
na equação do cálculo da constante de equilíbrio. Isto ocorre porque a concentra-
ção da substância que se encontra em uma fase distinta da fase dos demais
participantes do equilíbrio pode ser considerada praticamente invariável, podendo
ser incluída na própria constante de equilíbrio. Desse modo, para a reação:
a A(g) + b B(s) c C(g)
a constante de equilíbrio é dada por:
(c) Equilíbrio iônico em solução aquosa
Considere as seguintes reações:
HA(aq) H+(aq) + A-(aq)
BOH(aq) B+(aq) + OH-(aq)
A primeira é a ionização de um ácido e a segunda a dissociação de uma base. As
constantes para estes equilíbrios são chamadas de constante de dissociação e
calculadas da seguinte maneira:
PETROBRAS ABASTECIMENTO 2008 124
QualificAbast
Essas constantes indicam a força do ácido ou da base, pois quanto maior for a
constante, mais dissociada encontra-se a substância.
(c.1) Produto iônico da água
A água é um eletrólito muito fraco que se dissocia em quantidades iguais de íons
H+ e OH-.
H2 O H+(aq) + OH-(aq)
A constante de equilíbrio para a dissociação da água é:
O valor dessa constante é extremamente baixo, mostrando que a água quase não
se dissocia. Podemos considerar que a concentração de H2O é praticamente
constante, de modo que pode ser incluída no valor de K. Assim,
Considerando que um litro de água contém 55,4mols de água e substituindo
esse valor na equação da constante de equilíbrio da água, temos que
sendo Kw denominado de produto iônico da água. Como este valor é de 10 -14, e
é sabido que a água se dissocia em quantidades iguais de H+ e OH-, conclui-se
que a concentração de íons H+ e de íons OH- é de 10-7.
PETROBRAS ABASTECIMENTO 2008 125
QualificAbast
(c.2) A escala de pH – potencial hidrogeniônico
O caráter ácido ou básico de soluções aquosas diluídas pode ser determinado
quantitativamente utilizando-se uma escala chamada de pH, que significa
potencial hidrogeniônico. Este conceito é muito importante, pois várias reações
químicas são influenciadas pelo pH da solução reagente.
O pH é definido como o logaritmo do inverso da concentração dos íons H+ de
uma solução. Matematicamente temos:
A água pura apresenta uma concentração de [H+] = 10-7, logo o pH da água é 7.
Analogamente, pode-se determinar também o pOH.
Dessa maneira, temos que:
Conhecendo-se o pH de uma solução, pode-se facilmente calcular o pOH e,
portanto, determinar a concentração de OH-.
As escalas de pH e pOH (ver Figura 1) variam de 0 a 14 e permitem classificar
o caráter ácido ou básico de uma solução. Se a solução aquosa é ácida, significa
PETROBRAS ABASTECIMENTO 2008 126
QualificAbast
que existem mais íons [H+] do que [OH-]. Se a solução é básica, existem mais
[OH-] do que [H+]. Desse modo, soluções ácidas têm pH menor que 7 e soluções
básicas têm pH maior que 7. O mesmo pode ser feito para a escala de pOH.
Então temos que:
Soluções ácidas:
10-7 < [H+] < 1 e 7 > pH > 0
10-7 > [OH+] > 10-14 e 7 < pOH < 14
Soluções básicas:
10-7 > [H+] > 10-14 e 7 < pH < 14
10-7 < [OH+] > 1 e 7 > pOH > 0
Figura 1 – Escalas de pH e pOH
PETROBRAS ABASTECIMENTO 2008 127
QualificAbast
(c.3) Solução tampão
Uma solução tampão tem como função manter constante o pH de uma solução
em relação à adição de quantidades pequenas de ácidos ou bases, mesmo que
sejam fortes, ou seja, uma solução tampão deve apresentar resistência a mudanças
de pH.
Essa solução pode ser constituída por um ácido fraco e um sal solúvel de mesmo
ânion, ou por uma base fraca e um sal solúvel de mesmo cátion.
PETROBRAS ABASTECIMENTO 2008 128
QualificAbast
[Eletroquímica
Existem diversas reações na natureza onde ocorre transferência de elétrons de
uma espécie química para outra. Sendo os elétrons partículas com carga elétrica,
torna-se então possível a interconversão de energia química em energia elétrica
e vice-versa. A área da química que estuda os processos de conversão de energia
química em energia elétrica é a eletroquímica. Com ela, pode-se prever e
quantificar reações de oxirredução, que, de acordo com o que foi estudado
anteriormente, é uma reação que envolve a transferência de elétrons.
Os dispositivos que permitem a interconversão de energia química em elétrica
são chamados de células eletroquímicas. Pode-se observar dois tipos de células
eletroquímicas: as células galvânicas ou pilhas, nas quais a energia química é
convertida em elétrica; e as células eletrolíticas, nas quais a energia elétrica é
transformada em energia química.
(a) Pilhas ou Células Galvânicas
Um objeto que contenha ferro metálico, como, por exemplo, uma esponja de aço,
reage rapidamente ao entrar em contato com uma solução de sulfato de cobre II
(CuSO4), como mostrado na Figura 1. Durante este processo, verificam-se a for-
mação de um sólido marrom-avermelhado sobre a palha de aço, um descoloramento
da solução de sulfato de cobre II e a oxidação (corrosão) do ferro.
PETROBRAS ABASTECIMENTO 2008 129
QualificAbast
Figura 1 – Corrosão do ferro da esponja de aço
O que ocorre para que esses fenômenos aconteçam? A pergunta é facilmente
respondida à luz dos conceitos eletroquímicos.
A palha de aço, composta principalmente de ferro (Fe) na sua forma metálica, e
a solução de sulfato de cobre II, contendo em solução íons Cu2+ e íons SO 2-
4 ,
promovem uma reação de oxirredução. Veja o que acontece:
Cu+2(aq) + 2e-1 → Cuº(s)
O íon Cu+2 se reduz, ganhando dois elétrons e passando a Cuº. Isso explica os
fenômenos observados na palha de aço e na solução. A coloração avermelhada
que surge na palha de aço se deve ao depósito de cobre na forma sólida (Cuº).
Como os íons de cobre saíram da solução, a coloração azul diminuiu de
intensidade, pois são os íons de cobre que causam a coloração azulada.
Porém, como se trata de uma reação de oxirredução, para um elemento ter se
reduzido, deve ter ocorrido a oxidação de outro elemento. E realmente ocorre.
Nesse caso, o ferro que compõe a palha de aço se oxida. Observe a reação
abaixo:
Fe0(s) → Fe+2(aq) + 2e-1
PETROBRAS ABASTECIMENTO 2008 130
QualificAbast
O ferro passa de sua forma metálica e neutra para a forma iônica, liberando
elétrons. O ferro que sai da palha fica em solução na forma de Fe2+.
As duas semi-reações, de redução e de oxidação, levam a reação total que ocorre
no sistema:
Reação de redução Cu+2(aq) + 2e-1 → Cu0(s)
Reação de oxidação Fe0(s) → Fe+2(aq) + 2e-1
Reação global Cu+2(aq) + Fe0(s) → Cu0(s) + Fe+2(aq)
Em uma pilha ocorre exatamente o que aconteceu anteriormente com a palha de
aço e a solução salina. Há uma transferência espontânea de elétrons de um
elemento para outro. No entanto, algumas modificações precisam ser feitas para
que possamos aproveitar essa transferência de elétrons.
Mas o que é, então, uma pilha ou a célula galvânica?
Pilha é um dispositivo que aproveita a transferência espontânea de elétrons de
uma reação de oxirredução e propicia o aparecimento de uma corrente elétrica
através de um condutor, e assim converte energia química em energia elétrica.
Observe a Figura 2, que representa uma pilha:
PETROBRAS ABASTECIMENTO 2008 131
QualificAbast
Figura 2 – Pilha ou célula galvânica de zinco/cobre
Fonte: RUSSEL, 1994.
Do lado esquerdo, existe um eletrodo de zinco mergulhado em uma solução de
sulfato de zinco, e, do lado direito, existe um eletrodo de cobre mergulhado em
uma solução de sulfato de cobre II. A diferença desse sistema para o sistema da
palha de aço mergulhada na solução salina é que, neste caso, os elétrons são
forçados a passar por um fio condutor que liga os dois eletrodos, pois uma placa
porosa (de cerâmica, vidro sinterizado ou outro material) é introduzida, separando
a solução que fornece os íons positivos e o eletrodo que fornece os elétrons.
O que ocorre então? O eletrodo de zinco constitui o anodo, isto é, o pólo negativo,
local onde se dá a oxidação. Então, o zinco metálico se oxida, formando cátions
Zn+2 que passam à solução, e libera um fluxo de elétrons que atravessa o fio
condutor e chega ao eletrodo de cobre (este é o circuito externo da pilha). O
eletrodo de cobre constitui o catodo, isto é, o pólo positivo, local onde se dá a
redução. O catodo, que está em contato com os íons Cu+2 da solução, promove
a redução desses íons, gerando um depósito de Cu0 sobre o eletrodo.
Veja, então, as reações que ocorrem na pilha:
PETROBRAS ABASTECIMENTO 2008 132
QualificAbast
Reação de redução Cu+2(aq) + 2e-1 → Cu0(s)
Reação de oxidação Zn0(s) → Zn+2(aq) + 2 e-1
Reação global Cu+2(aq) + Zn0(s) → C u0(s) + Zn+2(aq)
Dessa maneira, com o passar do tempo, a barra de zinco irá diminuir até ser
completamente corroída, enquanto que a de cobre irá aumentar de tamanho.
Outro fenômeno que ocorre nesta pilha é a migração de ânions sulfato do
compartimento catódico para o anódico, através da parede porosa. Essa corrente
iônica, também chamada de circuito interno da pilha, é necessária para manter
as duas soluções neutras, uma vez que com o passar do tempo aumenta a
quantidade de cargas positivas (Zn+2) no anodo e diminui no catodo.
A passagem de elétrons pelo circuito externo gera corrente elétrica, eletricidade.
Desse modo, energia química foi transformada em energia elétrica, podendo ser
utilizada para os mais diversos fins, como acender uma lâmpada, fazer funcionar
um motor, etc. As pilhas comuns que encontramos no mercado e as baterias de
automóveis são exemplos de células galvânicas.
(b) Potencial-padrão de eletrodo
A tensão de uma pilha é dada pela diferença entre os potenciais do catodo e do
anodo. No entanto, é impossível medir valores absolutos de potenciais elétricos,
como também não podemos medir valores absolutos de altitudes, energias
potenciais, etc. Para contornar esse problema, optou-se por escolher
arbitrariamente um eletrodo-padrão, e atribuir a esse padrão um determinado
valor de potencial. O padrão escolhido, por acordo internacional, foi o eletrodo
padrão de hidrogênio, ao qual foi atribuído o potencial zero (Eº = 0V), em condi-
ções-padrão [temperatura de 25ºC, pressão de H 2 de 1atm e concentração de
H+(aq) de 1mol/L]. A partir daí foram determinados os potenciais-padrão dos
PETROBRAS ABASTECIMENTO 2008 133
QualificAbast
demais eletrodos, relativamente ao eletrodo-padrão de hidrogênio. Para isso,
recomenda-se confeccionar uma célula-padrão. A temperatura deve ser fixada a
25ºC, os eletrodos devem ser feitos com metais puros e as soluções devem
sempre possuir a concentração de 1mol/L. Caso um dos componentes seja gasoso,
a pressão do gás deve ser fixada em 1atm. O eletrodo de hidrogênio deve ser
disposto como o anodo da pilha, e o eletrodo em estudo deve ser o catodo. Desse
modo, o potencial é lido diretamente no voltímetro. A Tabela 1 relaciona os
valores de alguns potenciais-padrão de eletrodo.
Tabela 1 – Potenciais-padrão de eletrodo
Reação de redução Potencial-padrão E0 (V)
Mg2+ + 2e- → Mg -2,36
Cr3+ + 3e- → Cr -0,74
Fe2+ + 2e- → Fe -0,44
2H+ + 2e- → H2 0,00
Cu2+ + 2e- → Cu 0,34
Ag+ + 1e- → Ag 0,80
F2 + 2e - → 2F- 2,87
Observe que os potenciais tabelados são para as reações de redução. Se uma
destas reações for utilizada no sentido inverso, isto é, como reação de oxidação,
deve-se inverter o sinal do potencial. Por exemplo, a equação-padrão de oxidação
do magnésio e o seu potencial podem ser obtidos invertendo-se a equação de
redução dada na tabela, como mostrado abaixo:
Reação de redução: Mg+2(aq) + 2e-1 → Mg0(s) E0 = -2,36V
Reação de oxidação: Mg0(s) → Mg+2(aq) + 2e-1 E0 = +2,36V
PETROBRAS ABASTECIMENTO 2008 134
QualificAbast
A tabela de potenciais-padrão de redução pode ser utilizada tanto para prever a
diferença de potencial (ddp) existente entre dois eletrodos como para determinar
qual deles será o catodo e qual será o anodo. Dado dois eletrodos, também
chamados de pares redox (pois existe sempre em cada eletrodo a interconversão
entre duas espécies que diferem entre si pela quantidade de elétrons, por exemplo
Fe+2/Fe0), irá sofrer redução aquele cujo potencial de redução for maior. Por
exemplo, confecciona-se uma pilha com os pares Cu+2/Cu0 e F2 0/F-. O cobre, que
possui o menor potencial de redução, será o anodo (e, portanto, será oxidado),
enquanto que o flúor será o catodo (e, portanto, será reduzido). Já o potencial ou
tensão desta pilha será dado pela soma do potencial de redução do flúor e do
potencial de oxidação do cobre, ou, alternativamente, pela diferença entre os
potenciais de redução do flúor e do cobre (sempre o do catodo menos o do
anodo). Deve-se salientar que para que haja produção espontânea de corrente
elétrica, o valor da ddp deverá ser sempre positivo. Observe o exemplo abaixo.
Dados os pares redox Mg+2/Mg0 e F 20/F-, escreva as semi-reações e a
reação global da pilha e determine a ddp por ela gerada
Primeiro deve-se determinar qual o papel de cada par redox na pilha. Para isso,
é necessário comparar os seus potenciais de redução, dados na Tabela 1.
Mg+2 + 2e- → Mg0 E0 = -2,36V
F20 + 2e- → 2F- E0 = +2,87V
O magnésio possui o menor potencial de redução, portanto será o anodo da
pilha. Já o flúor será o catodo. Logo, as equações para esta pilha são dadas por:
Reação de oxidação Mg0(s) → Mg+2(aq) + 2e-1 E0 = +2,36V
Reação de redução F20(g) + 2e-1 → 2F-1(aq) E0 = +2,87V
Reação global Mg0(s) + F 20(g) → Mg+2(aq) + 2F-1(aq) ΔE0=+5,23V
PETROBRAS ABASTECIMENTO 2008 135
QualificAbast
(c) Células eletrolíticas
Até agora vimos que uma reação química pode fornecer corrente elétrica devido
ao fluxo espontâneo de elétrons do elemento com maior potencial de redução
para o elemento com menor potencial de redução. Porém, sabe-se que esse
processo pode ser cessado e até revertido se colocarmos em sentido contrário
uma fonte de corrente contínua ou uma fonte de tensão de mesma intensidade
que a corrente ou a ddp gerada pela reação. O fluxo de elétrons pararia e não
mais haveria reação de oxirredução. Se a intensidade da fonte fosse maior, o
fluxo de elétrons seria invertido. Com isto, o anodo que normalmente é corroído
no processo espontâneo pode ser regenerado, e o depósito de metal no catodo
pode ser dissolvido, retornando na forma de íons para a solução. Sempre que
uma reação de oxirredução for forçada no sentido inverso, aplicando-se uma
corrente elétrica ou ddp, diz-se que ocorreu uma eletrólise e temos uma célula
eletrolítica. A reação em uma célula eletrolítica não é espontânea.
Teoricamente, toda célula galvânica poderia ser transformada em célula eletrolítica.
Porém, devido a restrições cinéticas e termodinâmicas, algumas células não são
convertidas. Isto explica por que nem todas as pilhas podem ser recarregadas,
aplicando-se uma ddp contrária e restaurando-se o eletrodo que foi corroído.
PETROBRAS ABASTECIMENTO 2008 136
QualificAbast
[Alguns elementos importantes e seus
compostos
(a) Hidrogênio
É o terceiro elemento mais abundante em número de átomos (atrás do oxigênio
e do silício) e o nono em massa na crosta terrestre, incluindo a litosfera, hidrosfera
e atmosfera. Grande parte do hidrogênio encontra-se combinada com o oxigênio,
formando a água.
O hidrogênio ocorre naturalmente como uma mistura de três isótopos, que recebem
nomes especiais: prótio (1H 1), com abundância de 99,985%; deutério (1H 2), com
abundância de 0,015%; e trítio ( 1H3), com abundância de 10-7%.
O hidrogênio forma a substância simples H 2, que é um gás inflamável e explosivo,
muito menos denso que o ar, e que ascende rapidamente quando liberado para
a atmosfera.
O hidrogênio (H 2) é obtido industrialmente:
· como subproduto da eletrólise de soluções aquosas de NaCl.
2NaCl + 2H2O → 2NaOH + H2 + Cl2
· pela reação entre carbono e vapor d’água a altas temperaturas. Esta é a princi-
pal reação na síntese do gás de água (mistura de CO e H2), um tipo de gás
combustível com aplicação bastante restrita hoje em dia.
PETROBRAS ABASTECIMENTO 2008 137
QualificAbast
C + HO → CO + H
2 2
CO + H O → CO + H
2 2 2
· a partir de compostos orgânicos na indústria petroquímica.
C2H6 → C2H4 + H2
Na maioria dos compostos, o hidrogênio possui estado de oxidação +1, onde se
encontra covalentemente ligado aos outros elementos, como no HF, HCl, H2O,
NH , NaOH, H SO , NaHCO , C H , etc. Quando o hidrogênio está ligado a um
3 2 4 3 6 6
elemento mais eletropositivo, assume estado de oxidação -1, formando hidretos,
como, por exemplo, NaH, LiH, SiH , etc.
4
(b) Oxigênio
É o elemento mais abundante na crosta terrestre, com uma ocorrência da ordem
de 53%, em número de átomos, e 49% em massa. Aparece na forma livre como
O2, e também combinado com silício e alumínio, formando várias rochas e
minerais.
O oxigênio ocorre como uma mistura de três isótopos estáveis: 8O16 (com
abundância de 99,8%), 8O17 e 8O18.
O oxigênio possui duas formas alotrópicas estáveis: o oxigênio atmosférico
(O2) e o ozônio (O3). Uma terceira forma alotrópica foi detectada no
oxigênio líquido como O4. O ozônio pode ser obtido do O2, através de
reação altamente endotérmica. Na atmosfera superior, a ação da luz
ultravioleta fornece a energia necessária para que esta reação ocorra:
PETROBRAS ABASTECIMENTO 2008 138
QualificAbast
3O2 → 2O 3 ΔH = 286kJ
O ozônio produzido em uma altitude de aproximadamente 30km absorve a
radiação ultravioleta com comprimento de onda superior a 350nm. O ozônio é
um gás tóxico e causa irritação quando inalado.
O oxigênio pode ser obtido da eletrólise da água, mas apenas quando se exige
uma pureza muito elevada, devido ao alto custo do processo. Industrialmente, o
oxigênio é obtido da destilação fracionada do ar liquefeito, quando é separado do
nitrogênio e de outros compostos como CO 2 e gases nobres.
Na maioria dos compostos o oxigênio apresenta número de oxidação -2. O oxigênio
forma óxidos iônicos, quando ligado a metais altamente eletropositivos, como,
por exemplo, o Na2O, CaO e K2O, e óxidos moleculares covalentes, quando
ligado a não-metais, como o CO, CO2, SO3 e NO2. Pode apresentar também
número de oxidação -1, nos peróxidos, e -1/2, nos superóxidos.
(c) Flúor
Ocorre em minerais como a fluorita (CaF2), criolita (3NaF.AlF3), fluorapatita
[Ca5F(PO4)3], entre outros. O flúor elementar não pode ser obtido pela oxidação
química de fluoretos, pois o flúor é o mais forte agente oxidante. Desse modo, o
único meio de se obter o elemento na forma elementar é através de métodos
eletrolíticos.
O poder extremamente oxidante faz com que ele reaja de forma vigorosa com a
maioria das substâncias. Pode ser armazenado em recipientes metálicos a baixas
pressões, onde forma uma camada de fluoreto na super fície do metal
extremamente estável, que acaba protegendo o metal de novos ataques. Pode
ser estocado em recipientes de vidro, desde que não haja a presença de HF.
PETROBRAS ABASTECIMENTO 2008 139
QualificAbast
O flúor é utilizado para prevenir a cárie dentária. Os íons fluoretos presentes na
água e em cremes dentais tendem a trocar o grupamento OH- presente na
hidroxiapatita, elemento constituinte do esmalte dentário [Ca5OH(PO4)3], para
convertê-la em fluorapatita [Ca F(PO ) ], que é um composto que se dissolve
5 4 3
muito mais lentamente em ambientes ácidos, como o interior da boca.
(d) Cloro
O cloro livre (Cl2) encontra-se na forma gasosa, possui uma cor amarelo-esverdeada
e é tóxico. Na natureza, encontra-se combinado na forma de cloretos, como nos
minerais halita (NaCl) e silvita (KCl), em depósitos subterrâneos e nos oceanos.
O cloro, em certos compostos, como NaClO e Ca(ClO) 2, possui poder germicida,
sendo utilizado na purificação da água. Possui também características alvejantes.
A maior parte do cloro industrial é preparada industrialmente pela eletrólise de
solução de NaCl, fornecendo hidróxido de sódio e hidrogênio como subprodutos.
Nos cloretos, o cloro apresenta estado de oxidação -1. Podem ser iônicos, como
o NaCl, KCl, CaCl2, ou covalentes, como o HCl, CCl4, etc. Dentre esses, o HCl é
o de maior importância industrial. É utilizado em larga escala nas indústrias
químicas, metalúrgicas, de alimentos e de petróleo. Em geral, é obtido
industrialmente pelo aquecimento de hidrogênio e cloro, oriundos da eletrólise
de uma solução aquosa de NaCl.
Forma uma série de óxidos, todos potencialmente explosivos, como o Cl2O, Cl2O3,
ClO , etc. Dentre estes, o dióxido de cloro (ClO ) é o mais importante
2 2
industrialmente, pois é um poderoso agente oxidante, usado como alvejante
para a polpa de papel (o processo de alvejamento consiste na oxidação de
compostos orgânicos coloridos formando compostos incolores ou menos coloridos).
PETROBRAS ABASTECIMENTO 2008 140
QualificAbast
(e) Iodo
O iodo na forma livre (I2 ) é um sólido cinza-escuro, com brilho semimetálico.
Apresenta alta pressão de sublimação na temperatura ambiente, desprende um
vapor de cor violeta-escura e seu odor pode ser facilmente sentido. O iodo ocorre
naturalmente como íons iodeto nos oceanos, e especialmente em certos
organismos marinhos que o concentram. Aparece também como iodato de sódio,
misturado com nitrato de sódio, em depósitos de salitre do Chile.
O iodo é usado na fabricação de remédios, corantes, desinfetantes, em fotografia
e em química analítica. O pentóxido de diiodo (I O ) é um agente oxidante
2 5
empregado na análise quantitativa de CO.
(f) Bromo
No estado livre, é um líquido pesado de cor castanho-avermelhada, com alta
pressão de vapor à temperatura ambiente. É parcialmente solúvel em água e
deve ser manuseado com cuidado, pois é muito tóxico. Não ocorre livre na
natureza; mas na forma de brometos, ocorre como KBr, NaBr e MgBr 2.
O bromo é utilizado na preparação de corantes, medicamentos, desinfetantes,
agentes antifogo, na indústria fotográfica, etc.
(g) Enxofre
Encontra-se largamente distribuído na crosta terrestre, onde é encontrado em
leitos subterrâneos, como enxofre livre, com pureza de 99,8%. É também
encontrado combinado em minérios, como a pirita (FeS2), e no petróleo e gás
natural, principalmente na forma de H 2S. O enxofre apresenta várias formas
alotrópicas. À temperatura ambiente, é um sólido amarelo constituído de cristais
PETROBRAS ABASTECIMENTO 2008 141
QualificAbast
ortorrômbicos. Quando aquecido lentamente, o enxofre passa à forma monoclínica.
Quando o enxofre líquido a 350°C é resfriado subitamente, forma-se uma
substância elástica, chamada de enxofre plástico ou amorfo.
O enxofre é uma das matérias-primas básicas da indústria. É usado na fabricação
de ácido sulfúrico, de sulfeto de carbono, na vulcanização da borracha, no bran-
queamento de polpa de madeira, na fabricação de pólvora, fogos de artifício, etc.
Dentre os compostos de enxofre destacam-se os sulfetos, que são compostos
binários onde o enxofre apresenta número de oxidação -2, como, por exemplo, o
sulfeto de hidrogênio (H2S) e o sulfeto de sódio (Na2S).
A solubilidade dos sulfetos é muito variável. O sulfeto de sódio é altamente
solúvel em água, enquanto o sulfeto de platina PtS é praticamente insolúvel.
Os sulfetos metálicos são produzidos a partir do sulfeto de hidrogênio (H2 S), um
gás extremamente venenoso, com cheiro muito ativo de “ovo podre”, que faz
com que seu odor possa ser detectado em níveis ainda não perigosos para saúde.
O dióxido de enxofre (SO 2) é produzido pela combustão do enxofre. O SO 2 é um
gás incolor que se condensa a aproximadamente 10°C sob 1atm. É tóxico e
possui odor irritante. É utilizado industrialmente na produção de ácido sulfúrico.
O ácido sulfúrico é um dos compostos mais importantes da indústria e tem sido
utilizado como um dos indicadores de desenvolvimento industrial de um país.
Quase todo H2SO4 é produzido hoje em dia através do processo de contato:
· o enxofre na forma livre e sólida é fundido e posteriormente filtrado para a
remoção de impurezas (traços de cinzas);
· o enxofre é queimado para a conversão em SO 2;
· o SO2 é oxidado cataliticamente a SO3;
· o SO3 é dissolvido em água para se obter a solução de ácido sulfúrico na con-
centração desejada.
PETROBRAS ABASTECIMENTO 2008 142
QualificAbast
As reações são as seguintes:
S + O2 → SO 2
V2O5
SO2 + O2 → SO3
SO3 + H 2O → H2SO4
O SO3 pode ser transformado em H2SO4 através da reação com água. Porém,
esta reação é lenta. Então, industrialmente, no processo de contato, faz-se a
solubilização de SO3 em H2SO4, ocorrendo a formação de ácido pirossulfúrico,
que ao ser dissolvido em água gera o ácido sulfúrico, como descrito a seguir:
SO3 + H2SO4 → H2S2O7
H2S2O7 + H2O → 2H2SO4
(h) Nitrogênio
Na forma livre como N2 é o principal constituinte do ar. Os compostos inorgânicos
de nitrogênio não são muito encontrados como minerais devido à sua alta
solubilidade. Está presente em inúmeros compostos orgânicos, como proteínas e
aminoácidos. O nitrogênio atmosférico é convertido em nitrogênio orgânico por
bactérias presentes no solo e em algumas raízes.
Industrialmente o N2 é produzido pela destilação fracionada do ar atmosférico.
Uma das substâncias químicas mais importantes produzidas a partir de nitrogê-
nio é a amônia, utilizada em sistemas de refrigeração, na indústria de papel, na
fabricação de ácido nítrico, explosivos e propelentes. É produzida pelo processo
Haber-Bosch, no qual o N2 reage com H2 sob altíssimas pressões (de 500 a
1000atm) e altas temperaturas (da ordem de 400°C-500°C), na presença de catalisadores.
PETROBRAS ABASTECIMENTO 2008 143
QualificAbast
(i) Fósforo
Na natureza, o fósforo não ocorre na forma livre, sendo a maior parte encontrada
em depósitos de rochas de fosfato de cálcio [Ca (PO ) ] e apatita [Ca F(PO ) ].
3 4 2 5 4 3
O fósforo elementar é obtido industrialmente pelo aquecimento de minerais de
fósforo com carbono e dióxido de silício em fornos elétricos.
2 Ca (PO ) + 6 SiO + 10 C → P + 6 CaSiO + 10 CO
3 4 2 2 4 3
O fósforo pode existir no mínimo em seis formas alotrópicas, porém três delas
são mais comuns: o fósforo branco, que é uma substância bastante reativa e
venenosa; o fósforo vermelho, menos reativo e que pode ser guardado em contato
com o ar; e o fósforo preto.
(j) Alumínio
O alumínio é o terceiro elemento em abundância na litosfera, sendo que a maior
parte ocorre na forma de aluminossilicatos, como argila, mica e feldspato. O
principal minério de alumínio é a bauxita, que é formada basicamente por óxido
de alumínio hidratado (Al 2O 3 .2H 2O). O alumínio metálico é preparado
eletroliticamente pelo processo Hall, a partir da alumina contida na bauxita.
O alumínio é um metal extremamente versátil. Ele pode ser enrolado, prensado,
moldado, curvado e extrusado, dando origem a várias formas. Possui baixa
densidade, o que lhe confere várias aplicações, como, por exemplo, a construção
de aeronaves. O alumínio puro é muito mole para ser utilizado em estrutura, mas
pode ser incorporado em ligas. É excelente condutor elétrico, competindo com o cobre.
PETROBRAS ABASTECIMENTO 2008 144
QualificAbast
(l) Ferro
É o metal de maior uso, sendo a crosta terrestre constituída por aproximadamente
5% deste metal. É de fácil obtenção a partir de seus minerais, como a hematita
(Fe2O3), limonita (Fe2O3.H2O), magnetita (Fe3O4) e pirita (FeS2).
O processo siderúrgico começa pela produção de ferro-gusa (liga de ferro com
2% a 5% de C e impurezas de Si, P e Mn) em altos-fornos. Após fundir novamente
o ferro, estas impurezas são oxidadas pelo ar e removidas, fornecendo o ferro
fundido, que, de acordo com o percentual de carbono, é classificado com relação
à dureza e à resistência. O ferro é misturado com diversos materiais para a
formação de diversos tipos de aços-ligas.
(m) Cobre
Quando puro, é bastante maleável e dúctil, ótimo condutor de calor e excelente
condutor de eletricidade, sendo superado apenas pela prata. Os principais minérios
de cobre são a calcosita (Cu2S), a cuprita (Cu2O), a calcopirita (CuS.FeS) e a
malaquita [CuCO .Cu(OH) ].
3 2
(n) Cromo
É um metal branco-prateado, resistente à corrosão, muito duro e um pouco frágil
quando puro. É usado em ligas de aço e na galvanização de ferro e outros metais.
Bastante utilizado em curtumes. Os seus compostos, onde o cromo encontra-se
com diferentes números de oxidação, encontram inúmeras aplicações industriais.
PETROBRAS ABASTECIMENTO 2008 145
QualificAbast
(o) Vanádio
O vanádio é um metal muito duro e que apresenta grande resistência mecânica
à corrosão. É raramente produzido na forma pura, sendo geralmente usado em
ligas com ferro, denominadas ferrovanádio. O vanádio confere aos aços aumento
de resistência e ductibilidade.
(p) Titânio
É um metal branco-prateado, bem resistente à corrosão, excepcionalmente duro,
e que apresenta alta resistência e baixa densidade. É muito usado na construção
de peças de aeronaves.
PETROBRAS ABASTECIMENTO 2008 146
QualificAbast
[Referências bibliográficas
ABREU, P. L.; MARTINEZ, J. A. Gás Natural – o combustível do novo milênio.
Porto Alegre: Plural Comunicação. 1999.
BRASIL, N. I. Introdução à Engenharia Química. Rio de Janeiro: Interciência.
1999.
BUENO, W.; BOODTS, J. F. C.; DeGreve. L.; LEONE, A. L. Química Geral. São
Paulo: McGraw-Hill do Brasil. 1978.
FARAH, M. A. Caracterização do Petróleo e seus Produtos – Par te 1
Combustíveis. Rio de Janeiro: Petrobras. 1985.
FOUST, A. S.; WENZEL, L. A.; CLUMP, C. W.; MAUS, L.; ANDERSEN, L. B.
Princípios das Operações Unitárias. Rio de Janeiro: LTC. 1982.
NEIVA, J. Conheça o Petróleo. Rio de Janeiro: Expressão e Cultura. 1993.
RUSSEL, J. B. Química Geral. São Paulo: Makron Books do Brasil. 1994.
SARDELLA, A.; MATEUS. E. Curso de Química – Química Geral. São Paulo:
Editora Ática. 1991.
SHREVE, R. N.; BRINK Jr., J. A. Indústrias de Processos Químicos. Rio de
Janeiro: Guanabara Koogan. 1997.
SOLOMONS, G.; FRYHLE, C. Química Orgânica. Rio de Janeiro: LTC. 2001.
PETROBRAS ABASTECIMENTO 2008 147
QualificAbast
[Anexo A
Tabela de Cátions Univalentes
(possuem uma única valência)
(1+) (2+) (3+)
Monovalentes Bivalentes Trivalentes
H O1+ hidrônio Be2+ berílio Al3+ alumínio
3
NH 1+
amônio Mg2+ magnésio Bi3+ bismuto
4
Li1+ lítio Ca2+ cálcio
Na1+ sódio Sr2+ estrôncio
K1+ potássio Ba2+ bário
Rb1+ rubídio Ra2+ rádio
Cs1+ césio Zn2+ zinco
Ag1+ prata Cd2+ cádmio
PETROBRAS ABASTECIMENTO 2008 148
QualificAbast
Tabela de Cátions Polivalentes
(possuem mais de uma valência)
Monovalente(1+) Bivalente(2+) Trivalente(3+) Tetravalente(4+) Pentavalente(+5)
Cu
1+ Cu2+ As
3+
Sn
4+
As
5+
cuproso cúprico arsenioso estânico arsênico
Hg Hg Sb 3+ Pb 4+ Sb 5+
2 2+ 2+
mercuroso mercúrico antimonioso plúmbico antimônico
1+ 2+ 3+ 4+
Au Cr Au Mn
auroso cromoso áurico mangânico
2+ 3+ 4+
Fe Cr Pt
ferroso crômico platínico
2+ 3+ 4+
Co Fe Ti
cobaltoso férrico titânico
2+ 3+
Ni Co
niqueloso cobáltico
2+ 3+
Sn Ni
estanoso niquélico
2+ 3+
Pb Mn
plumboso manganês III
2+
Mn
manganoso
2+
Pt
platinoso
2+
Ti
titanoso
PETROBRAS ABASTECIMENTO 2008 149
QualificAbast
Tabela de Ânions Monovalentes
Dos halogênios Do nitrogênio Metais de transição
1–
F fluoreto NO 2
1–
nitrito CrO21– cromito
Cl1– cloreto NO31– nitrato MnO41– permanganato
ClO 1– hipoclorito NH21– amideto FeO21– ferrito
ClO 21– clorito AuCl41– cloroaurato
ClO31– clorato Do fósforo
ClO41– perclorato PO31– metafosfato Outros
Br1– brometo H2PO21– hipofosfito AlO2 1– aluminato
BrO 1– hipobromito H2PO41 diidrogenofosfato AsO21– metarsenito
BrO21– bromito SbO21– metantimonito
BrO31– bromato Do carbono BiO31– bismutato
BrO 41–perbromato CN1– cianeto H1– hidreto
1–
I iodeto NC1– isocianeto OH1– hidróxido
IO1– hipoiodito OCN1– cianato BO 21– metaborato
IO2 1– iodito NCO1– isocianato BF41– fluorborato
1–
IO 3
iodato ONC1– fulminato
IO41– periodato SNC1– tiocianato
HCO31– monoidrogeno-
carbonato
Do enxofre CHO21– formiato
HS1– monoidrogenos-
sulfeto C2H3O1– acetato
HSO31– monoidrogenos-
sulfito
HSO41– monoidrogenos-
sulfato
PETROBRAS ABASTECIMENTO 2008 150
QualificAbast
Tabela de Ânions Bivalentes
Do oxigênio Do fósforo PtCl62– hexacloro-
HPO32– fosfito platinato
O2– óxido
O22– peróxido HPO42– monoidrogenofosfato Outros
O42– superóxido BeO22– berilato
B4O7 2– tetraborato
Do enxofre Do carbono SiO 32– metassilicato
S2– sulfeto C22– carbeto SiF62– fluorsilicato
SO32– sulfito CO32– carbonato SnO 22– estanito
SO42– sulfato C2O42– oxalato SnO 32– estanato
S2O32– tiossulfato PbO22– plumbito
S2O42– hipossulfito Metais de transição PbO32– plumbato
S2O52– pirossulfito CrO4 2– (orto)cromato Se2– seleneto
S2O62– hipossulfato Cr 2O 72– dicromato SeO32– selenito
S2O72– pirossulfato MoO42– molibdato SeO42– selenato
S2O82– peroxodissulfato WO4 2– tungstato Te2– telureto
S4O62– tetrationato MnO32– manganito TeO3 2– telurito
MnO42– manganato TeO4 2– telurato
ZnO2 2– zincato
PETROBRAS ABASTECIMENTO 2008 151
QualificAbast
Tabela de Ânions Trivalentes
Do nitrogênio Outros
N 3–
nitreto BO33– (orto)borato
AsO33– arsenito
AsO43– (orto)arsenato
Do fósforo SbO33– antimonito
P3– fosfeto SbO43– (orto)antimoniato
PO4 3–(orto)fosfato
Dos metais de transição
[Fe(CN)6] 3– ferricianeto
Tabela de Ânions Tetravalentes
Do fósforo Outros
P2O 6
4–
hipofosfato SiO4 4 – (orto)silicato
P2O74– pirofosfato As2 O7 4– piroarsenato
Sb 2O 74 – piroantimoniato
Dos metais de transição
[Fe(CN)6]4 – ferrocianeto
PETROBRAS ABASTECIMENTO 2008 152
QualificAbast
[Anexo B
PETROBRAS ABASTECIMENTO 2008 153
QualificAbast
Você também pode gostar
- PQI-P1 PQI P1 MergedDocumento8 páginasPQI-P1 PQI P1 MergedIsabela CoutinhoAinda não há avaliações
- Espectrometria de Absorção AtômicaDocumento30 páginasEspectrometria de Absorção AtômicaElmar Damasceno Damasceno Júnior100% (1)
- Lista II (Princípios de Equilíbrios Químicos) PDFDocumento14 páginasLista II (Princípios de Equilíbrios Químicos) PDFAnonymous QMpWb7Vc3X0% (1)
- Lei de Boyle e Lei de CharlesDocumento4 páginasLei de Boyle e Lei de Charlescardoso_cb7922Ainda não há avaliações
- Lista de Exercícios - Conceitos Fundamentais - Química (Prof. PC - PEQ)Documento5 páginasLista de Exercícios - Conceitos Fundamentais - Química (Prof. PC - PEQ)Cassio Casteli50% (2)
- Atividade Atomo 9 AnoDocumento3 páginasAtividade Atomo 9 AnoLilian Meire Liberato100% (1)
- Funcoes Inorganic As Ita ImeDocumento3 páginasFuncoes Inorganic As Ita ImeleandrosepulvedaAinda não há avaliações
- Manual para EmbalagensDocumento29 páginasManual para EmbalagensjefersonjajAinda não há avaliações
- Análise Da Qualidade Do Gasóleo Comercializado No Município Da Baía-FartaDocumento86 páginasAnálise Da Qualidade Do Gasóleo Comercializado No Município Da Baía-FartaManuel Januário100% (1)
- NBR 12090 - 91 (MB-3427) - Chuveiros Elétricos - Determinação Da Corrente de Fuga - 4pagDocumento4 páginasNBR 12090 - 91 (MB-3427) - Chuveiros Elétricos - Determinação Da Corrente de Fuga - 4pagClaudio LorenzoniAinda não há avaliações
- Lista de Comandos Do AutoCADDocumento9 páginasLista de Comandos Do AutoCADaline123alineAinda não há avaliações
- LubrificantesDocumento35 páginasLubrificanteswilliamcs09Ainda não há avaliações
- Química Tonoscopia, Ebulioscopia, CriosDocumento2 páginasQuímica Tonoscopia, Ebulioscopia, CriosQuimica Passei100% (1)
- Ocorrência de Reações de Dupla TrocaDocumento23 páginasOcorrência de Reações de Dupla TrocaGleisonAinda não há avaliações
- Aula 6 - Eficiencia CromatograficaDocumento4 páginasAula 6 - Eficiencia CromatograficaTalles BarcelosAinda não há avaliações
- Dessalgação Do Petróleo ResumoDocumento10 páginasDessalgação Do Petróleo ResumoFelipe Abreu de Jesus100% (2)
- Espectroanalitica - Absorcao Atomica - PpsDocumento29 páginasEspectroanalitica - Absorcao Atomica - PpsLuís Eduardo BernardesAinda não há avaliações
- Catalogo Condumax 2017 - BAIXADocumento104 páginasCatalogo Condumax 2017 - BAIXArcosta21Ainda não há avaliações
- Apostila de CAD - Solid Edge V20 - Prof. Samuel DiasDocumento178 páginasApostila de CAD - Solid Edge V20 - Prof. Samuel DiasisaquesantosAinda não há avaliações
- Apostila de CAD - Solid Edge V20 - Prof. Samuel DiasDocumento273 páginasApostila de CAD - Solid Edge V20 - Prof. Samuel DiasSidney M. Silva100% (1)
- Relatório CementaçãoDocumento13 páginasRelatório CementaçãoPaulo Mirabelli100% (1)
- Análises de Petróleo e DerivadosDocumento37 páginasAnálises de Petróleo e DerivadosRafael TavaresAinda não há avaliações
- Rel. Destilação Simples e FracionadaDocumento11 páginasRel. Destilação Simples e FracionadaMaisa Amaral100% (1)
- Tratamentos Convencionais de DerivadosDocumento44 páginasTratamentos Convencionais de DerivadosAdilson J. de AssisAinda não há avaliações
- Fisica Basica C-II 2edicaoDocumento186 páginasFisica Basica C-II 2edicaofjnazareth100% (1)
- Paradigmas e Linguagem PythonDocumento61 páginasParadigmas e Linguagem PythonGilberto Santos100% (1)
- Química - Pré-Vestibular Impacto - Número de OxidaçãoDocumento2 páginasQuímica - Pré-Vestibular Impacto - Número de OxidaçãoQuímica Qui100% (2)
- Aula Refino Do PetroleoDocumento250 páginasAula Refino Do PetroleojnfjjuniorAinda não há avaliações
- Destilação A VácuoDocumento4 páginasDestilação A VácuoPedro Augusto C. Dickfeldt100% (1)
- Lista - Exercícios 2 - CTM - Ensino RemotoDocumento6 páginasLista - Exercícios 2 - CTM - Ensino RemotoalisoAinda não há avaliações
- Apostila Solid Edge ST3 UNIPDocumento87 páginasApostila Solid Edge ST3 UNIPSergio SaitoAinda não há avaliações
- Determinação Da Massa MolarDocumento6 páginasDeterminação Da Massa MolarHenriquekalelAinda não há avaliações
- Aula Conservação Massa (Balanço Global)Documento58 páginasAula Conservação Massa (Balanço Global)Francisco de Assis Bertini MoraesAinda não há avaliações
- Estudo de Uma Coluna de Extração Liquido-LíquidoDocumento56 páginasEstudo de Uma Coluna de Extração Liquido-LíquidoBruna RoqueAinda não há avaliações
- 01 Estrutura CristalinaDocumento20 páginas01 Estrutura CristalinaEmerson CastroAinda não há avaliações
- Apostila Hidrocarbonetos PDFDocumento4 páginasApostila Hidrocarbonetos PDFwinricAinda não há avaliações
- Resoluções Química Inorgânica 82-92Documento151 páginasResoluções Química Inorgânica 82-92Diego VidalAinda não há avaliações
- Material em PDF - Dominando o CálculoDocumento25 páginasMaterial em PDF - Dominando o CálculoPAULO ROBERTOAinda não há avaliações
- Química Osmose e Pressão OsmóticaDocumento1 páginaQuímica Osmose e Pressão OsmóticaQuimica Passei100% (1)
- Livro Refino PetroleoDocumento21 páginasLivro Refino PetroleoWadson Leite Barbosa100% (2)
- Lista de Exercícios de PneumáticaDocumento3 páginasLista de Exercícios de PneumáticaMatheus SilvaAinda não há avaliações
- Conversão Unidade PDFDocumento6 páginasConversão Unidade PDFAnonymous KPzPpZ6Ainda não há avaliações
- Respostas Da Lista de Exercícios de Absorção Atômica-2012.1Documento3 páginasRespostas Da Lista de Exercícios de Absorção Atômica-2012.1Farmacia 102100% (4)
- Fundamentos Da Termodinâmica Clássica 4 EdiçãoDocumento597 páginasFundamentos Da Termodinâmica Clássica 4 EdiçãoEmili BatistaAinda não há avaliações
- Cap. 2 - Combustão de Gases - Parte 1Documento29 páginasCap. 2 - Combustão de Gases - Parte 1renefbgAinda não há avaliações
- Gás Natural - FormandoDocumento198 páginasGás Natural - Formandobrites1966100% (1)
- A1Documento31 páginasA1Rafael Brognoli Recco100% (1)
- Cinetica e Reatores MartinDocumento298 páginasCinetica e Reatores MartinEugenio ManuelAinda não há avaliações
- Noções Básicas de EspectrofotometriaDocumento31 páginasNoções Básicas de EspectrofotometriaRoberto Alves BarbosaAinda não há avaliações
- Atuação Do Engenheiro Químico No Refino Do PetróleoDocumento10 páginasAtuação Do Engenheiro Químico No Refino Do PetróleoSayonarah RochaAinda não há avaliações
- Compostos de Coordenacao Ou ComplexosDocumento21 páginasCompostos de Coordenacao Ou ComplexosPedro LessaAinda não há avaliações
- Controle de sistemas por computador: projeto e identificaçãoNo EverandControle de sistemas por computador: projeto e identificaçãoAinda não há avaliações
- Aplicando Iot Para Medir Célula De Carga Com Esp8266 (nodemcu) Programado Em ArduinoNo EverandAplicando Iot Para Medir Célula De Carga Com Esp8266 (nodemcu) Programado Em ArduinoAinda não há avaliações
- Quimica Aplicada - Geral e Do Petroleo PDFDocumento82 páginasQuimica Aplicada - Geral e Do Petroleo PDFAlfane Gonçalves100% (1)
- Processos de Refino 2 - Craqueamento CatalíticoDocumento104 páginasProcessos de Refino 2 - Craqueamento CatalíticoLuan GabrielAinda não há avaliações
- Geoquiicai - Vers2 222Documento3 páginasGeoquiicai - Vers2 222Cinia desejoAinda não há avaliações
- Revisão - A História Do Átomo e Suas EstruturasDocumento22 páginasRevisão - A História Do Átomo e Suas EstruturasKênya MoraesAinda não há avaliações
- Estágio Supervisionado em Química - Os Desafios As Reflexões e ContribuiçõesDocumento13 páginasEstágio Supervisionado em Química - Os Desafios As Reflexões e ContribuiçõesIDufs ForPEQAinda não há avaliações
- UntitledDocumento2 páginasUntitledJuliaAinda não há avaliações
- Avaliacao 1 Ano Quimica Efag 2019Documento1 páginaAvaliacao 1 Ano Quimica Efag 2019danzootecAinda não há avaliações
- Exercícios Aula 1 QuímicaDocumento3 páginasExercícios Aula 1 QuímicaMarcos ViniciusAinda não há avaliações
- Característica Dos Átomos E Semelhança Atômica: 3 Série/Pré-Vestibular Química 3 Aula 5Documento19 páginasCaracterística Dos Átomos E Semelhança Atômica: 3 Série/Pré-Vestibular Química 3 Aula 5Paulo Eduardo Cavalcante de SousaAinda não há avaliações
- Fundamentação QuimicaDocumento18 páginasFundamentação QuimicaILOVEBIOMEDAinda não há avaliações
- Tecnologia Mecânica - Estrutura e Propriedades Das Ligas Metálicas - Vol. IDocumento141 páginasTecnologia Mecânica - Estrutura e Propriedades Das Ligas Metálicas - Vol. ILUSOUNDAinda não há avaliações
- Prova de Química 1 Ano - Ii BimestreDocumento2 páginasProva de Química 1 Ano - Ii BimestreIngredy AianneAinda não há avaliações
- 2listadeexercicio Guímica Geral 1Documento3 páginas2listadeexercicio Guímica Geral 1reappeAinda não há avaliações
- Estrutura Atomica-01Documento4 páginasEstrutura Atomica-01Reinaldo BritoAinda não há avaliações
- Conceitos Fundamentais de Atomistica PDFDocumento5 páginasConceitos Fundamentais de Atomistica PDFSandro BaldezAinda não há avaliações
- Modelos AtômicosDocumento119 páginasModelos AtômicosPaulo Vitor PinheiroAinda não há avaliações
- Química Vestibulando DigitalDocumento216 páginasQuímica Vestibulando DigitalKleber Rogério100% (1)
- Ficha Formativa: Nas Respostas Aos Itens de Escolha Múltipla, Selecione A Opção CorretaDocumento6 páginasFicha Formativa: Nas Respostas Aos Itens de Escolha Múltipla, Selecione A Opção CorretaBeatriz Afonso de SousaAinda não há avaliações
- Átomos e MoléculasDocumento7 páginasÁtomos e Moléculasadfs sadfasdfAinda não há avaliações
- Atividade 1 e 2 AnoDocumento2 páginasAtividade 1 e 2 AnoFlaviane MouraAinda não há avaliações
- Introducao A Quimica Novo Formato para AlunosDocumento11 páginasIntroducao A Quimica Novo Formato para Alunosfernando lealAinda não há avaliações
- Massa AtomicaDocumento8 páginasMassa AtomicaValdiki DavisAinda não há avaliações
- Aula 00 - Introdução À Química - ITA 2024Documento129 páginasAula 00 - Introdução À Química - ITA 2024HausnerAinda não há avaliações
- Semelhanças AtômicasDocumento2 páginasSemelhanças Atômicasaugustorodrigo995Ainda não há avaliações
- Estrutura Atomica ExerciciosDocumento5 páginasEstrutura Atomica ExerciciosLarissa NeferAinda não há avaliações
- NST-química-Atomística Estrutura Atômica (P, N, E), Número de Massa e Massa Atômica, Átomos e Íons, Relação Entre ÁtomosDocumento11 páginasNST-química-Atomística Estrutura Atômica (P, N, E), Número de Massa e Massa Atômica, Átomos e Íons, Relação Entre ÁtomosA B CAinda não há avaliações
- Química Geral e Experimental I - II UnidadeDocumento24 páginasQuímica Geral e Experimental I - II UnidadeAraújo NettoAinda não há avaliações
- Prova Final de Ciencias-9anoDocumento4 páginasProva Final de Ciencias-9anoyves raphael100% (1)
- 1 Calculos QuimicosDocumento8 páginas1 Calculos QuimicosJulia Rosário de Jesus100% (1)
- Massa Atômica Massa Molecular e Massa Molar 1 Prof Rui MedeirosDocumento3 páginasMassa Atômica Massa Molecular e Massa Molar 1 Prof Rui MedeiroslivisAinda não há avaliações