0 notas0% acharam este documento útil (0 voto)
130 visualizaçõesPropriedades Coligativas
Propriedades Coligativas
Enviado por
Tayuana Da CostaO documento descreve quatro propriedades coligativas de soluções: tonoscopia, ebulioscopia, crioscopia e osmoscopia. A tonoscopia é o abaixamento da pressão de vapor do solvente devido à presença do soluto não volátil. A ebulioscopia é o aumento do ponto de ebulição do solvente. A crioscopia é a diminuição do ponto de congelamento do solvente. A osmoscopia é o fenômeno da osmose onde o solvente passa para a solução mais concentrada através de uma membran
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Propriedades Coligativas
Propriedades Coligativas
Enviado por
Tayuana Da Costa0 notas0% acharam este documento útil (0 voto)
130 visualizações3 páginasO documento descreve quatro propriedades coligativas de soluções: tonoscopia, ebulioscopia, crioscopia e osmoscopia. A tonoscopia é o abaixamento da pressão de vapor do solvente devido à presença do soluto não volátil. A ebulioscopia é o aumento do ponto de ebulição do solvente. A crioscopia é a diminuição do ponto de congelamento do solvente. A osmoscopia é o fenômeno da osmose onde o solvente passa para a solução mais concentrada através de uma membran
Título original
propriedades coligativas
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
O documento descreve quatro propriedades coligativas de soluções: tonoscopia, ebulioscopia, crioscopia e osmoscopia. A tonoscopia é o abaixamento da pressão de vapor do solvente devido à presença do soluto não volátil. A ebulioscopia é o aumento do ponto de ebulição do solvente. A crioscopia é a diminuição do ponto de congelamento do solvente. A osmoscopia é o fenômeno da osmose onde o solvente passa para a solução mais concentrada através de uma membran
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Fazer download em pdf ou txt
0 notas0% acharam este documento útil (0 voto)
130 visualizações3 páginasPropriedades Coligativas
Propriedades Coligativas
Enviado por
Tayuana Da CostaO documento descreve quatro propriedades coligativas de soluções: tonoscopia, ebulioscopia, crioscopia e osmoscopia. A tonoscopia é o abaixamento da pressão de vapor do solvente devido à presença do soluto não volátil. A ebulioscopia é o aumento do ponto de ebulição do solvente. A crioscopia é a diminuição do ponto de congelamento do solvente. A osmoscopia é o fenômeno da osmose onde o solvente passa para a solução mais concentrada através de uma membran
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Fazer download em pdf ou txt
Você está na página 1de 3
UNOESC – UNIVERSIDADE DO OESTE DE SANTA CATARINA
TAYUANA BORTOLINI DA COSTA
PROPRIEDADE COLIGATIVAS
XAXIM – SANTA CATARINA
2021
TAYUANA BORTOLINI DA COSTA
PROPRIEDADES COLIGATIVAS
As propriedades coligativas são as propriedades que surgem quando se adiciona
um soluto não volátil (dificuldade de evaporar), quanto maior é a concentração
maior será o efeito da propriedade. Existem quatro propriedades coligativas a
tonoscopia, ebulioscopia, crioscopia e a osmoscopia.
A pressão máxima de vapor de uma substância é a pressão exercida por seus
vapores quando eles estiverem em equilíbrio dinâmico com sua fase liquida. O
fator de correção de Van´t Hoff se dá por...
I= 1 + α. (q-1)
TONOSCOPIA
É o abaixamento da pressão de vapor do solvente, devido à queda na taxa de
evaporação o soluto não volátil segura as moléculas do solvente, dificultando a
evaporação das moléculas.
Para soluções moleculares. ΔP/P2 = Kt . m
Para soluções iônicas. ΔP/P2 = Kt. M . i
ΔP = abaixamento absoluto da pressão máxima de vapor
P2 = pressão de vapor do solvente
Kt = constante tonoscópica
M = concentração em mol/L
EBULIOSCOPIA
É o aumento do ponto de ebulição de um liquido quando adicionamos um soluto
não volátil a ele. Um exemplo que explica bem esse conceito é que quando
temos água fervendo e seu ponto de ebulição é de 100 °C ao nível do mar e
adicionamos uma certa quantia de açúcar, que é um soluto não volátil, a água
para de ferver, ou seja, a sua temperatura de ebulição aumentou, isso acontece
pela interação de moléculas do solvente e soluto dificultando que a molécula
passa para o estado de vapor.
Para soluções moleculares. ΔTe = Ke . W
Para soluções iônicas. ΔTe = Ke . w . i
ΔTe = elevação do ponto de ebulição
Ke = constante ebulioscópica
W = molalidade
CRIOSCOPIA
Diminuição do ponto de congelamento quando adicionado um soluto não volátil.
A crioscopia funciona do mesmo modo que a ebulioscopia, em lugares muito
frios a água da superfície dos mares congela, pois, a água que fica por baixo do
gelo tem muitos sais dissolvidos que diminuem o seu ponto de congelamento.
Para soluções moleculares. ΔTc = Kc . w
Para soluções iônicas. ΔTc = Kc . w . i
ΔTc = diminuição do ponto de congelamento
Kc = constante crioscópica
OSMOSCOPIA
É o fenômeno da osmose, onde o solvente passa pela membrana do meio
menos concentrado para o mais concentrado.
Para soluções moleculares. π = m . r .t
Para soluções iônicas. π = m . r . t . i
M= concentração em quantidade de matéria (molaridade da solução)
R= constante universal dos gases perfeitos = 0,082 atm. L mol -1 . K -1 ou 62,3
mmhg L.mol -1. K-1
I= temperatura absoluta em Kelvin
Você também pode gostar
- PLANTA FORTESCUE DE HIDROGÊNIO VERDE - PORTO DO PECÉM - CE - 2023 08 19 As 7hDocumento22 páginasPLANTA FORTESCUE DE HIDROGÊNIO VERDE - PORTO DO PECÉM - CE - 2023 08 19 As 7hPaulo Marcos Cabral JuniorAinda não há avaliações
- 4 Manual Guia Arla ScaniaDocumento157 páginas4 Manual Guia Arla Scaniarafael penaAinda não há avaliações
- Relatório Quimica Org Exp II - Corante P5Documento4 páginasRelatório Quimica Org Exp II - Corante P5Phillipe LimaAinda não há avaliações
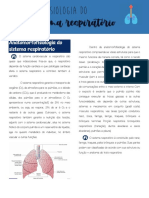
- Pneumo 1,2,3° - Bimes.Documento131 páginasPneumo 1,2,3° - Bimes.Milena BarcelosAinda não há avaliações
- Relatório Tensão SuperficialDocumento5 páginasRelatório Tensão SuperficialHaniel HonoratoAinda não há avaliações
- Identificação de Um Metal Por Sua Massa MolarDocumento7 páginasIdentificação de Um Metal Por Sua Massa MolarfelipeAinda não há avaliações
- Estudo Cinético Da Reação Da Acetona Com IodoDocumento2 páginasEstudo Cinético Da Reação Da Acetona Com Iodosony_mpb_rpAinda não há avaliações
- Trabalho de Des ColigativasDocumento10 páginasTrabalho de Des ColigativasJorgenilson SandraAinda não há avaliações
- EBULIOSCOPIA Turma 305Documento1 páginaEBULIOSCOPIA Turma 305Isadora Camporese Schuster100% (1)
- 2017 08 17 Propriedades Coligativas SerDocumento33 páginas2017 08 17 Propriedades Coligativas SerEugenio ManuelAinda não há avaliações
- Aula 2 - Propriedades ColigativasDocumento44 páginasAula 2 - Propriedades ColigativasBeatriz NunesAinda não há avaliações
- 12 - Relatorio (Ebulioscopia)Documento2 páginas12 - Relatorio (Ebulioscopia)Vanessa PeçanhaAinda não há avaliações
- Relatorio de AnaliticaDocumento10 páginasRelatorio de AnaliticaAdrianaMenegaroAinda não há avaliações
- Físico Química I Calor de DissoluçãoDocumento6 páginasFísico Química I Calor de DissoluçãoProst Mohamed0% (1)
- Apostila de Praticas de Químic Orgânica Exp. IV FinalDocumento90 páginasApostila de Praticas de Químic Orgânica Exp. IV FinalFernandoOliveiraAinda não há avaliações
- Relatório Quimica Destilação Simples e FracionadaDocumento13 páginasRelatório Quimica Destilação Simples e FracionadaFormatPcs100% (2)
- Relatório Equilíbrio QuímicoDocumento8 páginasRelatório Equilíbrio QuímicoIan BarretoAinda não há avaliações
- Destilação FracionadaDocumento5 páginasDestilação FracionadaEdu AntunesAinda não há avaliações
- Relatorio Distilaçao SimplesDocumento8 páginasRelatorio Distilaçao SimplesPedro CostaAinda não há avaliações
- Reações QuímicasDocumento17 páginasReações QuímicasErika NogueiraAinda não há avaliações
- RELATÓRIODocumento4 páginasRELATÓRIOLucas JesusAinda não há avaliações
- Destilação Por Arraste de Vapor 2Documento19 páginasDestilação Por Arraste de Vapor 2Ághata CostaAinda não há avaliações
- Relatório Quimica A Pratica 4Documento13 páginasRelatório Quimica A Pratica 4Tardio Valter100% (1)
- LEQ 1 - UFPE Roteiro Prática Pressão de Vapor 2023Documento4 páginasLEQ 1 - UFPE Roteiro Prática Pressão de Vapor 2023Alexandre HenriqueAinda não há avaliações
- 1° Relatório - Controle Físico-Químico Do LeiteDocumento17 páginas1° Relatório - Controle Físico-Químico Do LeiteTássia Castilho LimaAinda não há avaliações
- Determinação Do Coeficiente de Partição de Uma Substancia em Dois Líquidos ImiscíveisDocumento9 páginasDeterminação Do Coeficiente de Partição de Uma Substancia em Dois Líquidos ImiscíveisGuilherme Henrique Dos SantosAinda não há avaliações
- Evaporação SeminarioDocumento36 páginasEvaporação SeminarioJoana CordeiroAinda não há avaliações
- R3 - Fsqex - Propriedades ColigativasDocumento7 páginasR3 - Fsqex - Propriedades ColigativasRaniere BragaAinda não há avaliações
- Roteiro 2 - EquilíbrioDocumento13 páginasRoteiro 2 - EquilíbrioIsabel JohannAinda não há avaliações
- Apostila Organica Experimental VDocumento35 páginasApostila Organica Experimental VffoliveAinda não há avaliações
- Operações Unitárias de Laboratório - EquipamentosDocumento11 páginasOperações Unitárias de Laboratório - EquipamentosLuan GabrielAinda não há avaliações
- CINÉTICADocumento26 páginasCINÉTICAAntelmo Paulo StoelbennAinda não há avaliações
- Relatório Determinação de AASDocumento15 páginasRelatório Determinação de AASchemistry_se2636Ainda não há avaliações
- Apostila Quimica Segunda ParteDocumento43 páginasApostila Quimica Segunda ParteFlavioAinda não há avaliações
- 2012.1 Aula 03 Op - II Balanco MaterialDocumento8 páginas2012.1 Aula 03 Op - II Balanco MaterialThais AquinoAinda não há avaliações
- Experimento - Propriedades Físico-Químicas - Densidade e Viscosidade (David Carvalho)Documento9 páginasExperimento - Propriedades Físico-Químicas - Densidade e Viscosidade (David Carvalho)David CarvalhoAinda não há avaliações
- Relatório CriosDocumento11 páginasRelatório CriosdaniolisimAinda não há avaliações
- Relatório de Físico Química - Calor de VaporizaçãoDocumento8 páginasRelatório de Físico Química - Calor de VaporizaçãoKarine SilvaAinda não há avaliações
- Relatório 1 - Tensão SuperficialDocumento6 páginasRelatório 1 - Tensão SuperficialNatália CataniAinda não há avaliações
- Cromatografia em Papel e GizDocumento7 páginasCromatografia em Papel e GizElizabeth Guimaraes GoisAinda não há avaliações
- Estudo Da Polaridade e Volume Do Solvente Extrator Na Extração de Cafeína em Guaraná em PóDocumento1 páginaEstudo Da Polaridade e Volume Do Solvente Extrator Na Extração de Cafeína em Guaraná em PóJaqueline SantosAinda não há avaliações
- Destilação BatchDocumento3 páginasDestilação BatchDuarte MartinsAinda não há avaliações
- Experimento-2 Miscibilidade e SolubilidadeDocumento9 páginasExperimento-2 Miscibilidade e SolubilidadeJoelson Kalil CoelhoAinda não há avaliações
- Aldeidos e Cetonas Reações II PDFDocumento35 páginasAldeidos e Cetonas Reações II PDFFabricio CarvalhoAinda não há avaliações
- Equilíbrio Químico - Kátia GabrielDocumento50 páginasEquilíbrio Químico - Kátia GabrielMarciaAinda não há avaliações
- Relatório 9 FQ - Equilíbrio Químico em SoluçõesDocumento10 páginasRelatório 9 FQ - Equilíbrio Químico em SoluçõesSérgio GuimarãesAinda não há avaliações
- 04REL 04OrganicaEX2Documento8 páginas04REL 04OrganicaEX2Maria VitóriaAinda não há avaliações
- Op C - AdsorçãoDocumento46 páginasOp C - AdsorçãoRenan Gottardi BinAinda não há avaliações
- Energia de HidrataçãoDocumento2 páginasEnergia de HidrataçãoSérgio L.JúniorAinda não há avaliações
- Relatório Tensão Supercial - Vinicius Brambilla LourençoDocumento2 páginasRelatório Tensão Supercial - Vinicius Brambilla LourençoCAMILA AYUMI DE GODOIAinda não há avaliações
- Relatorio de Química Orgânica - Cravo-da-ÍndiaDocumento15 páginasRelatorio de Química Orgânica - Cravo-da-ÍndiaLéo dAvilaAinda não há avaliações
- Aula 7 - GravimetriaDocumento14 páginasAula 7 - GravimetriaGabriel MoraisAinda não há avaliações
- Equilíbrio Químico em Processos IndustriaisDocumento1 páginaEquilíbrio Químico em Processos IndustriaisKostiantyn Vladymyrov100% (1)
- 1.determinação de Água de Cristalização Do BaCl2Documento4 páginas1.determinação de Água de Cristalização Do BaCl2Priscila Ribeiro100% (1)
- RelatíDocumento9 páginasRelatíZ3tyyTVAinda não há avaliações
- Aula 4 - Propriedades ColigativasDocumento20 páginasAula 4 - Propriedades ColigativasKiamanda OliveiraAinda não há avaliações
- Relatorio8 Corante Alaranjado Metila PDFDocumento14 páginasRelatorio8 Corante Alaranjado Metila PDFGiliandroFarias100% (1)
- Mistura de SólidosDocumento9 páginasMistura de SólidosTales BotelhoAinda não há avaliações
- Relatório de Síntese Do Cloreto de T-ButilaDocumento8 páginasRelatório de Síntese Do Cloreto de T-Butilacontato.fcantelliAinda não há avaliações
- Relatorio DestilaçãoDocumento11 páginasRelatorio DestilaçãoJoão Dias100% (2)
- Propriedades ColigativasDocumento7 páginasPropriedades ColigativasJefferson MouraAinda não há avaliações
- Trabalho de QF 1 Grupo,,.Documento22 páginasTrabalho de QF 1 Grupo,,.Rolleyn MachocoAinda não há avaliações
- Aula de Propriedades Coligativas em Power Point Pronta 23.08.2023Documento26 páginasAula de Propriedades Coligativas em Power Point Pronta 23.08.2023BrunodsAinda não há avaliações
- Quimica do Cimento 2nd Arq1_repairedDocumento67 páginasQuimica do Cimento 2nd Arq1_repairedmedsonreborn3Ainda não há avaliações
- IUPAC Ácido ÚricoDocumento11 páginasIUPAC Ácido ÚricoArdor um ProcrastinadorAinda não há avaliações
- Cama Box Casal Black Friday Vale Pix - Casas BahiaDocumento1 páginaCama Box Casal Black Friday Vale Pix - Casas BahiahildospAinda não há avaliações
- Atividade de Pesquisa 02 - Instrumentação em Higiene OcupacionalDocumento2 páginasAtividade de Pesquisa 02 - Instrumentação em Higiene Ocupacionalerik pereira da silva100% (1)
- Ficha Técnica BRIFISOL 503Documento6 páginasFicha Técnica BRIFISOL 503Control Calidad SUPERFRESSCOAinda não há avaliações
- CPF 70132001233 - 20210718154206355697-3 - Simulado - Turma - Especial - Ime - 1 - Fase - 2022 - QuestoesDocumento21 páginasCPF 70132001233 - 20210718154206355697-3 - Simulado - Turma - Especial - Ime - 1 - Fase - 2022 - QuestoesAdriel BatistaAinda não há avaliações
- Revisão - Avp Etapa 1 QuímicaDocumento10 páginasRevisão - Avp Etapa 1 QuímicaAndreza MarquesAinda não há avaliações
- Roteiro para Aula Prática e Relatório - Aula 2 - Analise de AlimentosDocumento18 páginasRoteiro para Aula Prática e Relatório - Aula 2 - Analise de AlimentosangellindaansalaAinda não há avaliações
- Permissao para Trabalho A QuenteDocumento3 páginasPermissao para Trabalho A QuenteFlavio LucioAinda não há avaliações
- Lista 2 - Química OrgânicaDocumento5 páginasLista 2 - Química Orgânicathais cremascoAinda não há avaliações
- Desenho CentrifugaDocumento1 páginaDesenho Centrifugag.mariotti70Ainda não há avaliações
- Fundamentos Da BioquímicaDocumento35 páginasFundamentos Da Bioquímicaramalhoj91Ainda não há avaliações
- Mecânica Dos Solos s1Documento5 páginasMecânica Dos Solos s1Thiago Vertini100% (1)
- Lista de Exercícios - LigaçõesDocumento4 páginasLista de Exercícios - LigaçõesThiago messi 12Ainda não há avaliações
- Manual PusfogDocumento27 páginasManual PusfogAndreza SantosAinda não há avaliações
- 2 Lista - 1° Tri - 2° Ano FísicaDocumento4 páginas2 Lista - 1° Tri - 2° Ano Físicanicolas •Ainda não há avaliações
- MR Ligação Química 22 23Documento3 páginasMR Ligação Química 22 23Ana ValentimAinda não há avaliações
- Usinagem de Pecas de PlasticoDocumento10 páginasUsinagem de Pecas de PlasticoSilas NequiceAinda não há avaliações
- NufosateDocumento25 páginasNufosatesousa ltAinda não há avaliações
- Plano-De-Estudos-03 Kit-Enem 15 09Documento3 páginasPlano-De-Estudos-03 Kit-Enem 15 09r7b97mrqfmAinda não há avaliações
- Tubos de Concreto e CalhasDocumento5 páginasTubos de Concreto e CalhasDaniela RibeiroAinda não há avaliações
- Apostila PDF-Extrusão TPs-Sousa&Donato-Jun'2017 PDFDocumento276 páginasApostila PDF-Extrusão TPs-Sousa&Donato-Jun'2017 PDFGean Carlos SaugoAinda não há avaliações
- Folheto TBS Ponto Fixo de Terra, Tipo 205 DG 2018 PTDocumento2 páginasFolheto TBS Ponto Fixo de Terra, Tipo 205 DG 2018 PTLuis PintoAinda não há avaliações
- DACNIS SH 68 - TOTAL - (BR) SDS NBR 14725-4 - BrazilDocumento11 páginasDACNIS SH 68 - TOTAL - (BR) SDS NBR 14725-4 - BrazilWillians SilvaAinda não há avaliações
- Propriedades e Processo de Sintetização Do PVCDocumento44 páginasPropriedades e Processo de Sintetização Do PVCDanielAinda não há avaliações
- Cap 50 70Documento12 páginasCap 50 70AloisioAinda não há avaliações