Litijum tetrahidroaluminat
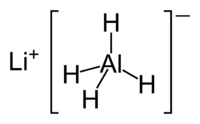
Tetrahidroaluminat litijuma je neorganska dvoguba so sa molekulskom formulom Li[AlH4]. Na sobnoj temperaturi je belo čvrsto telo gustine 0,917 g/cm3.[4]
| Tetrahidroaluminat litijuma | |||
|---|---|---|---|

| |||
| |||
| |||
| IUPAC ime |
| ||
| Drugi nazivi | LAH, Tetrahidroaluminat litijuma | ||
| Identifikacija | |||
| Abrevijacija | LAH | ||
| CAS registarski broj | 16853-85-3 | ||
| PubChem[1][2] | 28112 11062293 (2H4) 11094533 (3H4) | ||
| ChemSpider[3] | 26150 | ||
| EINECS broj | |||
| ChEBI | 30142 | ||
| RTECS registarski broj toksičnosti | BD0100000 | ||
| Gmelin Referenca | 13167 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | LiAlH4 | ||
| Molarna masa | 37.95 g/mol | ||
| Agregatno stanje | beli kristali (čist uzorak) sivi prah (komercijalna upotreba) | ||
| Gustina | 0.917 g/cm3, osnovno | ||
| Tačka topljenja |
150 °C (423 K), razlaže se | ||
| Rastvorljivost u vodi | reaktivan | ||
| Struktura | |||
| Kristalna rešetka/struktura | monoklinična | ||
| Opasnost | |||
| Opasnost u toku rada | veoma zapaljiv | ||
| NFPA 704 | |||
| R i S-oznake | R: R15 S: S7/8, S24/25, S43 | ||
| Srodna jedinjenja | |||
| Srodna jedinjenja/hidridi | aluminijum-hidrid natrijum bor hidrid natrijum-hidrid | ||
|
| |||
| Infobox references | |||
Sa vodom reaguje veoma burno po formuli:
- Li[AlH4] + 4H2O → LiOH + Al(OH)3 + 4H2
Dobija se dejstvom velikih količina litijum hidrida na etarski rastvor aluminijum hlorida:[5]
- 4LiH + AlCl3 → Li[AlH4] + 3LiCl
Tetrahidroaluminat litijuma se često koristi kao redukciono sredstvojest u organskoj hemiji, npr. redukuje karboksilne kiseline do alkohola, a nitrite do amina). Dejstvom hlorida na etarski rastvor Li[AlH4] dobija se odgovarajući hidrid, npr:
- SiCl4 + Li[AlH4] → SiH4 + LiCl + AlCl3
Reference
uredi- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Finholt A. E., Bond A. C., Schlesinger H. I. (1947). „Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry”. Journal of the American Chemical Society 69 (5): 1199. DOI:10.1021/ja01197a061.
- ↑ Holleman, A. F., Wiberg, E., Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie, 102nd ed.. de Gruyter. ISBN 978-3-11-017770-1.
Literatura
uredi- Wiberg, E.; Amberger, E. (1971). Hydrides of the Elements of Main Groups I-IV. Elsevier. ISBN 0-444-40807-X.
- Hajos, A. (1979). Complex Hydrides and Related Reducing Agents in Organic Synthesis. Elsevier. ISBN 0-444-99791-1.
- Lide, D. R., ur. (1997). Handbook of Chemistry and Physics. CRC Press. ISBN 0-8493-0478-4.
- Carey, F. A. (2002). Organic Chemistry with Online Learning Center and Learning by Model CD-ROM. McGraw-Hill. ISBN 0-07-252170-8.
- Andreasen, A. (2005). „Chapter 5: Complex Hydrides”. Hydrogen Storage Materials with Focus on Main Group I-II Elements. Risø National Laboratory. ISBN 87-550-3498-5. Arhivirano iz originala na datum 2012-08-19. Pristupljeno 2014-04-03.
Spoljašnje veze
uredi- „Lithium Tetrahydridoaluminate - Compound Summary (CID 28112)”. PubChem.
- „Lithium Tetrahydridoaluminate”. WebBook. NIST.
