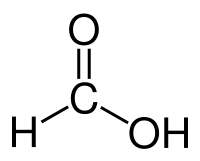
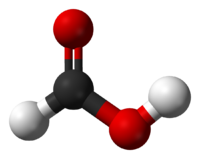
Myrsyra (engelska: formic acid, latin: formica = "myra") är en färglös, frätande, vattenlöslig syra med stickande lukt.[1] Myrsyra kallas även metansyra och är den enklaste karboxylsyrorna och därmed den enklaste organiska syran. Den har strukturformeln HCOOH och är den alkansyra med den kortaste kedjan. Karboxylgruppen -COOH ger syran dess egenskaper. [1] Myrsyrans salter kallas formiater från syrans latinska namn acidum formicum, där formica. Formaldehyd och formalin kan härledas på samma sätt. Exempel på formiater är natriumformiat (HCOONa) och aluminumformiat ((HCOO)3Al). Även estrarna av myrsyra kallas för formiat. [1]
| Myrsyra | ||||
  | ||||
| Systematiskt namn | Metansyra | |||
|---|---|---|---|---|
| Kemisk formel | CH2O2 eller HCOOH | |||
| Molmassa | 46,03 g/mol | |||
| Utseende | Färglös, vätska | |||
| CAS-nummer | 64-18-6 | |||
| SMILES | O=CO | |||
| Egenskaper | ||||
| Densitet | 1,2 g/cm³ | |||
| Löslighet (vatten) | Löslig | |||
| Smältpunkt | 8,4 °C | |||
| Kokpunkt | 100,8 °C | |||
| Faror | ||||
| Huvudfara |
| |||
| NFPA 704 | ||||
| SI-enheter & STP används om ej annat angivits | ||||

Myrsyra utsöndras bland annat från giftkörtlar hos vissa arter av myror, därav namnet och används som försvar. [1]
Historia
redigeraI början av 1400-talet observerade några forskare att vissa myror utsöndra en sur vätska.
Den engelske forskaren John Ray (29 november 1627 - 17 januari 1705) var den första som isolerade myrsyra genom att destillera massor av myror (1671).
Den franske kemisten Joseph Louis Gay-Lussac var den första att syntetisera myrsyra från vätecyanid. År 1855 uppfann en annan fransk kemist, Marcelin Berthelot, syntesen från kolmonoxid, som fortfarande används idag. Länge var myrsyra av liten teknisk betydelse. I slutet av 1960-talet producerades betydande mängder myrsyra som en biprodukt av syntesen av ättiksyra. Först senare användes myrsyra i större skala. Det erhölls inte längre bara som en biprodukt, utan tillverkas specifikt syntetiskt. [1]
Egenskaper
redigeraMyrsyra är, till skillnad från de flesta andra karboxylsyror, en relativt stark syra och bör hanteras med försiktighet. Den är liksom ättiksyra löslig i vatten och många organiska lösningsmedel. Till skillnad från många andra karboxylsyror kan myrsyra under normala förhållanden inte bilda en anhydrid. Om man vill bilda formylformiat kan man låta formylfluorid och natriumformiat reagera vid –78 °C. Med en alken kan myrsyra bilda formiatestrar.
Myrsyra är en relativt instabil, färglös, klar och mycket flyktig vätska. Den stelnar till en färglös fast substans vid 8 °C och kokar vid 100,7 °C. Smält- och kokpunkterna är betydligt högre än för organiska föreningar med liknande molmassa såsom propan, eftersom vätebindningarna mellan molekylerna måste brytas under smältning och kokning. Vissa av dessa fortsätter att existera i gasform, därför avviker myrsyra kraftigt från beteendet hos en ideal gas. Myrsyra bildar en azeotrop med vatten.
Myrsyra har en densitet på 1,22 g/cm³ vid 20 °C. Det krävs 12,7 kJ/mol för att smälta myrsyran och 22,7 kJ/mol för att förgasa den. Trippelpunkten är vid 8,3 °C och 0,0236 bar.
Myrsyra har en stark, stickande doft. Den kan blandas med vatten, etanol och glykol i valfritt förhållande och är också löslig i de flesta andra polära organiska ämnen, dock endast i små mängder i kolväten.
Syrakonstanten är 3,77 och myrsyra är därmed den starkaste osubstituerade monokarboxylsyran. Ättiksyra har ett pKs-värde på 4,76, trifluorättiksyra 0,23, svavelsyra -3 och väteklorid (saltsyra) -6,2.
Myrsyraångor kan detekteras med hjälp av gasdetektorer, till exempel för att bestämma koncentrationer på arbetsplatsen, eller genom dess reducerande effekt, vanligtvis genom reduktion av en ammoniakalisk silvernitratlösning till silver. [1]
Produktion
redigeraNär metanol och kolmonoxid kombineras med en stark bas som natriumhydroxid (NaOH) produceras estern metylformiat (CH3HCO2) som sedan medelst hydrolys kan sönderdelas till metanol och myrsyra.
Myrsyra bildas också när man destillerar en blandning av oxalsyra (C2O2[OH]2) och glycerol. I denna reaktion fungerar glycerol som en katalysator.
Myrsyra produceras ofta som biprodukt vid andra organiska reaktioner, men för att tillverka lika mycket syra som används behöver man producera mer än det man får som biprodukt.
Användning
redigeraMyrsyra används i stor utsträckning inom lantbruket vid ensilering av grönmassa vid vallskörden, oftast i kombination med andra syror eller konserveringsmedel. Myrsyra används även för bekämpning av varroakvalster i bisamhällen, då en 60 % lösning i vatten får avdunsta. Myrsyra förekommer i ett preparat för behandling av vårtor[2]. Myrsyra kan också användas i laboratorier för att framställa kolmonoxid.
Myrsyra användes som konserveringsmedel i fisk-, frukt- och grönsaksprodukter fram till 1998 under E-nummer E236, men är inte längre godkänt som livsmedelstillsats i EU. Natrium- och kalciumformiat är inte heller tillåtna som livsmedelstillsatser (E237 och E238). Inom medicinen används myrsyra som ett antireumatiskt medel och för att behandla vårtor. Inom textil- och läderindustrin används myrsyra vid färgning och impregnering. Syran används också som desinfektionsmedel i sura rengöringsprodukter.
Inom den kemiska industrin används syran för att neutralisera alkaliska reaktionsblandningar. Vid elektroniktillverkning används myrsyra som reduktionsmedel i lödningsprocessen. Den används industriellt för avkalkning av kylvattensystem då avloppsvattnet endast innehåller ofarligt kalciumformiat med ett lågt COD-värde.
Koncentrerad myrsyra används även för att rengöra grova ädelstenar. Syran attackerar kalksten och andra föroreningar och rengör ädelstenen utan att skada den. Myrsyra bör endast användas på syrafasta ädelstenar.[1]
Säkerhet, giftighet, hälsofaror
redigeraVid kontakt med koncentrerad myrsyra på kroppen (speciellt ögonen) kan frätsår skapas. Myrsyra utanpå kroppen är inte giftig, men om man dricker syran kan man få frätsår i strupen. Syran är lättflyktig och ångorna från koncentrerad syra irriterar ögonen och de övre luftvägarna.[3]
| Koncentration | Märksymbol |
|---|---|
| 2 %-10 % | Irriterande (Xi) |
| 10 %-90 % | Frätande (C) |
| >90 % | Frätande (C) |
En av de saker som orsakar metanolens (träspritens) giftighet är att levern bryter ner metanol till myrsyra vilket sänker blodets pH-värde. Detta tillstånd, acidos, kan i sig vara livshotande. Myrsyra och formaldehyd som bildas vid nedbrytning av metanol angriper synnerven och kan orsaka blindhet.
Förekomst i naturen
redigeraI naturen är myrsyra utbredd. Den används av många plan- och djurarter som en beståndsdel av giftblandningar för att försvara sig.
Myrsyra är en naturlig komponent i bihonung. Beroende på sort innehåller 1 kg honung 50 till över 1000 milligram. Myrsyra är också en komponent i tobaksrök.
Larverna från den stora gaffelsvansen (Cerura vinula) som är en typ av fjäril, liksom vissa arter av myror (medlemmar i underfamiljen Formicinae) sprejar en vätska som innehåller myrsyra som försvar. Vissa arter av markbaggar, skorpioner och bin använder sekret som innehåller myrsyra för både försvars- och attack syften. Hos vissa arter av maneter är myrsyra en del av giftet i stickkapslarna.
Nässlornas brännhår innehåller ett nässelgift som innehåller bland annat myrsyra och natriumformiat.
I den mänskliga organismen produceras myrsyra tillsammans med formaldehyd när metanol metaboliseras. Myrsyra är lätt biologiskt nedbrytbar. [1]
Förutom hos myror finns även myrsyra i munkörtlarna hos vissa släkten gaddlösa bin (så kallade "eldbin", speciellt släktet Oxytrigona)[4], i brännhåren hos brännässla (Urtica dioica)[5][6], i svett och i urin.[7]
-
Brännässla (Urtica dioica)
-
Röd skogsmyra (Formica rufa)
-
Svett
Se även
redigeraKällor
redigera- ^ [a b c d e f g h] ”Ameisensäure” (på tyska). Wikipedia. 2024-05-10. https://de.wikipedia.org/w/index.php?title=Ameisens%C3%A4ure&oldid=244842665. Läst 3 juni 2024.
- ^ ”VårtFri läkemedel”. http://www.vartfri.se/sv-se/vartbehandling/myrsyra/. Läst 27 augusti 2018.
- ^ Bo Birgersson, Olov Sterner, Erik Zimerson: Kemiska hälsorisker. Toxikologi i kemiskt perpektiv kap. "Karlboxylsyror". Liber Hermods, 1983.
- ^ David W. Roubik (2006). ”Stingless bee nesting biology” (på engelska) (PDF (967 kB)). Apidologie (37): sid. 6. doi:. http://hal.archives-ouvertes.fr/docs/00/89/22/07/PDF/hal-00892207.pdf. Läst 30 maj 2015.
- ^ Henriksson, Anders (2000). Naturkunskap B. Gleerups Utbildning AB. sid. 63. ISBN 91-40-63503-1
- ^ http://www.ne.se/brännässla - från Nationalencyklopedin på nätet - http://www.ne.se - läst datum: 18 mars 2014
- ^ http://www.alltomvetenskap.se/nyheter/hur-branns-nasslor - läst datum: 18 mars 2014 - från tidningen allt om vetenskap med startsidan: http://www.alltomvetenskap.se
Externa länkar
redigera- Wikimedia Commons har media som rör Myrsyra.


