محلول جامد
محلول جامد هي بلورة أو بلورات مكونة من عنصرين كيميائيين على الأقل وتكون فيها ذرات العنصر الغريب (المذاب) أو أيوناته موزعة توزيعا عشوائيا.[1][2][3] وقد تشغل ذرات العنصر الغريب مواقع في الشبكة البلورية كان من المفروض أن تشغله ذرة من العنصر الرئيسي (المذيب) أو قد تشغل أماكن بينية في الشبكة البلورية. فالمحلول الجامد يشكل بلورات مختلطة ويسمى أيضا سبيكة .
تكوين محلول جامد
[عدل]تصنف نوعان من المحاليل الصلبة:
- محلول جامد متماثل التبلور: تتميز عناصره بأن لها نفس النظام البلوري، مما يجعل المحلول البلوري متخذا أيضا نفس
نطام التبلور.
- محلول جامد مختلف التبلور: وفيه يرغم عنصر الأغلبية (المذيب) ذرات عنصر المذاب أن يتبع نظامه البلوري.
وإذا لم تكن ذرات العنصرين المكونان للمحلول الجام موزعة توزيع عشوائيا فيسمى المحلول الجام في هذه الحالة «متبلور وسطي».
محاليل صلبة في المعادن الأولية
[عدل]من النادر أن تكون المعادن الأولية نقية وانما تتكون في الغالب من مركبات كيميائية. وفي كثير من الحالات لا يعبر اسم المعدن الأولي عن عناصره الداخلة في تركيبه.
فمثلا اللابرادوريت هو مزيج متبلور من مجموعة ألبيت-أنورثيت، ويتكون بنسبة 50-70% من أنورثيت.
والمعدنان فورستيريت (Mg2SiO4) وفاياليت (Fe2SiO4) يكونان مجموعة من المزيجات المعدنية تسمى «مجموعة أوليفين» ([Mg, Fe]2SiO4).
ومثال اشتراك المغنسيوم لتكوين دولوميت (CaMg(CO3)2) أو مغنيسيت (MgCO3).
أهمية المحاليل الجامدة
[عدل]للمحاليل الجامدة أهمية كبيرة في الصناعة والتجارة حيث تتميز تلك المحاليل الصلبة بخواص تفوق خواص العناصر النقية. وكثير من السبائك المعدنية هي عبارة عن محاليل صلبة. ومنها ما يحتوي على قليل من العنصر المذاب ولكنه يغير الخواص الفيزيائية والكهربائية للعنصر المذيب بشكل شديد.
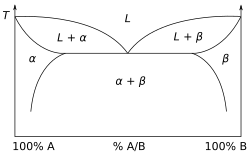
يسمى الشكل المجاور مخطط ثنائي الأطوار: وهو مزيج من مادتين مختلفي التركيز و. محور اليمين يبين وجود المادة B بنسبة 100% ، ويمثل محور اليسار وجود المادة A بنسبة 100% . وبينهما توجد مزيج منهما بنسب تركيز مختلفة. المنطقة "" هي عبارة عن محلول جامد وتقوم فيه المادة بدور المذاب في مادة المذيب .
وعلى الناحية الأخرى للرسم البياني - اللذي يبين تريكز المادتين - نجد المنطقة "" وهي أيضا عبارة عن محلول صلب؛ وفيه يلعب دور المذاب في المذيب .
وفي المنطقة الوسطى العريضة بين المنطقتين و ، وهي معلمة بـ " + "، وهي «ليست» محلول جامد. وإذا فحصنا التركيب الصغري تحت الميكروسكوب لتلك المنطقة نجدها تتكون من طورين: محلول جامد -في- ومحلول جامد -في- ويكوّنان طورين منفصلين، قد يكونا في هيئة رقائقية أو هيئة حبيبية.
تطبيقات
[عدل]في مخطط أطوار تكون المادة صلبة عند ثلاثة تركيزات للمادة، وتظل صلبة حتى تصل درجة حرارتها إلى درجة الانصهار، وبعد استمرار إضافة حرارة إليها (حرارة إنصهار) تصبح سائلة عند نفس درجة الانصهار. أي تثبت درجة الحرارة عند درجة الانصهار رغم استمرار التسخين، حتى تنصهر كل المادة وتصبح سائلة. (مثل ذلك نجده في الماء الذي يغلي حيث تظل درجة الحرارة عند 100 درجة مئوية ثابتة (درجة الغليان) حتي يتحول كل الماء إلى بخار.)
طبقا لمخطط الأصوار لدينا تلاثة تركيزات:
- إلى اليسار نجد المادة A النقية
- وإلى اليمين نجد المادة B نقية
- وبينهما نجد نقطة منخفضة تسمى نقطة يوتيكتكية وعندها يكون التركيز اليوتيكتي. أي عند نقطة اليوتيكي والتركيز اليوتيكي تكون درجة الانصهار أقل ما يمكن، وهذا ما يجعلنا نهتم بنقطة اليوتيكتي لمزيج مواد معين.
وفي خلاف تلك الثلاثة نقاط تكون المادة في حالة معجون أو بين السائل والصلب حتى يكتمل انصهارها بالتسخين.
ويسمى المزيج عند نقطة اليوتيكي، يسمى «سبيكة يوتيكتيكية». يشكل مزيج من الرصاص والقصدير عند نسبة 37 /63 نقطة مناسبة للحام في لحام الدوائر الإلكترونية.
اقرأ أيضا
[عدل]مراجع
[عدل]- ^ Callister Jr.، William D. (2006). Materials Science and Engineering: An Introduction (ط. 7th). John Wiley & Sons. ISBN:0-471-35446-5.
- ^ Cottrell، Alan Howard (1967). An Introduction to Metallurgy. Institute of Materials. ISBN:0-8448-0767-2.
- ^ Alan D. MacNaught؛ Andrew R. Wilkinson، المحررون (1997). Compendium of Chemical Terminology: IUPAC Recommendations (ط. 2nd). Blackwell Science. ISBN:0865426848. مؤرشف من الأصل في 2022-07-12.




