Chlor
| Chlor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓ Periodická tabulka ↓ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Plynný chlor | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obecné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Název, značka, číslo | Chlor, Cl, 17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cizojazyčné názvy | lat. Chlorum | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupina, perioda, blok | 17. skupina, 3. perioda, blok p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemická skupina | Halogeny | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v zemské kůře | 130 až 1900 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Koncentrace v mořské vodě | 19000 mg/l | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhled | Žlutozelený plyn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikace | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Registrační číslo CAS | 7782-50-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativní atomová hmotnost | 35,453 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomový poloměr | 100 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentní poloměr | 102±4 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsův poloměr | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iontový poloměr | 181 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronová konfigurace | [Ne] 3s2 3p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidační čísla | VII, VI, V, IV, III, II, I, −I | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita (Paulingova stupnice) | 3,16 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizační energie | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| První | 1251,2 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Druhá | 2298 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Třetí | 3822 KJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Látkové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystalografická soustava | Orthorhombická | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molární objem | 17,39×10−6 m3/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mechanické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 0,0032 g/cm3 (0 °C, 101,325 kPa)
1,5623 g/cm3 (kap. při Tv) 2,10 g/cm3 (−70 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenství | Plynné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tlak syté páry | 10 Pa (139 K) 1 kPa (170 K) 100 kPa (239 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rychlost zvuku | 206 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná vodivost | 8,9×10−3 W⋅m−1⋅K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termodynamické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota tání | −101,5 °C (171,65 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | −34,4 °C (238,75 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo tání | 6,406 kJ/mol (Cl2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenské teplo varu | 20,41 kJ/mol (Cl2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrná tepelná kapacita | 480 Jkg−1K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektromagnetické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Měrný elektrický odpor | >10 Ω·m (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Standardní elektrodový potenciál | 1,36 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetické chování | Diamagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bezpečnost | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| [1] Nebezpečí[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-věty | R23, R36/37/38, R50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-věty | (S1/2), S9, S45, S61 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopy | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chlor, chemická značka Cl, latinsky chlorum (starořecky χλωρóς, chlóros – „zelený“) je toxický, světle zelený plyn, druhý člen řady halogenů.
Základní fyzikálně-chemické vlastnosti
[editovat | editovat zdroj]Chlor je velmi reaktivní plyn, který se ochotně slučuje s většinou prvků periodické soustavy. Byl objeven roku 1774 Carlem Wilhelmem Scheelem, ale dnešní pojmenování mu dal až roku 1810 anglický chemik sir Humphry Davy.
Výskyt v přírodě
[editovat | editovat zdroj]
Na Zemi je chlor přítomen pouze ve formě sloučenin, většina z nich je rozpuštěna v mořské vodě a ve vodě některých vnitrozemských jezer (Mrtvé moře, Velké solné jezero a další). Z minerálů je nejznámější chlorid sodný (NaCl) neboli kuchyňská sůl. Velká ložiska chloridu sodného se nacházejí např. v Polsku a USA a geologicky vznikla jako pozůstatek po odpaření slaných vnitrozemských jezer. Viz také minerál halit.
V zemské kůře je chlor 20. nejrozšířenějším prvkem a je přítomen v koncentraci 200–1900 ppm (mg/kg). V mořské vodě tvoří chloridové ionty nejvíce zastoupený anion, jejich koncentrace se pohybuje kolem 19 g/l. Přesto je na Zemi zhruba 10krát méně chloru, než by odpovídalo jiným planetám, což mohlo napomoci rozšíření života.[2]
Zastoupení ve vesmíru odpovídá vyššímu atomovému číslu chloru. Předpokládá se, že na 1 atom chloru připadá přes 17 milionů atomů vodíku.
Chlor je mikrobiogenním prvkem rostlin. Přijímají ho z půdy z vodného roztoku. V rostlině je velmi pohyblivý. Pomáhá kompenzovat kladný náboj draslíku, spolu s vápníkem stabilizuje komplex rozkládající vodu v primární fázi fotosyntézy a spolu s draslíkem se podílí na otvírání a zavírání průduchů.
Sloučeniny
[editovat | editovat zdroj]Ve sloučeninách se chlor vyskytuje v mocenství Cl−I, ClI, ClIII, ClIV, ClV a ClVII.
V každém mocenství, ve kterém se chlor vyskytuje, vytváří i příslušnou kyselinu.
- jedinou bezkyslíkatou kyselinou je kyselina chlorovodíková (HCl) s chlorem záporně jednomocným Cl−I
- kyselina chlorná HClO odpovídá valenci ClI a patří mezi velmi slabé kyseliny
- v mocenství ClIII je známa kyselina chloritá HClO2
- v mocenství ClIV je znám oxid chloričitý ClO2 používaný k bělení celulózy v papírenském průmyslu[3] a také v údajně léčivém přípravku MMS[4][5]
- kyselina chlorečná HClO3 odpovídá valenci ClV
- velmi silná kyselina chloristá HClO4 přísluší sedmimocnému chloru ClVII[6]
Všechny uvedené kyseliny vytvářejí soli s elektropozitivními prvky a především v případě kyseliny chlorné, chlorité a chlorečné mají tyto soli mnohem větší praktický význam než příslušné kyseliny.
Organické sloučeniny chloru jsou v přírodě výjimečné a naprostá většina organických molekul obsahujících atom chloru, s nimiž se lze setkat, vznikla chemickou syntézou. K nejpoužívanějším patří chloroform, tetrachlormethan, PVC, DDT, freony atd.
Výroba a využití
[editovat | editovat zdroj]
Průmyslově vyráběný plynný chlor vzniká jako vedlejší produkt výroby hydroxidu sodného nebo draselného elektrolýzou vodného roztoku chloridu sodného nebo draselného – solanky (dalším vedlejším produktem je vodík). Starší amalgámový způsob výroby používal jako katodu kovovou kapalnou rtuť, což mohlo vést ke kontaminaci výrobních závodů i okolního životního prostředí (např. Spolana Neratovice[7], Spolchemie Ústí nad Labem[8]). Modernějšími a v současnosti používanými způsoby přípravy chloru jsou membránová nebo diafragmová elektrolýza. Při diafragmové elektrolýze je katodový a anodový prostor oddělen polopropustnou membránou, která má za úkol zabránit vedlejším reakcím, vzhledem k nízké účinnosti je však tento způsob historií (malá čistota vznikajícího hydroxidu). Dnes se k této přípravě užívá způsobu membránového, fungujícího na podobném principu jako diafragmové provedení, avšak s vyšší účinností, pro diafragmový i membránový způsob jsou společné užívané elektrody, tedy anoda (rozměrově stálá) z titanu pokrytého tenkou vrstvou oxidu titaničitého a katoda ze železa či niklu. Tlakové kovové lahve s plynným chlorem jsou označeny žlutým pruhem.
- Při práci s plynným chlorem je nezbytné zachovávat přísná bezpečnostní opatření, protože je velmi silně toxický a z průmyslových provozů je známa řada havárií se smrtelnými následky. Plynný chlor je znám jako první prakticky použitá chemická bojová látka již z 1. světové války v roce 1915.
- Elementární chlor se prakticky používá k dezinfekci pitné vody, protože i v malých koncentracích hubí bakterie a jeho nadbytek lze z vody snadno odstranit pouhým probubláním vzduchem. Další uplatnění nachází chlor v papírenském a textilním průmyslu, kde se používá k bělení surovin.
Kyselina chlorovodíková, chloridy
[editovat | editovat zdroj]
Chlorovodík HCl je bezbarvý plyn o bodu varu 53 °C, po rozpuštění ve vodě reaguje silně kysele a je označován jako kyselina chlorovodíková. Vyrábí se působením kyseliny sírové na chlorid sodný nebo častěji přímou reakcí plynného vodíku a chloru. Značné množství chlorovodíku vzniká jako odpadní produkt při chloraci uhlovodíků. Komerčně se dodává v roztocích o koncentraci kolem 35 %.
- Směs kyseliny chlorovodíkové a dusičné v poměru (3:1) se nazývá lučavka královská. Tato směs rozpouští i velmi odolné drahé kovy jako zlato nebo platinu. K tomuto jevu dochází kombinací velmi silných oxidačních vlastností kyseliny dusičné a komplexotvorných vlastností chloridového iontu, který vytváří stabilní komplexní ionty [AuCl4]− a [PtCl6]2−.
- Chlorid sodný NaCl je nezbytnou složkou potravy, je obsažen v krvi i krevní plazmě. Jeho příjem v potravě je však třeba udržovat v rozumných mezích, protože jeho přebytek působí nepříznivě na kardiovaskulární systém a zvyšuje riziko infarktu myokardu.
- Chlorid sodný a chlorid vápenatý CaCl2 se v zimním období rozprašují na vozovky, aby z nich odstranily námrazu. Využívá se přitom faktu, že roztoky těchto látek mrznou až při teplotě pod −20 °C a při kontaktu ledu s uvedenými chloridy led taje a vznikají nasycené chloridové roztoky. Problémem zůstává korozivní působení těchto roztoků na kovové součásti automobilů i zatížení půdy v okolí komunikací vysokými koncentracemi solí.
- Většina chloridů je výborně rozpustná ve vodě. Výjimku tvoří chlorid stříbrný AgCl a chlorid rtuťný neboli kalomel Hg2Cl2. Nerozpustnosti AgCl ve vodě je možno využít k oddělení stříbra z roztoků dalších kovů, přičemž kovové stříbro lze z filtrátu AgCl poměrně jednoduše získat pyrometalurgicky. Vysoce čistý chlorid stříbrný je důležitou složkou fotografických materiálů (filmy, fotopapíry). Kalomel se přes svoji toxicitu používá v analytické chemii jako redukční činidlo pří vážkovém stanovení platinových kovů.
Kyselina chlorná, chlornany
[editovat | editovat zdroj]Kyselina chlorná HClO je poměrně slabá kyselina a chemicky značně nestálá sloučenina. Větší význam mají její soli chlornany.
- Chlornan sodný NaClO je sloučenina s oxidačními a především dezinfekčními účinky. Připravuje se zaváděním plynného chloru do roztoku hydroxidu sodného, za vzniku chlornanového a chloridového iontu. Reakce tohoto typu se nazývá disproporcionace.
- Vyrobený chlornan sodný je nejčastěji distribuován a dále používán přímo jako roztok.
Kyselina chlorečná a chloristá, chlorečnany a chloristany
[editovat | editovat zdroj]Kyselina chlorečná HClO3 je nestálá kapalina se silně oxidačními účinky.
- Ze solí jsou nejznámější chlorečnan sodný a draselný, základní složky „Travexu“, přípravku pro hubení plevelů a trávy. Kromě toho se tyto chlorečnany vyznačují velmi silnými oxidačními vlastnostmi a ve směsi s organickými látkami (cukr) velmi snadno a silně explodují. Řada především mladších amatérských pyrotechniků byla při experimentech s těmito směsmi vážně zraněna.[zdroj?]
- Kyselina chloristá HClO4 je jednou z nejsilnějších kyselin. Vyrábí se obvykle elektrochemickou oxidací chlorečnanů a komerčně se distribuuje jako vodný roztok o koncentraci přibližně 70%, který je prakticky neomezeně stálý.
- Ve zředěných roztocích se kyselina chloristá chová pouze jako velmi silná kyselina. V koncentrovaném stavu a za horka je ovšem mimořádně silným oxidačním prostředkem, využívaným např. k rozkladům stálých organických polymerů (polystyren, PVC). Doporučuje se však, aby uvedené reakce prováděl pouze zkušený analytický chemik, protože při nich hrozí nebezpečí exploze. Zároveň je známo, že organické látky (např. dřevěné součásti laboratorních digestoří) mohou po dlouhodobém styku s parami kyseliny chloristé nebo oxidu chloristého samovolně explodovat.
- Velká většina solí kyseliny chloristé, chloristanů jsou sloučeniny velmi dobře rozpustné ve vodě. Výjimku tvoří chloristan draselný KClO4, rubidný RbClO4, cesný CsClO4 a amonný NH4ClO4. V analytické chemii slouží tento jev k důkazu nebo separaci uvedených kationtů.
- Chloristan draselný a amonný jsou složkou různých pyrotechnických směsí. Chloristan amonný je základem pevného paliva raketových motorů, využívá jej např. i americký raketoplán Space Shuttle.
Organické sloučeniny chloru
[editovat | editovat zdroj]Výroba chlorovaných uhlovodíků v průběhu 20. století dosahovala milionů tun nejrůznějších sloučenin a dodnes představuje řada těchto produktů velkou ekologickou zátěž pro naši planetu. Řada sloučenin byla v době svého objevu pokládána za prakticky neškodné a teprve po mnohaletém masovém používání se ukázalo, že jejich dlouhodobé působení v přírodě může mít katastrofální následky. Jedním z příkladů je vliv chlorofluorovaných uhlovodíků – freonů na ozonovou vrstvu, o které se podrobněji píše v kapitole o fluoru.
Chlorovaná organická rozpouštědla
[editovat | editovat zdroj]Nejjednoduššími významnými chlorovanými uhlovodíky jsou trichlormetan neboli chloroform CHCl3 a tetrachlormetan, nazývaný tetrachlor CCl4. Obě sloučeniny jsou těžké kapaliny s relativně nízkým bodem varu (CHCl3 62 °C a CCl4 77 °C). Obě jsou nehořlavé a při vdechování nejsou toxické. Chloroform má navíc narkotizační účinky a byl v omezeném množství používán i v medicíně pro uspávání pacientů při operacích.
- Obě kapaliny se prakticky nemísí s vodou, ale jsou výbornými rozpouštědly nepolárních organických sloučenin a tuků. Ještě před několika lety prakticky všechny čistírny oděvů praly zboží svých zákazníků ve směsi těchto kapalin. Organické znečištění bylo velmi efektivně odstraněno a díky nízkému bodu varu čisticí směsi byly její zbytky z oděvů snadno odstraněny zahřátím.
- Řada barev na kovy i dřevo měla za rozpouštědlo pigmentů a ochranných látek právě chloroform či tetrachlor.
- Díky nehořlavosti terachlormetanu sloužila tato sloučenina jako náplň některých hasicích přístrojů.
- Obě látky se dodnes v omezeném měřítku používají pro extrakci tuků z biologického materiálu i pro separace organických sloučenin ze směsí extrakcí typu kapalina-kapalina.
- Podrobné dlouhodobé klinické studie však bohužel ukázaly, že trvalý dlouhodobý styk organizmu s těmito rozpouštědly značně zvyšuje riziko vzniku rakovinného bujení a obě sloučeniny se dostaly do seznamu karcinogenních látek. Na základě této skutečnosti je v současné době velmi silně omezena jak produkce, tak praktické využití těchto organických rozpouštědel.
PCB
[editovat | editovat zdroj]
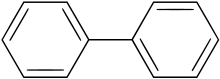
Podobný osud má i skupina organických chlorovaných aromatických uhlovodíků nazvaná polychlorované bifenyly neboli PCB. Existuje celkem 208 kongenerů, které se liší počtem atomů chloru a jejich vzájemnou polohou na bifenylovém skeletu. Jsou to výševroucí nehořlavé a chemicky jsou mimořádně stálé kapaliny. Jsou výbornými rozpouštědly nepolárních organických sloučenin a tuků.
Hlavní uplatnění nalezly PCB jako náplně transformátorů, kondenzátorů a dalších elektrických zařízení. Dále byly užívány jako hydraulické kapaliny, součásti tiskových barev, nátěrových hmot, tmelů a dalších výrobků.
PCB byly v době počátku jejich výroby považovány za zcela neškodné látky a na jejich únik do prostředí nebyl brán ohled. Teprve po desetiletích jejich užívání bylo zjištěno PCB se v přírodě nerozkládají (jsou perzistentní, hromadí se v tělech živočichů a šíří se v potravních řetězcích (jsou bioakumulativní) a že mají i ve stopových množstvích nepříznivé účinky na živé organismy. V průběhu let byla jejich výroba zastavena a jejich užívání omezeno Stockholmskou úmluvou.
DDT
[editovat | editovat zdroj]
DDT je zkratka sloučeniny dichlordifenyltrichlorethan nebo 1,1,1-trichlor-2,2-bis(p-chlorofenyl)ethan (ClC6H4)2CH(CCl3), jeden z nejstarších a nejznámějších insekticidů.
DDT byl poprvé syntetizován již v roce 1874. Jeho insekticidní účinky však objevil až švýcarský chemik Paul Hermann Müller v roce 1939. Od druhé světové války bylo DDT používáno v masovém měřítku, kde sloužilo jako pro přípravek k hubení škodlivého hmyzu v zemědělství, ale především k likvidaci komárů a moskytů v tropických zemích.
Postupně bylo zjištěno, že jde o perzistentní látku, která se hromadí v tělech živočichů i člověka (je bioakumulativní) a má i v malých dávkách nepříznivé účinky na zdraví. Proto bylo jeho výroba a použití v mnoha zemích zakázáno a celosvětově je použití omezeno Stockholmskou úmluvou o perzistentních organických látkách.
PVC
[editovat | editovat zdroj]
Polymer polyvinylchlorid, PVC, patří dodnes k nejrozšířenějším průmyslově vyráběným plastickým hmotám. Vyrábí se polymerací nenasyceného chlorovaného uhlovodíku vinylchloridu, (C2H3Cl). Vzniklý produkt se dále barví a plní různými aditivy, takže na trh se dostává velmi široká škála plastů s rozdílnými fyzikálním vlastnostmi.
- Všechny vyráběné druhy PVC se vyznačují dobrou chemickou odolností, jsou velmi špatně hořlavé a tepelně dobře odolné. Vnášením různých pigmentů do hmoty plastu lze připravit rozsáhlou paletu barevných odstínů. Povrch plastu je velmi snadno omyvatelný vodou. Z těchto důvodů se stále hojně používají k výrobě podlahových krytin a bytových textilií. Povrchy domácích zahradních bazénů jsou často pokryty vrstvou PVC, z PVC se vyrábí armatury pro rozvody pitných i odpadních vod.
- Další využití nalézá PVC v medicíně jako inertní součást různých aparátů (hadičky, trubičky, zásobníky tekutin…), ale jsou z něj např. vyráběny i hračky pro děti.
- Problém s PVC nastává v okamžiku jeho hoření nebo tepelného rozkladu. Přestože je za normálních okolností téměř nehořlavé, za vysokých teplot (např. při požáru bytu) začíná tepelně degradovat za uvolňování širokého spektra vesměs velmi toxických organických sloučenin (nejznámější je patrně fosgen). I při řízeném spalování se do plynných spalin dostávají atomy chloru, které působí silně korozivně na spalovací aparatury díky vznikajícímu chlorovodíku. Reakcí chloru s aromatickými uhlovodíky dochází ke vzniku zvláště nebezpečných dioxinů.
Dioxiny – ekologická hrozba
[editovat | editovat zdroj]

Dioxiny představují ekologicky nejproblematičtější organické sloučeniny chloru. Tímto termínem jsou označovány dvě skupiny látek: Polychlorované dibenzo-para-dioxiny a dibenzofurany, jejichž základní skelet ukazují připojené obrázky. Záměnou jednoho nebo několika vodíkových atomů za atomy chloru vznikají sloučeniny, které jsou obvykle označovány souhrnným názvem dioxiny. Tyto látky se vyznačují jak značnou přímou toxicitou, jsou však i silně mutagenní i karcinogenní.
Tyto sloučeniny se průmyslově nevyrábějí, vznikají jako nechtěné příměsi při chemické syntéze jiných aromatických chlorovaných látek. Často uváděným příkladem je defoliant Agent Orange, který byl ve Vietnamské válce masově rozprašován americkou armádou na tropické pralesy s cílem zbavit vegetaci listů. Přestože dioxiny nejsou originálně složkou této směsi, vyskytovaly se zde v relativně značném množství díky nedokonalému čištění základních složek[zdroj?]. Dodnes jsou ve Vietnamu oblasti, kde je půda natolik zatížena těmito látkami, že ji nelze zemědělsky využívat. Daleko tragičtější jsou však tisíce případů mrtvě narozených dětí, dětí narozených s hrůznými deformitami, extrémní nárůst případů onemocnění rakovinou v postižených oblastech. Problémy se nevyhnuly ani americkým vojákům a řada veteránů Vietnamské války vykazovala podobné syndromy jako vietnamští domorodci. To vše je dáváno do souvislosti s dlouhodobým kontaktem postižených osob s dioxiny obsaženými v Agent Orange.
Jedna ze složek Agent Orange (2,4,5-T) se od roku 1965 vyráběla i v Československu v chemičce Spolana Neratovice. Během krátké doby v důsledku kontaminace dioxiny vážně onemocněly desítky zaměstnanců Spolany, kteří se podíleli na výrobě pesticidu.[9]

Rozhodně nejvýznamnějším zdrojem dioxinů v životním prostředí je spalování organických sloučenin, především komunálního odpadu. Důvodem je především fakt, že aromatické benzenové jádro je značně stálé a při spalování organických sloučenin dochází k přednostní oxidaci běžných uhlovodíků. Benzenový skelet přitom často zůstává nedotčen a jeho reakcí s kyslíkem a chlorem vznikají dioxiny.
- V současné době jsou spalovny komunálního odpadu konstruovány tak, aby v plynných emisích došlo k destrukci valné většiny vznikajících dioxinů. Dosahuje se toho převážně tak, že spaliny z primárního spalování odpadu vstupují do druhého spalovacího stupně, ve kterém je obvykle zvýšena teplota' na 1 500 °C i více[zdroj?]. Kombinací vysoké teploty spalování a prodloužené doby pobytu organických sloučenin v prostředí o extrémně vysoké teplotě lze dosáhnout prakticky kompletní oxidace přítomných dioxinů. Pro zajímavost lze uvést, že pražská spalovna komunálního odpadu je vybavena ještě dalším, třetím spalovacím stupněm. Všechny spalovny jsou navíc ze zákona pravidelně kontrolovány a obsah dioxinů ve spalinách je monitorován. Měření jsou většinou prováděna po dobu 18 hodin dvakrát ročně. Dioxiny zůstávají velkým problémem v popílcích a dalších odpadech z čištění spalin.[10]
- Bylo prokázáno, že vliv jednotlivých kongenerů dioxinů na živé organizmy se podstatně liší. Pro zjednodušení byl vybrán jeden z nich – 2,3,7,8-tetrachlorodibenzen-p-dioxin (obrázek) a při uvádění koncentrace dioxinů v analytickém vzorku jsou obvykle obsahy všech přítomných dioxinů vztahovány k této sloučenině.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Chlorine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ http://www.national-geographic.cz/detail/zivot-na-zemi-umoznilo-i-zasadni-odsoleni-pred-miliardami-let-42608/ Archivováno 11. 6. 2013 na Wayback Machine. – Život na Zemi umožnilo i zásadní odsolení před miliardami let
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 1.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1042–1043.
- ↑ Varování před konzumací doplňku stravy MIRACLE MINERAL SUPPLEMENT [online]. [cit. 2020-03-31]. Dostupné v archivu pořízeném dne 2020-06-03.
- ↑ Inspekce varuje před přípravkem Miracle Mineral Supplement [online]. Dostupné online.
- ↑ GREENWOOD, Norman Neill. Chemie prvků. Sv. 2.. 1. vyd. vyd. Praha: Informatorium 793 s., 1 příl s. Dostupné online. ISBN 80-85427-38-9, ISBN 978-80-85427-38-7. OCLC 320245801 S. 1068–1074.
- ↑ Spolana Neratovice
- ↑ Spolchemie
- ↑ Miroslav Šuta: Agent Orange a Spolana Archivováno 18. 7. 2011 na Wayback Machine., Literární noviny, č. 24/2008
- ↑ Chráněná krajinná oblast byla kontaminována popílkem za peníze Evropské unie [online]. Arnika, 2005-11-01 [cit. 2020-06-03]. Dostupné online.
Literatura
[editovat | editovat zdroj]- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu chlor na Wikimedia Commons
Obrázky, zvuky či videa k tématu chlor na Wikimedia Commons  Slovníkové heslo chlor ve Wikislovníku
Slovníkové heslo chlor ve Wikislovníku- (česky) Chemický vzdělávací portál
- Miroslav Šuta: Chemické látky v životním prostředí a zdraví, Ekologický institut Veronica, Brno 2008, ISBN 978-80-87308-00-4
- Stránky sdružení evropských výrobců chlóru a hydroxidů Eurochlor (anglicky)
- (anglicky) Chlorine – National Institute for Occupational Safety and Health
- Agency for Toxic Substances and Disease Registry: Chlorine
- Electrolytic production
- Production and liquefaction of chlorine
- Chlorine Production Using Mercury, Environmental Considerations and Alternatives





