Vand
|
Vand | |
|---|---|
| Synonymer | Is (fast form), vanddamp (gasform) |
| Struktur | 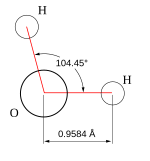
|
| Kuglekalot-model | 
|
| Sumformel | H2O |
| Farve | Svagt blå. |
|
Fysiske egenskaber | |
| Molvægt | 18,016 g/mol |
| Smeltepunkt | 0,00°C |
| Kogepunkt | 100,0 °C |
| Massefylde | 0,9970 g/cm3 (stuetemp.) |
| Varmefylde | 4,18 kJ/(kg*K) |
|
Syre/base-egenskaber | |
| pKa | 13,995 |
|
Diverse | |
| CAS-nummer | 7732-18-5 |
| E-nummer | Intet E-nummer |



Vand er en kemisk forbindelse, der er flydende ved stuetemperatur og under standardtryk. Vand er fast ved temperaturen under 0. Det har den kemiske formel H2O, hvilket betyder, at ét vandmolekyle er sammensat af to hydrogenatomer og ét oxygenatom. Vand findes næsten overalt på Jorden og er nødvendigt for alle kendte livsformer. Ca. 71% af Jordens overflade er dækket af vand. Vand i fast form kaldes is og vand i gasform kaldes (vand)damp.[1]
Kemikere omtaler ofte i spøg vand som dihydrogen monoxid eller DHMO, der er det systematiske navn for dette molekyle i det kemiske fagsprog. Det sker især i parodier på kemisk forskning, som kræver denne “dødelige kemiske forbindelse” forbudt.[2] Et accepteret og brugt IUPAC-navn er oxidane, men det bruges sjældent andre steder.[3][4]
Tripelpunkt
[redigér | rediger kildetekst]Temperaturenhederne (tidligere °Celsius, nu Kelvin) er fastlagt ud fra vands tripelpunkt: 273,16 K (= 0,01 °C) og 611,2 Pa er den temperatur og det tryk, hvor vand i alle tre tilstandsformer findes samtidig, også kaldet faser (is, vand og damp), og er i ligevægt med hinanden.
Ved temperaturer højere end 647 K og et tryk større end 22.064 Mpa vil en samling vandmolekyler gå over i en superkritisk tilstand, hvor det er muligt at ændre temperatur og tryk, så man går fra væskeformigt til dampformigt vand uden en faseovergang. Det er altså ikke klart, hvor grænsen mellem væskeformigt og dampformigt vand går over det kritiske punkt.
Hydrosfære
[redigér | rediger kildetekst]Hydrosfæren er en betegnelse for alt det vand, der er på Jorden, uanset fase. Jordens hydrosfære er beregnet til at være ca. 1.360.000.000 km3. Oceanerne udgør 97 % af hydrosfæren, resten udgøres af floder og søer, grundvand, kryosfæren (is), vanddamp i atmosfæren, krystalvand i mineraler og bjergarter samt vandet i de levende organismer. Jordens ældste vand er fundet i Canada 2,4 km under overfladen.[5] Andre himmellegemer kan også have hydrosfærer, f.eks. kometer, Merkur, jupitermånen Europa, saturnmånen Enceladus og uranusmånen Oberon, men Jorden er indtil nu den eneste vandverden, vi kender i detaljer.
Vandflade er en samlet betegnelse for
Jordens hydrosfære er formentlig "genbrug" fra kometer, asteroider og andre "snavsede snebolde", himmellegemer, der for 4,1 til 3,85 milliarder år siden under "Det Store Bombardement" bidrog med det meste af klodens vand. Det er stadig et helt åbent spørgsmål om det store bombardement har haft en direkte indflydelse på det aller-tidligste liv - for eksempel som at plante livet på Jorden eller som den aller-første masseudslettelse.
Egenskaber
[redigér | rediger kildetekst]Vands dipolære karakter
[redigér | rediger kildetekst]Et vigtigt træk ved vand er dets polære karakter. Vandmolekylet danner en vinkel med brintatomerne for enden af 'benene' og iltatomet ved vinkelspidsen. Da ilt har en højere elektronegativitet end brint, får iltenden af molekylet en negativ ladning i forhold til brintenden. Et molekyle med sådan en forskel i ladning kaldes en dipol. Den samme forskel gør, at vandmolekylerne tiltrækker hinanden (de forholdsvis positive brintender tiltrækkes af de forholdsvis negative iltender) og andre polære molekyler. Denne tiltrækning er kendt som brintbinding eller hydrogenbinding. Vand kan betragtes som en polymer af vandmolekyler.
Den forholdsvis svage tiltrækning (set i forhold til de kovalente bindinger inden i vandmolekylet selv) medfører fysiske egenskaber f.eks. et meget højt kogepunkt, da der kræves en hel del varmeenergi for at bryde brintbindingerne mellem molekylerne. Svovl er grundstoffet lige neden under ilt i det periodiske system, men dets tilsvarende forbindelse, svovlbrinte (brintsulfid, H2S), har ikke brintbindinger, og selv om stoffet har dobbelt så høj en molekylvægt som vand, optræder det som gas ved stuetemperatur. Den ekstra binding mellem vandmolekylerne giver desuden vand en høj varmekapacitet.
Andre konsekvenser af vands hydrogenbindinger er vands høje varmefylde, smeltevarme og fordampningsvarme, der medfører at flydende vand virker som en varmepuffer, der stabiliserer Jordens temperatur.
Derudover giver brintbindingerne vand en usædvanlig reaktion, når det fryser. Væsken bliver – som hos de fleste andre materialer – mere tung med faldende temperatur. Men i modsætning til de fleste andre stoffer medfører brintbindingerne, at molekylerne under den omflytning, der sker for at mindske deres energi ved afkøling tæt på frysepunktet, i stedet danner en struktur, der fylder mere og har en lavere massefylde: derfor kan den faste form, is, flyde på vand. Mens de fleste andre stoffer krymper ved overgang til fast form, udvider vand sig, når det størkner. Flydende vand har sin største tæthed (vægt) ved en temperatur på 4 °C. Det har en interessant konsekvens for vandlevende væsner ved vintertide. Vand, som afkøles ved overfladen, bliver tungere og synker ned. Det fremkalder konvektionsstrømme, der afkøler hele vandmassen, men når vandets temperatur kommer under 4 °C, bliver vandet på overfladen lettere og flyder ovenpå som et lag, der til sidst danner is. Da den nedadgående konvektionsstrømning af koldt vand blokeres, når skiftet i vægt finder sted, vil enhver større vandmasse, der fryser til om vinteren, have hovedparten af sit vand i flydende form ved 4 °C neden under isoverfladen.
Dette gør det muligt for fisk og andre dyr at overleve under isen. Det er i øvrigt også ét af de vigtigste eksempler på de fint afpassede fysiske egenskaber, som understøtter liv på Jorden. Det bruges som begrundelse for det antropo-kosmologiske princip. En yderligere konsekvens er, at is smelter, når den kommer under tilstrækkeligt tryk.
Vands dipolære karakter medfører desuden, at mange ioner i vandig opløsning krystalliserer til fast stof under systematisk indlejring af vandmolekyler i krystalstrukturen. Man kalder vandmolekyler, der sidder mellem ionerne i en krystals iongitter, for krystalvand. Normalt kan man ikke se på en krystal eller et salt, om det indeholder krystalvand, men hvis et stof med krystalvand opvarmes, kan man både se og høre, at krystalvandet undviger fra iongitteret. I forbindelse hermed ændres gitterstrukturen.
Vand som opløsningsmiddel
[redigér | rediger kildetekst]Vand er også et godt opløsningsmiddel på grund af dets polaritet og dets evne til at danne hydrogenbindinger. Når en forbindelse i ionform eller polær form blandes med vand, bliver den omgivet af vandmolekyler. Deres relativt ringe størrelse tillader typisk mange vandmolekyler at samle sig om ét molekyle af det opløste stof. De delvis negative dipoler i vandet tiltrækkes af de positivt ladede dele af stoffet og omvendt for de positive dipoler.
I almindelighed kan ioniserede og polære stoffer som f.eks. syrer, alkoholer og salte let opløses i vand, modsat ikke-polære stoffer som fedtstoffer og olier. De ikke-polære molekyler samles i vandet, da det er energimæssigt mere fordelagtigt for vandmolekylerne at bindes til hinanden ved brintbindinger snarere end at danne van der Waals-forbindelser med ikke-polære molekyler. Et eksempel på et ioniseret stof er bordsalt (natriumklorid, NaCl); stoffet deles i Na+-kationer og Cl--anioner, der begge omgives af vandmolekyler. Derefter kan ionerne let flyttes fra deres krystalgitter ud i opløsningen. Et eksempel på et ikke-ioniseret stof er sukker. Vand-dipolerne knyttes ved hjælp af brintbindinger til dipolære områder af sukkermolekylet og tillader, at det føres ud i opløsningen.
Vandets evne til at opløse stoffer er afgørende i biologiske sammenhænge, da mange stofskifteprocesser kun kan foregå i opløsning (f.eks. reaktionerne i cytoplasmaet og i blodet).
Sammenhængsevne og overfladespænding
[redigér | rediger kildetekst]
Hydrogenbindingerne giver vandet en stor sammenhængsevne og derfor også en høj overfladespænding. Dette ses klart, når små mængder vand anbringes på en overflade, der ikke kan opløses, og vandet samler sig i dråber. Denne egenskab er vigtig for vandets transport op gennem vedkarrene i planternes stængler. De stærke bindinger mellem molekylerne holder vandsøjlen sammen og udligner trykforskelle gennem sugekraften, der er fremkaldt af fordampning fra plantens overflade. Andre væsker med en lavere overfladespænding ville have tilbøjelighed til at blive revet fra hinanden, hvad der kunne fremkalde vakuum eller luftlommer og gøre transport i vedkarrene umulig.
Et specielt udtryk for vands egenskaber er den såkaldte “vandbro”.[6]
Varmefylde
[redigér | rediger kildetekst]Bemærk at flydende vand (H2O) har en ganske høj varmefylde i forhold til andre stoffer der er almindelige på jordoverfladen. Dette er grunden til at klimaet i egne der er omgivet af meget hav, f.eks. Danmark, er mere temperatur-stabilt end det mere ekstreme fastlandsklima. Man kunne sige at vand er en varmepuffer, der begrænser temperaturens udsving på Jorden.
Isens massefylde
[redigér | rediger kildetekst]En af de interessante egenskaber ved H2O er, at is har en mindre massefylde (densitet) end vand. Vands massefylde er på præcis 1,000 g/cm3 ved 3,8 grader Celsius, mens massefylden af is er 0,917 g/cm3 ved 0 grader Celsius. Årsagen er, at isen har en åben krystalstruktur. H2O er et af de få stoffer, der har denne egenskab.
Putter man f.eks. en isterning ned i et glas vand, vil man iagttage, at isterningen flyder i vandoverfladen, hvilket netop skyldes massefyldeforskellen mellem is og vand.
Denne usædvanlige opførsel har stor betydning for livet i søer og have. Om vinteren fryser åbne vande til fra oven. Det opbyggede islag virker herefter som isolator, der forhindrer bundfrysning på nær i meget lavvandede søer og have. Det betyder, at vandlevende dyr kan overleve måneders isdække.
En af ulemperne ved, at H2O udvider sig ved overgangen fra flydende til fast form, er faren for frostsprængning af vandrør og vandbeholdere. Om vinteren er det derfor nødvendigt at holde temperaturen lidt over 0 °C i alle huse eller at tømme rør og beholdere for vand.
Ledeevne
[redigér | rediger kildetekst]Rent vand er i virkeligheden isolerende, dvs., at det ikke leder elektrisk strøm særlig godt. Da vand er så effektivt et opløsningsmiddel, indeholder det oftest nogle stoffer i opløsning (f.eks. forskellige salte). Hvis vand har den slags urenheder i sig, er det derimod en god leder for elektrisk strøm. Fordi der er frie ioner i vandet, der bliver elektrisk ladede.
Elektrolyse
[redigér | rediger kildetekst]Vand skilles i sine to bestanddele, brint og ilt, når en elektrisk strøm passerer gennem det. Processen kaldes elektrolyse. Vandmolekyler dissocierer naturligt i H+- og OH--ioner, der trækkes hen mod henholdsvis katoden og anoden. Ved katoden optager to H+ ioner hver en elektron og danner H2 gas (brint). Ved anoden samles fire OH--ioner og frigiver O2 gas (ilt), molekylært vand og fire elektroner. Gasserne bobler op mod overfladen og kan samles op der.
Reaktion
[redigér | rediger kildetekst]Kemisk set er vand amfoterisk: det er i stand til at virke både som syre og base. Ved et pH på 7 (neutral) er koncentrationen af hydroxyd-ioner (OH-) lig med mængden af hydronium- (H3O+) og brintioner (H+) tilsammen. Hvis denne ligevægt forskydes, bliver vandet surt (højere koncentration af hydronium- og brintioner) eller basisk (højere koncentration af hydroxidioner).
I teorien har rent vand et pH på 7, men i virkeligheden er det svært at skaffe helt rent vand. Når vand er i kontakt med luft selv i kort tid, opløser det CO2 og danner en fortyndet kulsyre. Det medfører en pH-sænkning til ca. 5,7 ved normalt atmosfærisk partialtryk af CO2. Højere partialtryk af CO2 medfører lavere pH, mens lavere partialtryk medfører højere pH (op til pH 7 ved partialtryk på 0), jf. havenes forsuring ved den globale stigning af asmosfærens CO2-indhold.
Vandrensning
[redigér | rediger kildetekst]
Renset vand bruges til mange industrielle formål, men også i husholdningen. Mennesker har brug for vand, der ikke indeholder alt for meget salt eller andre urenheder. De almindeligste urenheder omfatter kemikalier og skadelige bakterier. Nogle slags opløste stoffer er acceptable eller tilmed ønskværdige for at fremhæve smagen. Vand, der er egnet til drikkebrug, kaldes drikkevand. Gængse metoder til rensning af vand er:
- Filtrering, hvor vandet passerer en si med tilstrækkeligt fin maskestørrelse. Selv om filtrering ikke renser vand, kan det være et nødvendigt første skridt for at undgå, at partikler forhindrer den egentlige rensning.
- Kogning, hvor vandet bringes i kog længe nok til at uskadeliggjort eller dræbe mikroorganismer. Kogning kan også fjerne ”"hårdhed"” i vandet ved, at kalk udfældes som kedelsten. Metoden fjerner dog ikke andre mineralske stoffer fra vandet.
- Filtrering med aktivt kul (se trækul). Det er den mest brugte metode til rensning af vand i husholdninger og akvarier.
- Destillation, hvor vandet bringes i dampform ved kogning, hvorefter dampen fortættes under afkøling. På denne måde kan man levere næsten helt rent vand (99,9%), men enkelte stoffer vil dog følge med vanddampen og fortættes sammen med den. Se alkohol.
- Omvendt osmose er en metode, hvor man udnytter en såkaldt halvgennemtrængelig hinde (semipermeabel membran). Ved normal osmose vil vandet af egen kraft bevæge sig gennem hinden i retning fra den svageste til den stærkeste koncentration af opløste stoffer. Ved omvendt osmose sætter man den forurenede vandmængde under et tryk, der er stærkt nok til at presse vandet i modsat retning. Hinden bruges altså som et filter.
- Demineralisering er en proces, hvor vandet passerer et filter med harpiksagtige stoffer, der binder metalioner. På den måde kan man fremstille store mængder blødt, om end ikke helt rent, vand.
Danmark anvender 750 millioner kubikmeter drikkevand om året, heraf 170 millioner kubikmeter i industri.[7]
Mytologi
[redigér | rediger kildetekst]Netop fordi vand er nødvendigt for livet på Jorden, har det altid haft en central rolle i mytologi og folkesagn.
Førhen dansede mange nordamerikanske indianerstammer regndans i tørketider i håb om, at det ville bringe dem regnvand. Bibelen har historien om syndfloden, der truer med at udrydde livet på Jorden, hvilket Noas ark forhindrer. Et andet bibelsk eksempel er, da Moses får havet til at dele sig og danne en tør flugtvej, ad hvilken han og hans følge kan undslippe Faraos hær.
Nogle religioner havde havguder. Nordboernes havgud hed Njord, romernes Neptun og grækernes Poseidon.
Vand er blevet opfattet som et af de grundelementer, alt er opbygget af. Ifølge kelterne var grundelementerne: jord, vand og ild. De fire klassiske græske elementer var jord, vand, luft og ild, og de fem kinesiske grundelementer var metal, træ, vand, luft og ild.

Se også
[redigér | rediger kildetekst]Referencer
[redigér | rediger kildetekst]- ^ den store danske vand - Molekylets fysiske egenskaber og kredsløb - lex.dk
- ^ www.dhmo.org (engelsk)
- ^ iupac.org: Red Book 2005 Citat: "...[side 85] H2O oxidane b,c...", backup
- ^ pubchem.ncbi.nlm.nih.gov: water Synonyms Citat: "...oxidane..."
- ^ This strange, ancient water in Canada could host 'alien' life. ScienceAlert
- ^ Forskerens favorit: Den flydende vandbro. Videnskab.dk 2019
- ^ Henrik Vinther Nielsen (17. oktober 2024). "Region Hovedstaden mangler rent drikkevand: Novo Nordisk presser ressourcerne". Ingeniøren.
Eksterne henvisninger
[redigér | rediger kildetekst]| Søsterprojekter med yderligere information: |
- K. Høeg-Smith & S. Brogaard: "The Energy of Raindrops" (Geografisk Tidsskrift, bind 75 (1976); s. 24-29)
- Water, Ice, and Vapour - vands forunderligere egenskaber (engelsk)
- Viden om vand Arkiveret 26. september 2007 hos Wayback Machine – Permanent tema på PDFnet.
- Flydende vands massefylde som funktion af temperaturen Arkiveret 2. juni 2004 hos Wayback Machine
- Universets største vandreservoir Arkiveret 5. marts 2012 hos Wayback Machine
- http://www.worldwaterforum.org/
- http://www.unesco.org/water/wwap/
- http://unesdoc.unesco.org/images/0012/001295/129556e.pdf
- http://www.physics.adelaide.edu.au/%7Edkoks/Faq/General/hot_water.html Arkiveret 21. januar 2013 hos Wayback Machine ~ Kan varmt vand fryse hurtigere end koldt?
- Water Structure and Behavior. Martin Chaplin Citat: "...Liquid water...is the most remarkable substance...A number of explanations of the complex behavior of liquid water have been published, many quite recently..."
- 2004-07-14, Sciencedaily: Some Of The Biggest Raindrops On Record Found In Both Clean And Dirty Air Citat: "...The largest ones were at least 8 millimeters in diameter..."
- En humorisitsk side om hvor farligt vand er
- Sådan renser vi regnvandet mest effektivt. Videnskab.dk 2013
- Oldest Water on Earth Found Deep Underground. Livescience
- Vand fryser til is ved minus 41 grader Celsius | Ingeniøren
| Infoboks uden skabelon Denne artikel har en infoboks dannet af en tabel eller tilsvarende. |
