Isoeugenol
Isoeugenol gehört zur Stoffgruppe der Phenylpropanoide und ist eine gelbliche Flüssigkeit mit charakteristischem Geruch nach Gewürznelke. Es kommt natürlich als Gemisch aus cis- und trans-Isomer vor, wobei der Anteil des trans-Isomers überwiegt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
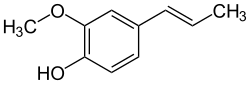
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Isoeugenol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H12O2 | |||||||||||||||||||||
| Kurzbeschreibung |
gelbliche viskose Flüssigkeit mit charakteristischem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 164,20 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,077 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
266–268 °C[2] | |||||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[2] | |||||||||||||||||||||
| Brechungsindex |
1,5739 (19 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen
BearbeitenIsoeugenol kommt natürlich in hoher Konzentration in Kalmus (Acorus calamus)[5] sowie auch Perilla (Perilla frutescens),[5] Muskatnuss (Myristica fragrans),[5][6] Basilikum (Ocimum basilicum),[5] Einjährigem Beifuß (Artemisia annua),[5] Zimt (Cinnamomum verum),[5] Kassien (Cinnamomum aromaticum),[5] Gewürznelken,[6] Dost (Origanum sipyleum),[5] Amerikanischen Heidelbeeren (Vaccinium corymbosum),[5] Dill,[6] Tabak (Nicotiana tabacum),[5] Reis (Oryza sativa),[5] Bay (Pimenta racemosa),[5] Arabica-Kaffee (Coffea arabica),[5] Ylang-Ylang-Öl,[6] Ingwer (Zingiber officinale)[5] und Piment (Pimenta dioica)[5] vor.
Eigenschaften
BearbeitenDurch Isomerisierung von Eugenol (1) zu Isoeugenol (2) mittels Alkalien und anschließender Oxidation durch Kaliumpermanganat oder Ozon lässt sich Vanillin technisch gewinnen.[7][8]
Der Flammpunkt von Isoeugenol liegt bei > 150 °C.[2]
Analytik
BearbeitenZur qualitativen und quantitativen Bestimmung der Substanz kann die Kopplung der HPLC mit der Massenspektrometrie nach angemessener Probenvorbereitung eingesetzt werden.[9][10]
Toxizität
BearbeitenIsoeugenol ist nicht gentoxisch[11], aber verursacht hepatozelluläre Karzinome und Adenome nach oraler Gabe bei männlichen Mäusen.[12] Es ist sowohl ein Antioxidans als auch ein Prooxidans; auf Letzterem beruht wahrscheinlich seine (schleim)hautreizende, allergiefördernde Wirkung.[13]
Rechtliches
BearbeitenWegen des (haut-)sensibilisierenden und allergenen Potentials ist Isoeugenol kennzeichnungspflichtig (Anlage 2 der Kosmetik-Verordnung), wenn es zu mehr als 0,001 % in Produkten die auf der Haut verbleiben oder zu mehr als 0,01 % in Produkten, die wieder abgespült werden enthalten ist.
Trivia
BearbeitenDer spätere Nobelpreisträger für Chemie Otto Hahn wurde mit einer Arbeit über die Bromderivate des Isoeugenols promoviert.
Einzelnachweise
Bearbeiten- ↑ Eintrag zu ISOEUGENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Mai 2020.
- ↑ a b c d e f g h i Eintrag zu Isoeugenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Dezember 2019. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-312.
- ↑ Eintrag zu Isoeugenol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d e f g h i j k l m n o ISOEUGENOL (englisch). In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 3. Januar 2022.
- ↑ a b c d Yong-Hong Li, Zhi-Hao Sun, P. u. Zheng: Determination of Vanillin, Eugenol and Isoeugenol by RP-HPLC. In: Chromatographia. Band 60, Nr. 11-12, Dezember 2004, S. 709, doi:10.1365/s10337-004-0440-4.
- ↑ Gary M. Lampman, Jennifer Andrews, Wayne Bratz, Otto Hanssen, Kenneth Kelley, Dana Perry, Anthony Ridgeway: The Preparation of Vanillin from Eugenol and Sawdust, in: Journal of Chemical Education, 1977, 54 (12), S. 776–778 (doi:10.1021/ed054p776).
- ↑ Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 504.
- ↑ Ye L: Development and validation of a LC-MS/MS method for the determination of isoeugenol in finfish. Food Chem. 2017 Aug 1;228:70-76, Erratum in: Food Chem. 2017 Dec 15;237:1236, PMID 28317779.
- ↑ Srivastava D, Cohen DE: Identification of the constituents of balsam of peru in tomatoes. Dermatitis. 2009 Mar-Apr;20(2):99-105, PMID 19426616.
- ↑ M. C. Munerato, M. Sinigaglia, M. L. Reguly, H. H. de Andrade: Genotoxic effects of eugenol, isoeugenol and safrole in the wing spot test of Drosophila melanogaster, in: Mutation Research, 2005, 582 (1–2), S. 87–94 (PMID 15781214).
- ↑ Toxicology and carcinogenesis studies of isoeugenol (CAS No. 97-54-1) in F344/N rats and B6C3F1 mice (gavage studies) Natl Toxicol Program, Tech Rep Ser. 2010 Sep;(551):1–178. PMID 21372857. PDF.
- ↑ T. Atsumi, S. Fujisawa, K. Tonosaki: A comparative study of the antioxidant/prooxidant activities of eugenol and isoeugenol with various concentrations and oxidation conditions, in: Toxicol Vitro, 2005, 19 (8), S. 1025–1033 (PMID 15964168).
