Frontalin
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
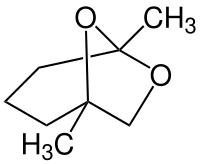
| ||||||||||
| (−)-Isomer | ||||||||||
| Allgemeines | ||||||||||
| Name | Frontalin | |||||||||
| Andere Namen |
1,5-Dimethyl-6,8-dioxabicyclo[3.2.1]octan | |||||||||
| Summenformel | C8H14O2 | |||||||||
| Kurzbeschreibung |
farblose ölige Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 142,20 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Siedepunkt | ||||||||||
| Brechungsindex |
1,4368 (24 °C, (−)-Isomer)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Frontalin ist eine natürlich vorkommende organische Verbindung. Es handelt sich um ein Terpenoid und Acetal und wirkt bei Borkenkäfern und Elefanten als Pheromon.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Frontalin kommt als Aggregationspheromon bei Borkenkäfern der Gattung Dendroctonus vor. Dazu gehören Dendroctonus frontalis (Southern Pine Beetle) und Dendroctonus brevicomis (Western Pine Beetle), sowie Dendroctonus ponderosae (Bergkiefernkäfer).[5] Biologisch aktiv ist meist das (–)-Frontalin.[5] Zum Teil kommt jedoch auch (+)-Frontalin vor. Bei Dendroctonus frontalis bildet das Weibchen hauptsächlich (–)-Frontalin, das Männchen hauptsächlich (+)-Frontalin. Bei Dendroctonus rufipennis ist die Verteilung umgekehrt.[6]
Neben dem Vorkommen in Insektenpheromonen, dient es auch bei Asiatischen Elefanten als Pheromon. Es wird von erwachsenen männlichen Elefanten in der Musth abgesondert, wobei die Menge mit dem Alter zunimmt. Es zeigt die Paarungsbereitschaft an, worauf insbesondere Weibchen reagieren, die ebenfalls paarungsbereit sind, da sie sich im passenden Stadium des Sexualzyklus befinden.[7]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Viele Pheromone in Borkenkäfern sind von Terpenen aus den Wirtspflanzen abgeleitet, dies ist bei Frontalin jedoch nicht der Fall. Die Biosynthese in Dendroctonus jeffreyi und anderen Arten der Gattung wurde mittels Isotopenmarkierungen untersucht. Ausgangspunkt der Biosynthese ist vermutlich Acetat. Wahrscheinliche Intermediate sind Geranylpyrophosphat und 6-Methyl-6-hepten-2-on.[6]
Synthese
[Bearbeiten | Quelltext bearbeiten]Beide Enantiomere des Frontalins können ausgehend vom Ester des 8-Phenylmenthols mit Brenztraubensäure hergestellt werden. Die Alkoholkomponente dient als chirales Auxiliar. An das Edukt kann in Gegenwart von Lithiumperchlorat Methylmagnesiumbromid addiert werden. Die so erhaltene Hydroxygruppe kann mit dem Cornforth-Reagenz (Pyridiniumdichromat) oxidiert werden, um anschließend eine Grignard-Verbindung zu addieren, die aus 5-Brom-2-methylpent-1-en hergestellt wird. Durch Reduktion mit Lithiumaluminiumhydrid wird das chirale Auxiliar abgespalten und ein Diol erhalten. Reaktion mit Ozon und reduktive Aufarbeitung mit Dimethylsulfid ergibt (-)-Frontalin. Durch Tauschen der Grignard-Reagenzien, das heißt, indem Methylmagnesiumbromid als zweites addiert wird, kann das (+)-Frontalin hergestellt werden.[5]
Eine alternative Synthese beginnt mit einer Diels-Alder-Reaktion von Methylvinylketon und Methylmethacrylat. Der Methylester kann durch Lithiumaluminiumhydrid zur Hydroxymethylgruppe reduziert werden. Durch Oxymercurierung mit Quecksilber(II)-acetat und Kaliumhydroxid / Natriumborhydrid kann die Doppelbindung hydroxyliert werden, und das Intermediat cyclisiert direkt zu Frontalin.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Miguel Yus, Diego J. Ramón, Oscar Prieto: (−)‐Frontalin: Synthesis using the Catalytic Enantioselective Addition of Dimethylzinc to a Ketone. In: European Journal of Organic Chemistry. Band 2003, Nr. 15, 2003, S. 2745–2748, doi:10.1002/ejoc.200300261.
- ↑ a b c J. D. Connolly, Connolly/Hill, R. A. Hill: Dictionary of Terpenoids. Taylor & Francis, 1991, ISBN 978-0-412-25770-4, S. 6 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yutaka Nishimura, Kenji Mori: A New Synthesis of (−)-Frontalin, the Bark Beetle Pheromone. In: European Journal of Organic Chemistry. Band 1998, Nr. 2, 1998, S. 233–236, doi:10.1002/(SICI)1099-0690(199802)1998:2<233::AID-EJOC233>3.0.CO;2-M.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c James K. Whitesell, Charles M. Buchanan: Synthesis of (-)- and (+)-frontalin. In: The Journal of Organic Chemistry. Band 51, Nr. 26, Dezember 1986, S. 5443–5445, doi:10.1021/jo00376a081.
- ↑ a b Lana S. Barkawi, Wittko Francke, Gary J. Blomquist, Steven J. Seybold: Frontalin: De novo biosynthesis of an aggregation pheromone component by Dendroctonus spp. bark beetles (Coleoptera: Scolytidae). In: Insect Biochemistry and Molecular Biology. Band 33, Nr. 8, August 2003, S. 773–788, doi:10.1016/S0965-1748(03)00069-9.
- ↑ L.E.L. Rasmussen: Frontalin: a Chemical Message of Musth in Asian Elephants (Elephas maximus). In: Chemical Senses. Band 28, Nr. 5, 1. Juni 2003, S. 433–446, doi:10.1093/chemse/28.5.433.
- ↑ Bradford P. Mundy, Rodney D. Otzenberger, A. Richard DeBernardis: Synthesis of frontalin and brevicomin. In: The Journal of Organic Chemistry. Band 36, Nr. 16, August 1971, S. 2390–2390, doi:10.1021/jo00815a048.