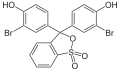
Bromotimolbluo
| Bromotimolbluo | |||

| |||

| |||

| |||
| Kemia formulo | |||
| CAS-numero-kodo | 76-59-5 | ||
| ChemSpider kodo | 6208 | ||
| PubChem-kodo | 6450 | ||
| Fizikaj proprecoj | |||
| Molmaso | 624.38 g mol−1 | ||
| Smiles | Brc1c(O)c(cc(c1C)<>C3 (OS(=O)(=O)c2ccccc23) c4cc(c(O)c(Br)c4C )C(C)C)C(C)C | ||
| Denseco | 1.25 g/cm3 (likva) | ||
| Fandopunkto | 202 °C (396 ℉; 475 K) | ||
| Solvebleco:Akvo | Nesolvebla (20 °C) | ||
| Solvebleco | Alkalo: solvebla
| ||
| Acideco (pKa) | 7.10 | ||
| Sekurecaj Indikoj | |||
| Risko | |||
| Sekureco | S25 | ||
| GHS etikedigo de kemiaĵoj[1][2] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H225, H315, H319, H335, H350, H361 | ||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P233, P240, P241, P242, P243, P261, P271, P280, P303+361+353, P308+313, P370+378, P403+235, P405, P501 | ||
(25 °C kaj 100 kPa) | |||
Bromotimolbluo aŭ bluo de bromotimolo, ankaŭ konata kiel bromotimol-sulfona ftaleino, kaj BTB, estas pH indikilo por identigo de substancoj kaj acidaj kaj bazaj. Ĝi ĉefe uzatas en aplikaĵoj necesantaj mezuradon de substancoj proksimaj al la neŭtrala pH de la akvo (proksima de 7), tiel kiel la kontrolado de la pH de naĝbanejoj kaj fiŝujoj. Ordinara uzo estas la mezurado de la ĉeesto de la karbonata acido en likvaĵo. Bromotimolbluo kutime vendiĝas laŭ solida stato de ties natria salo.
Strukturo kaj proprecoj
[redakti | redakti fonton]Bromotimolbluo agas kiel malforta acido en solvaĵo. Do, ĝi prezentiĝas en la protonigebla[3] kaj malprotonigebla[4] formoj, montriĝante aŭ flava aŭ blua respektive. En neŭtralaj solvaĵoj ĝi estas blueca verda. La malprotonigo de la neŭtrala formo rezultas en ia alte konjuga strukturo, respondeca pri la ŝanĝokoloro. Ia peranto en la malprotoniga mekanismo respondecas pri la verdeca koloro de la neŭtralaj solvaĵoj.
| Bromotimolbluo (pH indikilo) | |||||
| pH malsupra ol 6,0 | pH supra ol 7,6 | ||||
| flava | blua | ||||

La protonhava formo de la bluo de bromotimolo prezentas ties absorbo-pinto ĉe 427 nm tiele reflektante flavan lumon en acidaj solvaĵoj, kaj la malprotoniga formo prezentas ties absorbo-pinto ĉe 602 nm tiele reflektante bluan lumon en bazaj medioj.
La ĝenerala karbona skeleto de la bluo de bromotimolo estas specifa de multaj indikiloj, inkluzive de la "klorofenolruĝo", "timolbluo" kaj "bromokrezola verdo".
La ĉeesto de unu fora grupo elektrone modera (la bromatomo) kaj du moderaj pozitivaj grupoj (la alkilaj substituantoj) respondecas pri la indikiva rango de la bromotimolbluo inter 6,0 kaj 7,6. Dum la konjugado respondecas pri la longo kaj naturo de la ŝanĝokolora rango, ĉi-tiuj substituaj grupoj estas ĉefe respondecaj pri la aktiva rango de la indikilo.

Bluo de bromotimolo estas malmulte solvebla en akvo, sed solvebla en alkoholo, etero, kaj alkalaj akvaj solvaĵoj. Ĝi estas malpli solvebla en nepolaraj solvaĵoj tiel kiel benzeno, tolueno kaj ksileno, kaj praktike nesolvebla en petrola etero.
Uzoj
[redakti | redakti fonton]Bromotimolbluo uzatas por observado de fotosintezaj aktivecoj, aŭ spirindikilo (ĝi iĝas flava kiam CO2 aldoniĝas). Ordinara elmontro de la proprecoj de BTB kiel pH indikilo estas kiam oni elspiras tra neŭtrala solvaĵo enhavanta BTB-on. Laŭmezure kiel la karbona duoksido absorbiĝas el la spirado en la solvaĵon, estigante karbonatan acidon, la solvaĵo ŝankĝas koloron el verda al flava. Tiamaniere ke, BTB ordinare uzates en sciencaj lernoĉambroj por elmontri ke, ju pli oni uzas la muskolojn, des pli alta estas la nivelo de CO2.
Bluo de bromotimolo uzatas kune kun fenolruĝo por kontrolado pri la aktiveco de la fungo-asparaginaza enzimo, kiam la fenolruĝo turniĝas rozkolora kaj la BTB blua indikante per tio ian plialtigon de la pH, kaj do, de la enzimaktiveco. Tamen, pli freŝaj esploroj, sugestas ke la metilruĝo estas pli utila pri determinado de la aktiveco pro estigo de brila flava ringo en la regiono de la enzimaktiveco.
Bromotimolbluo same uzatas en laboratorio por biologia identigo de bakterioj pere de makuloj.

| Koloroj de la bluo de bromotimolo |
pH 1 fuksia |
turnopunkto pH 0 |
pH 2 flava |
turnopunkto pH 6,0 à pH 7,6 |
baza pH blua |
Literaturo
[redakti | redakti fonton]- Handbook of Acid-Base Indicators, R. W. Sabnis
- Assessment in Science: A Guide to Professional Development and Classroom ..., Daniel Shepardson
- The Yeasts: A Taxonomic Study, Cletus Kurtzman, J.W. Fell, Teun Boekhout
- Chemical Demonstrations: A Handbook for Teachers of Chemistry, Volume 3, Bassam Z. Shakhashiri
- Handbook of Biochemistry and Molecular Biology, Fourth Edition, Roger L. Lundblad, Fiona Macdonald
Vidu ankaŭ
[redakti | redakti fonton]-
Bromokrezolverdo -
Bromokrezola purpuro -
Metilenoverdo
Referencoj
[redakti | redakti fonton]- ↑ Apollo Scientific[rompita ligilo]
- ↑ LabChem. Arkivita el la originalo je 2021-09-17. Alirita 2017-06-18 .
- ↑ Protonigi: aldoni protonon (H+) al alia substanco aŭ radikalo.
- ↑ Malprotonigi aŭ senprotonigi estas forigo de protono (H+) el iu kemia substanco aŭ radikalo.