Titulación Redox
Titulación Redox
Cargado por
José Enrique Jurado MenesesCopyright:
Formatos disponibles
Titulación Redox
Titulación Redox
Cargado por
José Enrique Jurado MenesesTítulo original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Titulación Redox
Titulación Redox
Cargado por
José Enrique Jurado MenesesCopyright:
Formatos disponibles
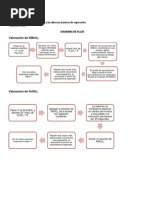
Prctica N 10: Titulacin REDOX
Las reacciones redox trasfieren electrones mientras que las reacciones cido-base transfieren protones. Del mismo modo que se pueden valorar cidos con bases se pueden titular oxidantes con un agente reductor o viceversa. El punto de equivalencia se alcanza cuando el oxidante es completamente reducido. El permanganato de potasio es un reactivo que se ha utilizado desde hace bastante tiempo como agente oxidante, debido a que puede disponer de l con facilidad, no es costoso y no se requiere de indicador a menos que se utilice en solucin diluida. Una gota de permanganato de potasio 0,1 N imparte un color rosa perceptible al volumen de solucin que por lo general se usa para una titulacin. Este color se usa para indicar el exceso de reactivo. Dado que el Mn tiene varios estados de oxidacin (2+, 3+, 4+, 6+y 7+), puede ocurrir su accin oxidante dando origen a diferentes productos. Se la reaccin ocurre en soluciones muy cidas (0,1 N o mayor), el producto que se obtiene es el in Mn+2, de acuerdo con la siguiente reaccin: MnO4 -1(ac) + 8H+(ac) + 5eMn+2(ac) + 4H2O
rosado incoloro
Pero si las soluciones son menos cidas, el producto que se obtiene es el MnO2, MnO4-1(ac) + 4H+(ac) + 3eMnO2(s) + 4H2O
rosado marrn
El estado de oxidacin 3+ del manganeso no es estable, pero los aniones formadores de complejos como el pirofosfato o el fluoruro, estabilizan el in: MnO41- (ac) + e- MnO42- (ac) + 4H2O Esta reaccin ocurre en soluciones muy alcalinas, a una concentracin de OH- de 1M. Las determinaciones permanganomtricas de oxalatos es un ejemplo clsico de reacciones en medio cido, dando origen al catin Mn+2. Existen precauciones especiales que se deben tomar para la preparacin de las soluciones de permanganato, ya que en medio neutro o bsico pueden experimentar descomposicin por los vestigios de MnO2 presentes inicialmente en el permanganato o por efecto del que se forma por la reaccin del permanganato con restos de agentes reductores presentes en el agua. Para establecer la concentracin real de una solucin de permanganato de potasio recientemente preparada es bastante comn emplear como estndar primario oxalato de sodio, Na2C2O4. Es por ello que se utiliza las tcnicas permanganomtricas para la determinacin de la concentracin de oxalatos en muestras de composicin desconocida. Material que debe traer el estudiante: Fsforos Bata de laboratorio Lentes de seguridad Pre-informe Propipeta Escriba la ecuacin balanceada del oxalato de sodio y el permanganato de potasio en medio cido. Conceptos que debe revisar para el fundamento terico: Concentracin de una solucin. Unidades de concentracin fsicas y qumicas. Tipos de reacciones qumicas Reacciones de oxido-reduccin. Mtodo de balanceo del in electrn medio cido y bsico. Titulacin Redox. Punto de equivalencia. Punto final. Tcnicas permanganomtricas. Reacciones del permanganato en medio cido y alcalino. Preparacin y almacenamiento de las soluciones de permanganato. Estabilidad de las soluciones de permanganato Reactivos auxiliares oxidantes Agente oxidante y reductor
Aplicaciones de la titulacin Redox.
Objetivos generales: Conocer la tcnica de valoracin permanganomtrica. Usar la permanganometra para el anlisis de oxalatos. Objetivos especficos: Usar la tcnica de permanganometra para el anlisis de los oxalatos. Determinar la concentracin de soluciones de permanganato. Determinar la pureza de un oxalato. Afianzar los conocimientos adquiridos en el balanceo de ecuaciones por el mtodo del in-electrn de la reaccin entre el permanganato y el oxalato. Materiales y Reactivos: Matraz aforado de 250ml Vidrio de reloj Beacker. Mechero Embudo Tela metlica. Termmetro. Cilindro graduado. Permanganato de potasio slido. Lana de vidrio. Solucin de oxalato de sodio. cido sulfrico. Parte Experimental: 1. Preparacin de una solucin de permanganato de potasio. a) Preparar 250 mL de una solucin de Permanganato de potasio 0,1 N, pesar 0.8 g de permanganato. b) Trasladar la solucin a un vaso precipitado de 500 mL y cubrirla con un vidrio de reloj. c) Calentar hasta ebullir, dejar hervir durante 10 min. d) Dejar enfriar y luego filtrar a gravedad utilizando un embudo provisto con lana de vidrio. Por qu se debe calentar la solucin? 2. Estandarizacin de la solucin de permanganato de potasio. a) Agregar 40ml de agua destilada y 2ml de cido sulfrico concentrado en un cilindro graduado. b) Pase esa solucin cida a un beacker y agregue 10ml de la solucin de oxalato de sodio que se le indica. c) Prepare la titulacin en caliente colocando la solucin de permanganato de potasio en la bureta y el vaso de precipitado sobre una rejilla, debajo de la cual debe estar un mechero. d) Determine mediante clculos matemticos el 70% del volumen de solucin de KMnO4 que podr ser necesario para pasar todo el C2O4= a CO2. e) Agregue el volumen de KMnO4 calculado sobre la solucin cida de oxalato de sodio al iniciarse la titulacin. f) Caliente el beacker entre 55 y 60C usando cuidadosamente el termmetro como agitador y termine la titulacin gota a gota, esperando antes de cada nueva adicin que se haya producido la decoloracin de la precedente, hasta lograr que el color rosa plido persista durante 30seg. g) Anote el volumen total de la solucin de KMnO4 utilizado en la titulacin. h) Calcule la normalidad de la solucin de KMnO4 (repita la experiencia 2 veces). i) Reporte el valor obtenido. 3. Determinacin del porcentaje de oxalato en una muestra problema. a) Mezcle 50ml de agua destilada con 5ml de cido sulfrico concentrado en un beacker de 250ml. b) Pese 0,10 a 0,15g de la muestra problema. c) Aada esta cantidad de muestra en el beacker del aparte a). d) Calcule el 70% del volumen de solucin de KMnO4 necesarios para pasar todo el C2O4= a CO2 (suponiendo que se trate de oxalato de sodio puro). e) Agregue el volumen de solucin KMnO4 calculado sobre la solucin cida de oxalato al iniciarse la titulacin. f) Termine la titulacin en caliente, tomando las mismas precauciones que las de la titulacin en la parte 1.f).
g) Con los datos de la normalidad y el volumen total de KMnO4 gastados, calcule el nmero equivalente gramo de KMnO4. h) Determine el numero de equivalentes gramo de C2O4=, el peso de C2O4= y el porcentaje de oxalato en la muestra. i) Repita la experiencia 2 veces. Complete, formule y balancee por el mtodo del in electrn las siguientes reacciones: a) Nitrito de potasio + permanganato de potasio+ cido sulfrico KNO3 + MnSO4 + K 2SO4 + H2O (medio cido) b) PbS (s) + perxido de hidrgeno PbSO4 + H2O (medio bsico) Bibliografa: Brown, T., Lemay, H. y Bursten, B., 1998 Qumica: La Ciencia Central. Mexico: Prentice May. Chang, R., 1992 Qumica. Mxico: Mc Graw Hill, 4 edicin. Christian, G., 1994 Analitical Chemistry. USA: John Wiley and Sons, Inc. 5 edicin. Day, R.A. y Underwood, A.L., 1998. Qumica Analtica Cuantitativa. Mxico: Prentice Hall Hispanoamericana. 5 edicin. Dean, J.A., 1973, Lances Handbook of Chemistry. New York: Mc Graw Hill. Book Co., 11 edicin. Hamilton, L., Simpson, S. Y Elli, G., 1984. Clculos de Qumica Analtica. Madrid: Mc Graw Hill, 7 edicin. Vogel, A., 1974. Qumica Analtica Cuantitativa. Argentina; E
También podría gustarte
- Laboratorio #6 Determinacion de PeroxidosDocumento9 páginasLaboratorio #6 Determinacion de Peroxidossebas48889Aún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Problemas resueltos de Hidráulica de CanalesDe EverandProblemas resueltos de Hidráulica de CanalesCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Calidad del agua para estudiantes de ciencias ambientalesDe EverandCalidad del agua para estudiantes de ciencias ambientalesAún no hay calificaciones
- Lab 6Documento9 páginasLab 6Hector VillalobosAún no hay calificaciones
- INFORME PermanganometriaDocumento20 páginasINFORME PermanganometriaMay_LOVEme0% (4)
- Lab. 4 Determinación de Óxido de CalcioDocumento13 páginasLab. 4 Determinación de Óxido de CalcioChristian JesusAún no hay calificaciones
- Determinacion Oxido de CalcioDocumento13 páginasDeterminacion Oxido de CalciobrayanAún no hay calificaciones
- Inforeme 5 Lab de Quimica AnaliticaDocumento8 páginasInforeme 5 Lab de Quimica AnaliticaJorge RuizAún no hay calificaciones
- 6 GUIA Preparacion y Valoracion de Una Solucion de Permanganato de PotasioDocumento21 páginas6 GUIA Preparacion y Valoracion de Una Solucion de Permanganato de PotasioCesar Lopez100% (2)
- Practicas 11-12-13 Con Permanganato de PotasioDocumento10 páginasPracticas 11-12-13 Con Permanganato de Potasioraquelglez125Aún no hay calificaciones
- P2 - Determinación de Las Concentraciones - RedoxDocumento7 páginasP2 - Determinación de Las Concentraciones - RedoxLucia Guzman FernandezAún no hay calificaciones
- Práctica N°12 y N°13Documento5 páginasPráctica N°12 y N°13lolo hHAún no hay calificaciones
- Lab Oratorio 11Documento10 páginasLab Oratorio 11WRETAún no hay calificaciones
- Laboratorio Q. Cuantitativa - Permanganato y HierroDocumento18 páginasLaboratorio Q. Cuantitativa - Permanganato y HierroYoselin Quispe PantojaAún no hay calificaciones
- 6 GUIA Preparacion y Valoracion de Una Solucion de Permanganato de PotasioDocumento24 páginas6 GUIA Preparacion y Valoracion de Una Solucion de Permanganato de PotasioCristhian Dany Gallardo MarianoAún no hay calificaciones
- Guia 6Documento29 páginasGuia 6AndreiAún no hay calificaciones
- Informe Analitica Volumetria Redox Agua OxigenadaDocumento5 páginasInforme Analitica Volumetria Redox Agua Oxigenadayo_como_caca_verde100% (1)
- PERMANGANIMETRÍADocumento6 páginasPERMANGANIMETRÍALuis Armando Hernandez MolinaAún no hay calificaciones
- Practica 2Documento13 páginasPractica 2homunculo19100% (1)
- Guía Laboratorio de Química Base Óxido-ReducciónDocumento9 páginasGuía Laboratorio de Química Base Óxido-ReducciónFede JimenezAún no hay calificaciones
- PERMANGANOMETRIADocumento13 páginasPERMANGANOMETRIAgabrielabeleno54Aún no hay calificaciones
- Analítica PR#8Documento5 páginasAnalítica PR#8XenatsuriAún no hay calificaciones
- Practica 5 de LaboratorioDocumento5 páginasPractica 5 de Laboratoriowhat up¡Aún no hay calificaciones
- Titulaciones Redox ImprimirDocumento6 páginasTitulaciones Redox ImprimirLina Daniela Landinez RodiguezAún no hay calificaciones
- Permanganometria MARCELADocumento4 páginasPermanganometria MARCELAjuank_1983Aún no hay calificaciones
- GVJHMJBHVDocumento8 páginasGVJHMJBHVBruno BrunoAún no hay calificaciones
- Titulación de Una Solución de Agua Oxigenada Comercial Con Permanganato de PotasioDocumento3 páginasTitulación de Una Solución de Agua Oxigenada Comercial Con Permanganato de PotasioJhonier Jesús Ruiz PèrezAún no hay calificaciones
- PermanganometriaDocumento6 páginasPermanganometriaMadelyn Garrido VillarrealAún no hay calificaciones
- Determinacion Del FeDocumento7 páginasDeterminacion Del FeLiz S. VillanuevaAún no hay calificaciones
- Guia N6)Documento16 páginasGuia N6)Jhoe LozaAún no hay calificaciones
- Permanganimetria 1Documento5 páginasPermanganimetria 1Alvaro Antonio Jara FernandezAún no hay calificaciones
- Práctica 2Documento7 páginasPráctica 2MARIO GARCÍA MARTÍNEZAún no hay calificaciones
- Analítica Práctica 6. Determinación de Peróxido de HidrógenoDocumento12 páginasAnalítica Práctica 6. Determinación de Peróxido de HidrógenoElizabeth HuamaniAún no hay calificaciones
- Práctica 7Documento5 páginasPráctica 7Rosangeles LopezAún no hay calificaciones
- Practica de Laboratorio # 1. Preparación de Una Solución 0,1 N de Permanganato de Potasio y Su Estandarización Con Oxalato de Sodio.Documento5 páginasPractica de Laboratorio # 1. Preparación de Una Solución 0,1 N de Permanganato de Potasio y Su Estandarización Con Oxalato de Sodio.oscar morales riosAún no hay calificaciones
- PermanganometriaDocumento8 páginasPermanganometriaJose Antonio Casiano PorrasAún no hay calificaciones
- Reporte DETERMINACIÓN DE PERMANGANATO DE POTASIODocumento8 páginasReporte DETERMINACIÓN DE PERMANGANATO DE POTASIOJose Antonio Silva50% (2)
- Análisis de La Pureza de H2O2 Por PermanganimetríaDocumento9 páginasAnálisis de La Pureza de H2O2 Por PermanganimetríaFredy Orlando HernándezAún no hay calificaciones
- Analitica 2do InformeDocumento26 páginasAnalitica 2do InformeFrank Jonathan Vasquez GonzalesAún no hay calificaciones
- Informe #6.1Documento10 páginasInforme #6.1williams bernacheaAún no hay calificaciones
- Determinacion Del Contenido de Calcio en Una Caliza Mediante Volumetria Redox Con Pergamanato de PotasioDocumento4 páginasDeterminacion Del Contenido de Calcio en Una Caliza Mediante Volumetria Redox Con Pergamanato de Potasionepertorres6169100% (1)
- Informe 2Documento26 páginasInforme 2cristianAún no hay calificaciones
- Prac.2 Quimica AnaliticaDocumento19 páginasPrac.2 Quimica AnaliticaNayely Arrieta García100% (1)
- Permanganometria Teoria y Aplicaciones (F)Documento14 páginasPermanganometria Teoria y Aplicaciones (F)JAVIER EDUARDO HERNANDEZ SANCHEZ100% (1)
- Determinacion Experimental Del Oxido de Calcio en El Carbonato de CalcioDocumento17 páginasDeterminacion Experimental Del Oxido de Calcio en El Carbonato de Calciojuniorsonder100% (5)
- Volume TriaDocumento17 páginasVolume TriaDaniel SantillánAún no hay calificaciones
- TP 9 Volumetría RedoxDocumento4 páginasTP 9 Volumetría RedoxCharlie NaranjaAún no hay calificaciones
- Valoracion Redox LABDocumento5 páginasValoracion Redox LABCtdm Eusebio AyalaAún no hay calificaciones
- RedoxluzarisDocumento6 páginasRedoxluzarisXipe Lab's HgAún no hay calificaciones
- Análisis Cuantitativo de Analitos Con Base en Equilibrios RedoxDocumento7 páginasAnálisis Cuantitativo de Analitos Con Base en Equilibrios RedoxDiego Emilio MorettAún no hay calificaciones
- Guía Práctica 10-Titulaciones RedoxDocumento6 páginasGuía Práctica 10-Titulaciones RedoxJorge Alejandro Escallon BurgosAún no hay calificaciones
- 7-Titulacion Redox1Documento4 páginas7-Titulacion Redox1mh8365842Aún no hay calificaciones
- Practica 2 Grupo 9BDocumento5 páginasPractica 2 Grupo 9BElías Robles GarcíaAún no hay calificaciones
- Laboratorio #13 DqoDocumento6 páginasLaboratorio #13 DqoANDREA LINETHAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- Curso Práctico de Química GeneralDe EverandCurso Práctico de Química GeneralCalificación: 4 de 5 estrellas4/5 (4)
- Allata Haccp de Helados TraducidoDocumento15 páginasAllata Haccp de Helados TraducidoJosé Enrique Jurado Meneses100% (1)
- Filosofia de La Calidad II CCDocumento31 páginasFilosofia de La Calidad II CCJosé Enrique Jurado MenesesAún no hay calificaciones
- Solicitud Seda AyacuchoDocumento1 páginaSolicitud Seda AyacuchoJosé Enrique Jurado MenesesAún no hay calificaciones
- Defectos y Enfermedades Del VinoDocumento12 páginasDefectos y Enfermedades Del VinoJosé Enrique Jurado MenesesAún no hay calificaciones
- Incre, S.A.: Procedimiento para El Control de La Documentacion Y Los Datos P-004Documento6 páginasIncre, S.A.: Procedimiento para El Control de La Documentacion Y Los Datos P-004José Enrique Jurado MenesesAún no hay calificaciones
- P 016Documento14 páginasP 016José Enrique Jurado MenesesAún no hay calificaciones
- P 011Documento1 páginaP 011José Enrique Jurado MenesesAún no hay calificaciones
- Pino CitocisDocumento1 páginaPino CitocisJosé Enrique Jurado MenesesAún no hay calificaciones
- QUELACIÓNDocumento2 páginasQUELACIÓNJosé Enrique Jurado MenesesAún no hay calificaciones