Bateria Casera
Bateria Casera
Cargado por
OmarCopyright:
Formatos disponibles
Bateria Casera
Bateria Casera
Cargado por
OmarDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Bateria Casera
Bateria Casera
Cargado por
OmarCopyright:
Formatos disponibles
DIEGO OMAR GMEZ COMISIN : 21
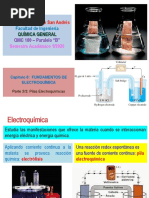
ELECTROQUMICA
La electroqumica es la rama de la ciencia que estudia la conversin entre
la energa elctrica y la energa qumica.
Los procesos electroqumicos son reacciones redox (oxidacin-reduccin) en las
cuales la energa liberada por una reaccin espontnea se convierte en
electricidad o la energa elctrica se aprovecha para provocar una reaccin
qumica no espontnea.
Reacciones Redox
En las reacciones redox se transfieren electrones de una especie a otra. La
oxidacin se define como la prdida de electrones y la reduccin como la ganancia
de electrones por un tomo. A veces la oxidacin se define como un aumento del
estado de oxidacin de un elemento y la reduccin como una disminucin del
estado de oxidacin. En una reaccin redox la oxidacin y la reduccin ocurren
simultneamente; dependen la una de la otra y el nmero total de electrones
perdido por una especie en la oxidacin debe ser igual al nmero de electrones de
electrones ganados por la otra especie en la reduccin, es decir que en una
reaccin de oxido-reduccin no hay exceso ni deficiencia de electrones.
Por ejemplo el hierro es capaz de reaccionar con el cloro de acuerdo a la
siguiente reaccin:
2 Fe + 3 Cl2
2 FeCl3
(1)
sta ecuacin se puede desdoblar en dos semirreacciones que permiten aclarar
los conceptos mencionados:
Semireaccin de Oxidacin:
Fe 0 Fe3+ + 3eSe refiere a la media reaccin donde un tomo o un grupo de tomos pierden e-.
En este caso el nmero de oxidacin del hierro (Fe) cambia de cero a +3. Como el
tomo de Fe aument su nmero de oxidacin se dice que se oxid.
DIEGO OMAR GMEZ COMISIN : 21
Semireaccin de Reduccin:
Cl2 0 + 2e- 2ClSe refiere a la media reaccin donde un tomo o un grupo de tomos ganan e-.
En este caso el nmero de oxidacin de la especie Cl 2 (0) disminuye a -1 por lo
tanto se redujo.
REDUCCIN
OXIDACIN
Ganancia de e-
Prdida de e-
Disminuye N de oxidacin
Aumenta N de oxidacin
Agente Reductor:
Agente Oxidante:
El que reduce se oxida
El que oxida se reduce
En la ecuacin (1) el agente oxidante es el Cloro, por ser la sustancia que
causa la oxidacin y como resultado su nmero de oxidacin disminuye. El agente
reductor es el
Hierro, por ser la sustancia que efecta la reduccin y en
consecuencia su nmero de oxidacin aumenta.
Como en una reaccin de xido-reduccin no hay exceso
ni deficiencia de
electrones debemos tratar de balancear la ecuacin de tal manera que los
electrones que perdi una especie sean ganados por la otra, en nuestro ejemplo:
2(Fe 0 Fe3+ + 3e-)
3 (Cl2 0 + 2e- 2Cl-)
2 Fe + 3 Cl2 + 6e-
2 Fe3+ + 6 Cl- + 6 e-
Balanceo de las ecuaciones de Oxido-Reduccin
Pretender balancear una ecuacin redox por tanteo o simple inspeccin es una
misin casi imposible. Para su balance se pueden utilizar dos mtodos: el mtodo
de in electrn y el del nmero de oxidacin.
BALANCEO DE REACCIONES REDOX POR EL MTODO DEL IN-
DIEGO OMAR GMEZ COMISIN : 21
ELECTRN
Se utiliza para ajustar reacciones que tienen lugar en disolucin. Consiste en
ajustar por separado las semirreacciones de oxidacin y de reduccin. Si las
sustancias que se oxida no se reducen presentan enlace inico se toman los iones
correspondientes. Si, por el contrario, forman enlace covalente se escribe la
molcula completa.
Procedimiento:
1. Escribir la reaccin global sin ajustar.
2. Asignar nmeros de oxidacin a todos los elementos.
3. Escribir por separado las semirreacciones de oxidacin y de reduccin.
4. Ajustar los tomos que no sean ni hidrgeno ni oxgeno.
5. Ajustar los tomos de oxgeno aadiendo molculas de agua.
6. Ajustar los tomos de hidrgeno aadiendo protones.
7. Ajustar las cargas elctricas con electrones.
8. Igualar los electrones en cada semirreaccin.
9. Sumar las dos semirreacciones eliminando los trminos comunes.
Ajuste de reacciones en medio bsico
(A partir del paso 9)
10. Aadir en ambos lados tantos OH- como protones haya.
11. Combinar los iones hidroxilo y los protones del mismo lado para formar agua.
12. Simplificar las molculas de agua.
DIEGO OMAR GMEZ COMISIN : 21
Celda Electroqumica
Es un dispositivo experimental para generar electricidad mediante una reaccin
redox espontnea (a sta celda tambin se la denomina Celda galvnica o
voltaica, en honor a los cientficos Luigi Galvani y Allesandro Volta). En la figura se
muestran los componentes fundamentales de una celda electroqumica.
Las celdas electroqumicas tienen dos electrodos: El nodo y el Ctodo.
El nodo se define como el electrodo en el que se lleva a cabo la oxidacin y el
ctodo donde se efecta la reduccin. Los electrodos pueden ser de cualquier
material que sea un conductor elctrico, como metales, semiconductores. Tambin
se usa mucho el grafito debido a su conductividad y a su bajo costo. Para
completar el circuito elctrico, las disoluciones se conectan mediante un conductor
por el que pasan los cationes y aniones, conocido como puente de sal (o como
puente salino). Los cationes disueltos se mueven hacia el Ctodo y los aniones
hacia el nodo. La corriente elctrica fluye del nodo al ctodo por que existe una
diferencia de potencial elctrico entre ambos electrolticos. Esa diferencia se mide
con la ayuda de un voltmetro y es conocida como el voltaje de la celda. Tambin
se denomina fuerza electromotriz (fem) o bien como potencial de celda. En una
DIEGO OMAR GMEZ COMISIN : 21
celda galvnica donde el nodo sea una barra de Zinc y el ctodo sea una barra de
Cobre, ambas sumergidas en soluciones de sus respectivos sulfatos, y unidas por
un puente salino se la conocen como Pila de Daniell. Sus semi-reacciones son
estas:
REACCIN ANDICA:
Zn(s) Zn2+ (ac) + 2 e-
REACCIN CATDICA:
Cu 2+ (ac) + 2e- Cu (s)
REACCIN NETA:
Zn(s) + Cu 2+ (ac) Zn2+ (ac) + Cu (s)
La notacin convencional para representar las celdas electroqumicas es un
diagrama de celda. En condiciones normales, para la pila de Daniell el diagrama
sera:
Zn (s) | Zn2+ (1 M) || Cu2+ (1M) | Cu (s)
Este diagrama est definido por: ANODO --> CATODO Electrodo negativo/electrolito //
Electrolito/electrodo positivo (el / indica flujo de electrones y el // significa puente salino) la lnea
vertical representa el lmite entre dos fases. La doble lnea vertical representa el puente salino. Por
convencin, el nodo se escribe primero a la izquierda y los dems componentes aparecen en el
mismo orden en que se encuentran al moverse de nodo a ctodo.
Potenciales Estndar de Electrodo
DIEGO OMAR GMEZ COMISIN : 21
La transferencia de electrones del nodo al ctodo a travs del circuito externo
genera una corriente elctrica debido a que existe una diferencia de potencial entre
ambos electrodos. Esta diferencia de potencial se mide en voltios y se suele
denominar fuerza electromotriz (fem) o voltaje de la celda (pila), Ecel, que
corresponde a la diferencia entre el potencial del ctodo, E
ctodo
, y el potencial del
nodo, E nodo.
Ecel = Ectodo - Enodo
Cuando todas las especies inicas que intervienen en la reaccin estn en
concentracin unidad, y las presiones de todos los gases son de 1 atm, los
correspondientes potenciales se denominan potenciales estndar y se
simbolizan como E. En estas condiciones:
Ecel = Ectodo - Enodo
El potencial de un electrodo aislado no puede medirse individualmente. El
nico valor que puede medirse experimentalmente con un voltmetro es la
diferencia de potencial entre las dos semiceldas, es decir, la fem o voltaje de
la celda. Sin embargo, es posible establecer valores relativos de potenciales
estndar de semicelda
eligiendo una como referencia. Por acuerdo
internacional, se ha elegido como referencia o patrn arbitrario el potencial
del electrodo estndar de hidrgeno EEH, tambin llamado electrodo normal
de hidrgeno (ENH o NHE), al que se asigna E = 0 V a cualquier temperatura.
ste electrodo consiste en un hilo de platino conectado a una lmina de
platino platinada, recubierto por un tubo de vidrio, introducido en una
disolucin HCl 1M. Por la parte superior del tubo se inyecta hidrgeno gas
con una presin de 1 atm.
Para medir el potencial elctrico de un electrodo se construye la pila con se
electrodo y el EEH y se mide la fuerza electromotriz de esa pila. Por ejemplo, en la
figura a) se muestra una celda electroqumica con un electrodo de Zn y un EEH y
en la figura b) una celda formada por el EEH y un electrodo de Cu.
DIEGO OMAR GMEZ COMISIN : 21
Las reacciones de semicelda se escriben de la siguiente forma:
a)
Ecel = Ectodo - Enodo = 0.00 E Zn2+ / Zn = 0.76
Entonces el potencial normal (o estndar) de reduccin del Zn es -0.76 V
b)
Ecel = Ectodo - Enodo = E Cu2+ / Cu 0.00 = 0.34
Entonces el potencial normal (o estndar) de reduccin del Cu es 0.34V
NOTA: En la ecuacin Ecel = Ectodo - Enodo, los potenciales de los
respectivos electrodos corresponden a los potenciales de reduccin.
Los potenciales elctricos de los diferentes electrodos se ordenan en una tabla
llamada escala de potenciales normales de reduccin o serie electroqumica de
DIEGO OMAR GMEZ COMISIN : 21
tensiones. Los valores de potencial elctrica que figuran en ella son los
correspondientes al proceso de reduccin, todos ellos referidos al valor 0 para el
potencial elctrico del electrodo normal de hidrgeno.
Si el potencial normal de reduccin un electrodo es negativo, significa que, en la
pila formada por ese electrodo y el EEH, dicho electrodo acta como nodo, es
decir, esa especie qumica es ms reductora que el hidrgeno ( caso del Zn) . Si,
por el contrario, el potencial normal de reduccin de un electrodo es positivo, esa
especie qumica es ms oxidante que el hidrgeno (caso del Cu).
Cuanto mayor sea el potencial normal de un electrodo mayor ser el carcter
oxidante de esa especie, y cuanto menor sea el potencial normal, mayor ser el
carcter reductor de la especie en cuestin.
Espontaneidad de una reaccin Redox
En una celda elctrica la energa qumica se transforma en energa elctrica que
est dada por el producto de la fem de la celda por la carga elctrica.
Energa elctrica (joules) = fem (volts) x carga (coulombs)
E elctrica = E0 x q
La carga est determinada por el nmero de moles de electrones (n) que
pasan a travs del circuito.
q = nF
Donde: F = constante de Faraday (carga elctrica contenida en un mol de
electrones).
1 F = 96500 Coulomb / mol
Entonces:
G = E elec. = W elec. (Trabajo elctrico) = - E0nF
El signo es negativo cuando el trabajo lo realiza el sistema sobre los alrededores
y G es la energa libre que tiene el sistema para realizar el trabajo elctrico.
G0 = -n F E0
Como G0 tiene que ser negativo para un proceso espontneo y n y F son
DIEGO OMAR GMEZ COMISIN : 21
positivos, entonces E0 celda tiene que ser positivo
G0 = -R T ln K = - n F E0 celda
E0 celda = (- R T ln K ) / (-n F)
E0 celda = (-(8.314 J/kmol)(298 K )(2.3) log K ) / (n (96500 J/mol))= 0.06 log K / n
Recordar que K es constante [ Q (cociente de reaccion) = Keq en equilibrio ]
Por lo tanto, si se conoce cualquiera de las cantidades G0, K, E0 celda, las otras
2 se pueden calcular.
La siguiente tabla nos da una relacin entre esas cantidades
G
E0 celda
Reaccin
Negativa
> 1
Espontnea
=1
En equilibrio
Positiva
<1
No espontnea
Leyes de Faraday
Faraday estudi cuantitativamente las reacciones de electrlisis. Enunci sus
resultados en forma de leyes:
1- La masa de sustancia depositada en cada electrodo es proporcional a la
cantidad de electricidad que ha circulado.
2- Para una misma cantidad de electricidad, la masa de sustancia obtenida
es proporcional al equivalente-gramo de la misma.
Las dos leyes se resumen en al siguiente ecuacin:
m es la masa de la sustancia producida en el electrodo (en gramos),
Q es la carga elctrica total que pas por la solucin (en coulomb),
q es la carga del electrn = 1.602 x 10-19 culombios por electrn,
n es el nmero de valencia de la sustancia como ion en la solucin (electrones por mol),
F = qNA = 96485 Cmol-1 es la Constante de Faraday,
M es la masa molar de la sustancia (en gramos por mol), y
DIEGO OMAR GMEZ COMISIN : 21
NA es el Nmero de Avogadro = 6.022 x 1023 iones por mol.
I es la corriente elctrica (en amperios)
t es el tiempo transcurrido (en segundos)
Bateras
En la seccin anterior se vio que la celda galvnica es un dispositivo en el cual
una reaccin de xido-reduccin genera corriente elctrica mediante separacin de
la sustancia oxidante y la reductora.
Batera casera
Es un pequeo experimento casero que consiste en armar una celda
voltaica formada por elementos que fcilmente pueden ser conseguidos en
un casa.
Materiales
Se necesitan monedas (si son de cobre puro mejor) como las monedas de
un centavo que fueron comunes en los 90s.
Cartn de un espesor entre 2 a 4 mm como el de un caja de zapatos u otra.
Papel aluminio como el que utiliza para envolver alimentos.
Vinagre que es el nombre comn para el cido actico diluido al 5%.
Una pequea cubeta para montar las partes.
Cables de un espesor no mayor a 1,5mm de seccin, como el de algunos
juguetes, tambin es fcil de conseguir. No se requiere mucha cantidad, como
mximo tramos de 15cm de colores diferentes (rojo y negro preferentemente).
DIEGO OMAR GMEZ COMISIN : 21
Construccin:
Las imgenes muestran una secuencia
lgica para el armado de la celda
Recortar con tijera o cutter cuadrados de
DIEGO OMAR GMEZ COMISIN : 21
cartn de un tamao similar a las monedas (en nuestro caso de las monedas
de 1 centavo).
Recortar tiras de papel aluminio de un ancho similar al de los cuadrados de
cartn ( recordar que las tiras tendrn un largo que depender del tamao
del rollo de papel de aluminio)
Doblar el papel aluminio para formar pequeos cuadritos similares a los de
cartn en tamao.
En un recipiente colocar vinagre y los cuadritos de cartn para que estos
ltimos absorban el lquido.
Con todos los materiales ya preparados formar las celdas acomodando los
materiales en el siguiente orden: primero la moneda como terminal positivo o
nodo (a la cual se le puede soldar un cable para formar el terminal); luego
se coloca el cartn embebido en vinagre y finalmente papel aluminio que
ser el terminal negativo o ctodo.
Se formarn celdas de acuerdo a la cantidad de voltaje que uno quiera.
Falencias constructivas
Al ser las monedas de composicin diferente (no todas son de cobre puro) los
potenciales obtenidos sern diferentes. Al agregar mas celdas pueden ocasionarse
pequeas perdidas que repercutirn en el valor final obtenido por sumatoria en
serie de cada una, las prdidas se evidencian por el hecho de que el valor obtenido
no es igual al valor que un esperara obtener de acuerdo a la cantidad de celdas.
Explicacin
Cada celda formada por una moneda, un cartn con vinagre y el papel aluminio
nos entrega una diferencia de potencial de aproximadamente 0,5 voltios, lo cual es
una cifra muy similar al potencial estndar esperado para el cobre puro ( segn
tabla estndar de potenciales). Ya que fue mencionado, la tabla de potenciales
muestran valores estndar para los materiales con respecto al hidrgeno que en
forma convencional tiene potencial cero. Eso quiere decir que de acuerdo a la
teora redox, teniendo en cuenta que el cobre es el nodo y el voltaje obtenido, la
DIEGO OMAR GMEZ COMISIN : 21
reaccin se produce por oxidacin del cobre y reduccin del hidrgeno, es decir el
aluminio interviene solo como terminal elctrico en la obtencin del voltaje ya que
es el cobre el que cede sus electrones para que se produzca la corriente elctrica.
Potenciales segn tabla de potenciales estndar
De donde se obtiene el hidrgeno ?
Recordemos que el vinagre es un cido orgnico, es el cido actico o etanico
Este cido se encuentra diluido en agua al 5%, en su estructura vemos que
contiene gran cantidad de hidrgenos que se aprovecharn en la reaccin.
Recordar que se liberan hidrgenos (in hidronio) al momento en que un cido
se diluye en agua.
DIEGO OMAR GMEZ COMISIN : 21
Acetato de cobre
Es una sustancia verde azulada que se obtiene como resultado de la reaccin y
se evidencia en la superficie de las monedas.
Cuanto voltaje se obtuvo?
Se logr alcanzar una diferencia de potencial de 4 voltios al momento de ser
armado, con el paso de las horas el vinagre comienza a secarse por evaporacin
del agua y el voltaje se estabiliza en alrededor de 3 voltios. Dichos potenciales son
suficientes para encender una lmpara LED durante 24horas (al menos ese fue el
tiempo mximo que dur nuestra prueba) lo cual es interesante para ser una
batera casera.
Nota: Este informe se acompaa un con un
video corto que muestra el proyecto en
funcionamiento.
También podría gustarte
- Informe de Inspeccion NDT 16d008Documento12 páginasInforme de Inspeccion NDT 16d008Overhaul Mining EirlAún no hay calificaciones
- UF1965 - Operaciones auxiliares en el mantenimiento de equipos eléctricosDe EverandUF1965 - Operaciones auxiliares en el mantenimiento de equipos eléctricosAún no hay calificaciones
- Formulacion Del RefrigeranteDocumento3 páginasFormulacion Del RefrigeranteCarlos Salazar100% (7)
- Ra 26 AcuarioDocumento1 páginaRa 26 Acuario780128Aún no hay calificaciones
- ELECTROQUIMICADocumento47 páginasELECTROQUIMICAMichael Moreno100% (1)
- Serie 3-2C-2024Documento10 páginasSerie 3-2C-2024sasha.aciar.cioAún no hay calificaciones
- Capitulo IV Equilibrio Oxidación - Reducción FIQ - 2024-IDocumento7 páginasCapitulo IV Equilibrio Oxidación - Reducción FIQ - 2024-IFranco Garcia ValeraAún no hay calificaciones
- PILASDocumento13 páginasPILASAdriana Toro RosalesAún no hay calificaciones
- ElectroquímicaDocumento14 páginasElectroquímicaSonia Zahoui100% (1)
- Potenciales de Electrodo y Potencial de Electrodo EstándarDocumento3 páginasPotenciales de Electrodo y Potencial de Electrodo EstándarJESUS YESICA SANCHEZ TEJADAAún no hay calificaciones
- Unidad 8 Equilibrio RedoxDocumento43 páginasUnidad 8 Equilibrio RedoxSoniaAún no hay calificaciones
- ElectroquimicaDocumento38 páginasElectroquimicaRenzoBenitesAún no hay calificaciones
- Parte 33 PILAS ELECTROQUÍMICASDocumento44 páginasParte 33 PILAS ELECTROQUÍMICASErik Ariel LauraAún no hay calificaciones
- 7 ReaccionesredoxDocumento15 páginas7 ReaccionesredoxMariana SofíaAún no hay calificaciones
- 7reacciones Redox y 5 de NeutralizaciónDocumento25 páginas7reacciones Redox y 5 de NeutralizaciónJorgeMoralesAún no hay calificaciones
- Tema 7 Reacciones de Oxido ReduccionDocumento37 páginasTema 7 Reacciones de Oxido ReduccionJose MAún no hay calificaciones
- 2 ElectroquimicaDocumento63 páginas2 ElectroquimicaRios Lopez Juan RobertoAún no hay calificaciones
- CAP 9 INTRODUCCIÓN A LA ELECTROQUIMICA - Parte 3 Pilas ElectroquímicasDocumento19 páginasCAP 9 INTRODUCCIÓN A LA ELECTROQUIMICA - Parte 3 Pilas ElectroquímicasDaniel FeymanAún no hay calificaciones
- Esquema-Resumen Unidad 7Documento7 páginasEsquema-Resumen Unidad 7Jonathan Alcivar RodriguezAún no hay calificaciones
- Unidad III Electroquímica.Documento18 páginasUnidad III Electroquímica.JoseXochihuaJuanAún no hay calificaciones
- Electroquimica IntroducciónDocumento6 páginasElectroquimica IntroducciónbrigethAún no hay calificaciones
- 5 Electroquu00cdmica para La ClaseDocumento13 páginas5 Electroquu00cdmica para La ClaseMiguel Angel RuizAún no hay calificaciones
- Electroquimica 2019Documento27 páginasElectroquimica 2019ulises michelinAún no hay calificaciones
- I-1 Unidad 10 ElectroquimicaDocumento65 páginasI-1 Unidad 10 Electroquimicasheila0517Aún no hay calificaciones
- Reacciones de Oxido Reducción 2024Documento27 páginasReacciones de Oxido Reducción 2024yaelinguarandaAún no hay calificaciones
- Cuestionario de ElectroquimicaDocumento5 páginasCuestionario de Electroquimicarosenthal elvis chimpay ariasAún no hay calificaciones
- Capitulo IV Equilibrio Oxidación - Reducción FIQ - 2023-IDocumento6 páginasCapitulo IV Equilibrio Oxidación - Reducción FIQ - 2023-IWilinster ReateguiAún no hay calificaciones
- Celdas GalvánicasDocumento22 páginasCeldas GalvánicasEISTEINAún no hay calificaciones
- Pilas - Electrolisis - 2012Documento16 páginasPilas - Electrolisis - 2012noegonzzAún no hay calificaciones
- T7 Reacciones Redox - Formulario ResumenDocumento5 páginasT7 Reacciones Redox - Formulario ResumennayradgrAún no hay calificaciones
- Electroquimica PDFDocumento41 páginasElectroquimica PDFLeandro PelletanAún no hay calificaciones
- Lab5 RedoxDocumento26 páginasLab5 RedoxCruz Torrez Jhenny MichelAún no hay calificaciones
- 1701737307574_problemario de CeldasDocumento12 páginas1701737307574_problemario de CeldasA̸̡͎͍̓̈́l̵͓̞͓̀̓̒e̸͎̟͐̐͋͜j̴͙͎̪͆̒̒à̸͚͓͇̐̈́n̴̞͉͆͋͜͝d̴̝͎͎̓͑̈́r̴͔̫̦̓͝o̵̺̟̓͐͝ B̴͚̟̺͋̿l̸̙͖͚̽͌͑à̸̺͉͇̒̚n̵͙͍̘͐̈́͠c̵͎̘̫̿̔̈́a̵̟̙͊͘Aún no hay calificaciones
- ElectroquímicaDocumento59 páginasElectroquímicaAnonymous M4NwEPXKEEAún no hay calificaciones
- Lab5 RedoxDocumento27 páginasLab5 RedoxMarceloAún no hay calificaciones
- Electroquimica Guia de LaboratorioDocumento4 páginasElectroquimica Guia de LaboratorioEsther Mogro50% (2)
- Ut 2técnicas Electroquímicas de Análisis 23 24Documento36 páginasUt 2técnicas Electroquímicas de Análisis 23 24cuentaamazonmfAún no hay calificaciones
- Diapositivas de ELECTROQUIMICADocumento33 páginasDiapositivas de ELECTROQUIMICAJohn Enrique Tinoco Rojas33% (3)
- ElectrodinámicaDocumento18 páginasElectrodinámicaMILENA PALACIO SALDARRIAGAAún no hay calificaciones
- Electroquimica 11Documento12 páginasElectroquimica 11Rosalia Pacheco CastroAún no hay calificaciones
- Óxido - ReducciónDocumento41 páginasÓxido - ReducciónSEGUNDO AÑO FACET UNCAún no hay calificaciones
- Química Inorgánica I - Electroquímica y Redox - ResumenDocumento4 páginasQuímica Inorgánica I - Electroquímica y Redox - ResumenFacundo MarínAún no hay calificaciones
- Informe Quimica #04 2007-IIDocumento24 páginasInforme Quimica #04 2007-IIDenis Ortiz CastiglioniAún no hay calificaciones
- Electroquimica DDocumento38 páginasElectroquimica DNoreli PerezAún no hay calificaciones
- Electro Qui MicaDocumento80 páginasElectro Qui MicaWilmer Bobadilla CruzAún no hay calificaciones
- Teria de Pilas Word 2003Documento32 páginasTeria de Pilas Word 2003Salinas GastónAún no hay calificaciones
- Potencial Normal de ElectrodoDocumento6 páginasPotencial Normal de ElectrodoAngelita Carbonel SinarahuaAún no hay calificaciones
- REACCIONES DE OXIDO REDUCCIÓN (Autoguardado)Documento20 páginasREACCIONES DE OXIDO REDUCCIÓN (Autoguardado)Paulina TejadaAún no hay calificaciones
- 4 ELECTROQUIMICA - Parte 3Documento50 páginas4 ELECTROQUIMICA - Parte 3Rodriguez MamaniAún no hay calificaciones
- Guía Teórica RedoxDocumento9 páginasGuía Teórica RedoxApoloAún no hay calificaciones
- TEORÍADocumento9 páginasTEORÍAEduardo CerezoAún no hay calificaciones
- Celdas VoltaicasDocumento4 páginasCeldas VoltaicasValeria Enriquez Ruiseco100% (3)
- Modulo III - Tema 5 - Celdas ElectroquímicasDocumento137 páginasModulo III - Tema 5 - Celdas ElectroquímicasAnonymous yEGP9hnAún no hay calificaciones
- Guia de Problemas Nº11Documento12 páginasGuia de Problemas Nº11Nahuel YurquinaAún no hay calificaciones
- Celda ElectroquímicaDocumento8 páginasCelda ElectroquímicaRaziel Pancardo GómezAún no hay calificaciones
- 2-ElectroquímicaDocumento24 páginas2-ElectroquímicaValentina DureAún no hay calificaciones
- Celdas Electroquimicas Unidad 5Documento20 páginasCeldas Electroquimicas Unidad 5vanessaAún no hay calificaciones
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaDe EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAún no hay calificaciones
- Teoría electromagnética para estudiantes de ingeniería: Notas de claseDe EverandTeoría electromagnética para estudiantes de ingeniería: Notas de claseCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Estudio Economico de BiodieselDocumento23 páginasEstudio Economico de BiodieselSamuel Eduardo Baltodano TorresAún no hay calificaciones
- Informe 3Documento19 páginasInforme 3Bianca LeónAún no hay calificaciones
- Seguridad Vial Sostenible y Ecologica Con Pinturas para Trafico - Expocon PDFDocumento31 páginasSeguridad Vial Sostenible y Ecologica Con Pinturas para Trafico - Expocon PDFDarwinJCAún no hay calificaciones
- Gestión EmpresarialDocumento9 páginasGestión EmpresarialYaiza BetanyaAún no hay calificaciones
- Technische Info Pretex EsDocumento7 páginasTechnische Info Pretex Estulipay0% (1)
- Presupuesto - Construccion Puente Viga Losa Long. 2.50 MTS - AyfgDocumento3 páginasPresupuesto - Construccion Puente Viga Losa Long. 2.50 MTS - AyfgOmar Elvis Pinto PaccoAún no hay calificaciones
- Cadena de CustodioDocumento2 páginasCadena de CustodioRuben Eduardo Vásquez PeñaAún no hay calificaciones
- Trabajo Final de Ser Sumano y Desarrollo Sostenible (La Basura)Documento19 páginasTrabajo Final de Ser Sumano y Desarrollo Sostenible (La Basura)Stephanie Marun BerroaAún no hay calificaciones
- Arquitectura de Producto A. Diagrama Esquemático Del Producto B. Agrupación de Los Elementos Del EsquemaDocumento5 páginasArquitectura de Producto A. Diagrama Esquemático Del Producto B. Agrupación de Los Elementos Del EsquemaDIEGO GOMEZ GARZONAún no hay calificaciones
- Reporte Fotografico Camino Rural Tierra BlancaDocumento4 páginasReporte Fotografico Camino Rural Tierra BlancafranciscoAún no hay calificaciones
- Copia de Maquinaria Agricola - 30-03-2020 V2Documento27 páginasCopia de Maquinaria Agricola - 30-03-2020 V2Adolfo Montes MorenoAún no hay calificaciones
- Ficha Keltec Filtros RedDocumento3 páginasFicha Keltec Filtros RedIngeniería AplicacionesAún no hay calificaciones
- BladoDocumento42 páginasBladoHever Yahir AzuaraAún no hay calificaciones
- Inventario BodegaDocumento11 páginasInventario BodegaFabian Fonseca HAún no hay calificaciones
- Plan Sector Automotriz (17!3!16)Documento44 páginasPlan Sector Automotriz (17!3!16)La Radio del SURAún no hay calificaciones
- Remaches Universales y CiegosDocumento29 páginasRemaches Universales y Ciegossanchez orta eduardo daniel100% (1)
- FM Spaj140c 750208 EscabDocumento72 páginasFM Spaj140c 750208 EscabMartin LozanoAún no hay calificaciones
- 06.1. Analisis de Costos UnitariosDocumento22 páginas06.1. Analisis de Costos UnitariosJenryIsuizaAún no hay calificaciones
- Ejercicios Resueltos 2Documento7 páginasEjercicios Resueltos 2Jacqueline Humanez Martinez100% (1)
- La Relacion Entre El Valor n30 de l9spt y La Resistencia A La Compresión SimpleDocumento7 páginasLa Relacion Entre El Valor n30 de l9spt y La Resistencia A La Compresión Simpleanderson manzanoAún no hay calificaciones
- Descripcion Sistema de Gases Medicinales (Mitu) PDFDocumento11 páginasDescripcion Sistema de Gases Medicinales (Mitu) PDFDaniel Perez100% (1)
- 50 Articulos CientificosDocumento11 páginas50 Articulos CientificosCleidy Delgado MegoAún no hay calificaciones
- Trabajo Práctico TornoDocumento16 páginasTrabajo Práctico TornoFernando Jair HuancaAún no hay calificaciones
- Tema 1 - PLANTAS PETROQUÍMICASDocumento44 páginasTema 1 - PLANTAS PETROQUÍMICASMaximo CardenasAún no hay calificaciones
- S06 - Estudio de La Disposición de PlantaDocumento36 páginasS06 - Estudio de La Disposición de Plantau21202110Aún no hay calificaciones
- Preparación de Una Pasta Cerámica ArchivoosDocumento7 páginasPreparación de Una Pasta Cerámica ArchivoosSon Gohan SuarezAún no hay calificaciones
- Capitulo 2Documento20 páginasCapitulo 2Alexis Jihuallanca ApazaAún no hay calificaciones