Clase 1 Quimica
Clase 1 Quimica
Cargado por
36 Alan Deymar Corazón SuxoCopyright:
Formatos disponibles
Clase 1 Quimica
Clase 1 Quimica
Cargado por
36 Alan Deymar Corazón SuxoDescripción original:
Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Copyright:
Formatos disponibles
Clase 1 Quimica
Clase 1 Quimica
Cargado por
36 Alan Deymar Corazón SuxoCopyright:
Formatos disponibles
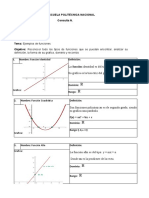
ESTADO GASEOSO
Estado de agregación de materia, en el que los gases no tienen forma ni volumen
propio adoptando el del recipiente que los contiene y que se caracterizan por ser
sensibles a los cambios de PRESION, VOLUMEN Y TEMPERATURA.
Volumen.- El volumen de un gas está determinado por el volumen del recipiente que lo
contiene.
VGAS = VRECIPIENTE
Presión.- En un gas está determinada por el choque que realizan las moléculas contra
las paredes del recipiente que los contiene.
F
P=
A
En los gases existen tres tipos de presiones:
Presión barométrica o atmosférica.- Es aquella que varía con la altitud.
Calculo de la presión atmosférica a partir de cualquier altura geográfica:
M.g.h
P = PO.e− RT
Patm (La Paz) = 495 mmHg
Patm (Mar) = 760 mmHg
Presión manométrica.- La presión manométrica resulta de comparar la presión
total de un gas con la presión atmosférica, una forma de medir la presión de los
gases es con manómetros.
Características de los manómetros:
CASO 1:
PGAS ˃ Patm
Respecto al N.R. el punto más bajo del líquido
manométrico.
Igualo las presiones que actúan sobre los
puntos A y B.
PA = PB
Reemplazo según la gráfica: quien ejerce
presión en A y en B.
PGAS = h + Patm (I)
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
CASO 2:
PGAS ˂ Patm
Igualo las presiones que actúan sobre los
puntos A y B.
PA = PB
PGAS + h = Patm
PGAS = Patm - h (II)
CASO 3:
PGAS = Patm
Igualo las presiones que actúan sobre los puntos
A y B.
PA = PB
PGAS = Patm (III)
Nota.- Cuando el líquido manométrico no es Mercurio (Hg)
δHg.hHg = δX.hX
Dónde: δHg = densidad del mercurio (δHg = 13,6 g/cm3)
hHg = altura en unidades de mercurio (mmHg)
δX = densidad de la sustancia X
hX = altura de la sustancia a convertir
Presión absoluta.- Es la presión que tiene un gas, dependiendo los casos que se
puede tener.
PABSOLUTA = PGAS
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
Conversión de unidades de presión:
1 atm = 760 mmHg = 760 Torr = 1,033 kgf/cm2 = 1,013 bar = 101,3 KPa
1 atm = 101325 Pa = 14,7 Lbf / plg2 = 14,7 PSI = 10332 mm H2O
1 bar = 105 Pa ; 1 Pa = 1 N/m2
Temperatura.- En los gases se considera siempre escalas absolutas.
ͦC ͦF −32 ͦRe K−273 R−492
Factor de conversión: = = = =
5 9 4 5 9
Numero de moles.- Es la cantidad de gas contenida en un recipiente.
m
n=
M
Nota.- Mol es una unidad para expresar cantidad.
Dónde: n = número de moles
m = masa
M = peso molecular
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
EJERCICIOS RESUELTOS
Ejemplo) Calcular la presión absoluta del gas si la altura “h” es de 200 mm si el líquido
manométrico es agua y el sistema se encuentra en La Paz (Patm = 495 mmHg).
Datos: Patm > Pgas
PGAS = ¿? ; h = 200 mmH2O (Patm = 495 mmHg)
Solución:
Buscamos el Nivel de Referencia (N.R.) el punto mas bajo del líquido manométrico.
Para la solución igualo los puntos A y B
donde se ejercen las presiones: PA = PB
Ahora reemplazos quienes ejercen presión
en esos puntos:
PGAS + h = Patm
El ejercicio me pide la Presión absoluta del gas: PGAS = Patm – h (I)
Convertir el liquido manométrico:
δHg.hHg = δagua.hagua
𝑔
𝛿𝑎𝑔𝑢𝑎 .ℎ𝑎𝑔𝑢𝑎 1 .200 𝑚𝑚
𝑚𝑙
hHg = = 𝑔 = 14,7 mmHg
𝛿𝐻𝑔 13,6
𝑚𝑙
Reemplazo en (I):
PGAS = 495 mmHg – 14,7 mmHg = 480,3 mmHg
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
Ejemplo) Determinar la presión absoluta del gas hidrogeno encerrado en un
Eudiómetro de la siguiente figura: el experimento fue realizado en La Paz cuando la
temperatura era de 15oC.
Datos: PH2 = ¿? ; Ciudad de La Paz entonces Patm = 495 mmHg y T = 15 ͦC
h = 43 cmH2O = 430 mmH2O
Solución:
Al igual como si fuera un líquido manométrico analizo el N.R. el punto más bajo:
Entonces realizo las presiones que ejercen
en el punto A y B:
PA = PB
Patm = h + PH2
PH2 = Patm – h (I)
PH2 = 495 mmHg – 31,617 mmHg
PH2 = 463,38 mmHg
Para reemplazar datos primero transformo a la misma unidad:
𝛿𝐻2𝑂 .ℎ𝐻2 𝑂
δHg.hHg = δX.hX → δHg.hHg = δH2O .hH2O → hHg =
𝛿𝐻𝑔
Quiero saber su equivalencia en la “hHg” reemplazo:
g 10𝑚𝑚
1 .430mm 43cm x = 430mm
cm3 1𝑐𝑚
hHg = g → hHg = 31,617 mm (la altura en Hg)
13,6 3
cm
Reemplazo en (I):
PH2 = 495 mmHg – 31,617 mmHg → PH2 = 463,383 mmHg Rpta.
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
Ejemplo) Determinar la presión manométrica y absoluta del gas si la presión
barométrica es 600 mmHg (δaceite= 0,65 g/cc). L1=20cm= 200 mm, L2=40cm = 400
mm, Ѳ = 50 O
Datos: h = ? ; PGAS = ? ; si la presión barométrica Patm = 600 mmHg
Solución:
Este caso es particular porque el manómetro tiene una inclinación:
Tomando el N.R. el punto más
bajo del líquido manométrico
PA = PB
PGAS = h1 + h2 + Patm (I)
Analizando:
ℎ1
sen ϴ = → h1 = L1.sen ϴ = 200 mm.sen 50 = 153,21 mmHg
𝐿1
h2
Sen Ѳ =
L2
Despejando h2:
h2 = L2.senѲ
h2 = 400 mm.sen50 = 306,42 mmAceite
δHg.hHg = δAceite.hAceite
h2 = hHg = 14,65 mmHg
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
Ejemplo) Se tiene un gas el cual necesito saber su presión. Ver la figura.
agua
ϴ = 30O, L1 = 50 cm,
ING. WILMER QUISPE CASTAÑETA FACULTAD DE INGENIERÍA
También podría gustarte
- Practica 6 Elaboracion de Un Circuito ImpresoDocumento13 páginasPractica 6 Elaboracion de Un Circuito ImpresoRodolfo LRAún no hay calificaciones
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSDe EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSCalificación: 4.5 de 5 estrellas4.5/5 (7)
- Funciones Cuadratica TRABAJO EXPOSICIONDocumento52 páginasFunciones Cuadratica TRABAJO EXPOSICIONMargotPilarHuamanìHinostroza90% (10)
- Nom 001 STPS 2008 PDFDocumento2 páginasNom 001 STPS 2008 PDFGerardo Oropeza100% (1)
- Proyecto Procesos IndustrialesDocumento20 páginasProyecto Procesos IndustrialesAlexGuzmanc0% (1)
- Libro ESTADO GASEOSO Ing. GOYODocumento112 páginasLibro ESTADO GASEOSO Ing. GOYOWalter Quispe100% (1)
- Clase Pref QMC 14.04.22 Gases 2Documento15 páginasClase Pref QMC 14.04.22 Gases 2Mariano GasparAún no hay calificaciones
- Formulario 3er Parcial FIS102 Por Aux JReynaldoDocumento2 páginasFormulario 3er Parcial FIS102 Por Aux JReynaldoDiego Josue Nina FernandezAún no hay calificaciones
- Ii 2010DDocumento4 páginasIi 2010DCelsoNadinAún no hay calificaciones
- Practica Capitulo 4 Equilibrio QuimicoDocumento6 páginasPractica Capitulo 4 Equilibrio Quimicojhon limachiAún no hay calificaciones
- Prefas Practica 3º Parcial-Qmc PrefDocumento14 páginasPrefas Practica 3º Parcial-Qmc Prefadriel38100% (1)
- PRÁCTICA 1 BiomédiccasDocumento47 páginasPRÁCTICA 1 BiomédiccasEleanor AlmAún no hay calificaciones
- BernoulliDocumento5 páginasBernoulliFamily ColqueAún no hay calificaciones
- Primer Examen Parcial Area Quimica Fecha 19-03-2008 PDFDocumento5 páginasPrimer Examen Parcial Area Quimica Fecha 19-03-2008 PDFJohns ContrerasAún no hay calificaciones
- 5segunda Ley de NewtonDocumento14 páginas5segunda Ley de NewtonAlvaroAntezanaAún no hay calificaciones
- Medidas Practica 1Documento8 páginasMedidas Practica 1Joel ArteagaAún no hay calificaciones
- PDF Ejercicios Balance de Materia Ingenieria - CompressDocumento52 páginasPDF Ejercicios Balance de Materia Ingenieria - CompressJuan M.L.Aún no hay calificaciones
- Solucionario QMC 3p 2tDocumento3 páginasSolucionario QMC 3p 2tJohns ContrerasAún no hay calificaciones
- Practica2 QMC PREFDocumento11 páginasPractica2 QMC PREFNaira Mercado Herrera0% (1)
- 6.2 CAPITULO 6 PROBLEMAS Formula EmpiricaDocumento4 páginas6.2 CAPITULO 6 PROBLEMAS Formula EmpiricaLuis PerezAún no hay calificaciones
- Exámenes Primer Parcial CPF Fis 2023Documento25 páginasExámenes Primer Parcial CPF Fis 2023JoelAún no hay calificaciones
- ÓxidosDocumento18 páginasÓxidosHover Morales Plasencia0% (1)
- Auxiliatura Fisica 12 08 21Documento9 páginasAuxiliatura Fisica 12 08 21Isaac Amador QuispeAún no hay calificaciones
- 40 FuncionesDocumento11 páginas40 FuncionesDarwin GuasguaAún no hay calificaciones
- Soluqmc A PDFDocumento6 páginasSoluqmc A PDFCristhian Vargas ParedesAún no hay calificaciones
- Cuestionario 2Documento6 páginasCuestionario 2Jesus QuispeAún no hay calificaciones
- Practica, FIS G26 José Alberto Gonzáles TancaraDocumento23 páginasPractica, FIS G26 José Alberto Gonzáles TancaraJose Alberto Gonzales TancaraAún no hay calificaciones
- Template Practica FundamentosDocumento5 páginasTemplate Practica Fundamentosmatematica fisica quimica boliviaAún no hay calificaciones
- Examenes 2do Parcial - ActualizadoDocumento105 páginasExamenes 2do Parcial - ActualizadoFernando CalaniAún no hay calificaciones
- Guia Tercer Parcial Fisica 2021 2022Documento41 páginasGuia Tercer Parcial Fisica 2021 2022jhoel2005angel2018Aún no hay calificaciones
- Radicales QGIIDocumento2 páginasRadicales QGIICarlos Alberto Andrade Cholico100% (1)
- Proyecto Dirigido (Propiedades Coligativas)Documento8 páginasProyecto Dirigido (Propiedades Coligativas)DanielAún no hay calificaciones
- PRIMER EXAMEN PARCIAL ÁREA QUÍMICA FECHA 18-09-2009 B PDFDocumento4 páginasPRIMER EXAMEN PARCIAL ÁREA QUÍMICA FECHA 18-09-2009 B PDFJohns ContrerasAún no hay calificaciones
- 1 Parcial QMC-100 - 021138Documento21 páginas1 Parcial QMC-100 - 021138Alvarez M. Fabricio MiguelAún no hay calificaciones
- Gases HumedosDocumento3 páginasGases HumedosSamo J LuisAún no hay calificaciones
- Problemas de VectoresDocumento6 páginasProblemas de VectoresEmilio Saca Poma100% (1)
- Practica 4 Caida Libre y Movimiento ParabolicoDocumento13 páginasPractica 4 Caida Libre y Movimiento ParabolicoAngel Cristobal Huacara HonorioAún no hay calificaciones
- Práctica FísicaDocumento16 páginasPráctica FísicaValeria LázaroAún no hay calificaciones
- 1tma PDFDocumento7 páginas1tma PDFMariel Aly RosenAún no hay calificaciones
- Equilibrio Quimico LabDocumento6 páginasEquilibrio Quimico LabJose Fernandez100% (1)
- Cuestionario #1Documento4 páginasCuestionario #1Rocio Andrea CasillaAún no hay calificaciones
- Reacciones QuimicasDocumento5 páginasReacciones QuimicasƉ-Mân ĽôpêʑAún no hay calificaciones
- Ejercicios Resueltos PR2 M.R.UDocumento5 páginasEjercicios Resueltos PR2 M.R.UYoel Mamani100% (1)
- Practica N1 FQ InvDocumento3 páginasPractica N1 FQ InvAdan RichardAún no hay calificaciones
- Formulario 2do ParcialDocumento6 páginasFormulario 2do ParcialAlvarez M. Fabricio MiguelAún no hay calificaciones
- CuestionarioDocumento13 páginasCuestionarioRodrigo Dalence100% (1)
- PROBLEMAS.-Resuelva Estos Problemas Mostrando Sus Esquemas, Planteo de EcuacionesDocumento5 páginasPROBLEMAS.-Resuelva Estos Problemas Mostrando Sus Esquemas, Planteo de EcuacionesCasas Churqui JesseAún no hay calificaciones
- Algebra - Pract.Documento137 páginasAlgebra - Pract.Miguel MontellanoAún no hay calificaciones
- Deduccion Del Efecto DopplerDocumento32 páginasDeduccion Del Efecto DopplerFreddy Lp Robles100% (1)
- Practica Segundo Parcial Fisica-2Documento9 páginasPractica Segundo Parcial Fisica-2Luis Angel Chino Calderon100% (1)
- Composicion Porcentual, Fórmulas Empíricas (Contenido) PDFDocumento5 páginasComposicion Porcentual, Fórmulas Empíricas (Contenido) PDFAndy LilaAún no hay calificaciones
- Exámenes Primer Parcial CPF QMC 2023 PDFDocumento103 páginasExámenes Primer Parcial CPF QMC 2023 PDFmikiAún no hay calificaciones
- Teorema Trabajo y EnergiaDocumento17 páginasTeorema Trabajo y EnergiaRuddy Morante100% (1)
- Caida Libre Final CURSO PREFACULTATIVO UMSADocumento3 páginasCaida Libre Final CURSO PREFACULTATIVO UMSAPol Calliconde0% (1)
- Informe MetrologíaDocumento23 páginasInforme MetrologíaLeslie Heart100% (1)
- Dossier de Estudio PaadDocumento71 páginasDossier de Estudio PaadPablo Veleas100% (1)
- Codex Lineal Tomo I PDFDocumento132 páginasCodex Lineal Tomo I PDFluisAún no hay calificaciones
- Guia 3Documento11 páginasGuia 3SharaAún no hay calificaciones
- Maratonica de ManometrosDocumento14 páginasMaratonica de ManometrosAngel Cano SilesAún no hay calificaciones
- Estado GaseosoDocumento3 páginasEstado GaseosoMarco Antonio Acarapi ApazaAún no hay calificaciones
- Cuestionario 4Documento9 páginasCuestionario 436 Alan Deymar Corazón SuxoAún no hay calificaciones
- Ejemplos para Calcular PresiónDocumento2 páginasEjemplos para Calcular PresiónMaggi RamirezAún no hay calificaciones
- Ingeniería química. Soluciones a los problemas del tomo IDe EverandIngeniería química. Soluciones a los problemas del tomo IAún no hay calificaciones
- ProgramaAnalíticoÁlgebra - Mat-100 - Invierno - Grupo A 28-Jun-2023 12-26-47Documento2 páginasProgramaAnalíticoÁlgebra - Mat-100 - Invierno - Grupo A 28-Jun-2023 12-26-4736 Alan Deymar Corazón SuxoAún no hay calificaciones
- Pendulo SimpleDocumento3 páginasPendulo Simple36 Alan Deymar Corazón SuxoAún no hay calificaciones
- Cuestionario 5Documento4 páginasCuestionario 536 Alan Deymar Corazón Suxo100% (1)
- Cuestionario Fisica UmsaDocumento2 páginasCuestionario Fisica Umsa36 Alan Deymar Corazón SuxoAún no hay calificaciones
- Cuestionario 1°Documento2 páginasCuestionario 1°36 Alan Deymar Corazón SuxoAún no hay calificaciones
- Practica 5 Transformador en ParaleloDocumento5 páginasPractica 5 Transformador en ParaleloOscar DimasAún no hay calificaciones
- Presentacion 01Documento16 páginasPresentacion 01CarlosP0% (1)
- Normas Electricas PDFDocumento9 páginasNormas Electricas PDF26manuelAún no hay calificaciones
- TP Números ComplejosDocumento22 páginasTP Números Complejostomas ciscoAún no hay calificaciones
- Msds - 075 Nitrato de PotasioDocumento2 páginasMsds - 075 Nitrato de PotasioJesus Alex Villalva LaizaAún no hay calificaciones
- Cartas PsicometricasDocumento3 páginasCartas PsicometricasLANZcuberAún no hay calificaciones
- Balance Macroscópico de Energía - Calentamiento de Un Tanque AgitadoDocumento5 páginasBalance Macroscópico de Energía - Calentamiento de Un Tanque AgitadoCAMILO ALBERTO FUERTES LLANTENAún no hay calificaciones
- Práctica 5 - Conductividad TérmicaDocumento22 páginasPráctica 5 - Conductividad TérmicaJulia Abigail Domínguez CisnerosAún no hay calificaciones
- Sem7-HT - Aplicación de La Transformación LinealDocumento3 páginasSem7-HT - Aplicación de La Transformación LinealFranz Mahatma Hurtado PulidoAún no hay calificaciones
- Calm Catalogo2008Documento109 páginasCalm Catalogo2008blancohccAún no hay calificaciones
- MC ElectricasDocumento12 páginasMC ElectricasABC Arquitectura & IngenieríaAún no hay calificaciones
- Unidad 2 Propiedades de Los SistemasDocumento21 páginasUnidad 2 Propiedades de Los SistemasVictorMtzCruz100% (1)
- LAB 4 Campo y Potencial EléctricoDocumento8 páginasLAB 4 Campo y Potencial EléctricoDARYL DAVID MEJIA GUEVARAAún no hay calificaciones
- Estudio de Permeabilidad Al Vapor de Agua de Films ComestiblesDocumento10 páginasEstudio de Permeabilidad Al Vapor de Agua de Films ComestiblesArnold Vitor A.Aún no hay calificaciones
- Practica #4 Vertederos TriangularesDocumento16 páginasPractica #4 Vertederos TriangularesSergioimf MamaniAún no hay calificaciones
- Tema Iv: Curvas Circulares: 1-Introducción: La Instrucción de CarreterasDocumento37 páginasTema Iv: Curvas Circulares: 1-Introducción: La Instrucción de CarreterasJair ArrietaAún no hay calificaciones
- El Campo Electromagnético - Cuadripotencial, Tensor de Faraday, Ecuaciones de Maxwell, Lagrangiana y Ecuación de La Onda ElectromagnéticaDocumento12 páginasEl Campo Electromagnético - Cuadripotencial, Tensor de Faraday, Ecuaciones de Maxwell, Lagrangiana y Ecuación de La Onda ElectromagnéticafmillananjariAún no hay calificaciones
- 7mo Laboratorio de Analisis QuimicoDocumento17 páginas7mo Laboratorio de Analisis QuimicoPedro Vasquez AcevedoAún no hay calificaciones
- TermodinamicaDocumento2 páginasTermodinamicaPEPPE GRilloAún no hay calificaciones
- CAA Gormaz, Lecaros, Ramírez, Soto 2015-2Documento6 páginasCAA Gormaz, Lecaros, Ramírez, Soto 2015-2Antonio GuerraAún no hay calificaciones
- Informe N6 Reflexion en Superficie PlanaDocumento4 páginasInforme N6 Reflexion en Superficie PlanaBrian Jimenez KorzeliusAún no hay calificaciones
- Sistema de Cálculo Decargabilidad de Líneas de Transmisión en Sistemas Eléctricos de Potencia.Documento7 páginasSistema de Cálculo Decargabilidad de Líneas de Transmisión en Sistemas Eléctricos de Potencia.Nicasio Fermin Cóndor ChavezAún no hay calificaciones
- Nociones de La TermodinámicaDocumento6 páginasNociones de La Termodinámicacota.elizabethmAún no hay calificaciones
- Aceites Shell para CompresoresDocumento1 páginaAceites Shell para CompresoresErik Rosado AlvaradoAún no hay calificaciones
- Practica 1 Fime DinamicaDocumento10 páginasPractica 1 Fime DinamicaEdgarLopezFloresAún no hay calificaciones
- Centrales y SubestacionesDocumento13 páginasCentrales y SubestacionesPablo EstradaAún no hay calificaciones