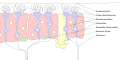
Epitelio olfativo
| Epitelio olfativo | ||
|---|---|---|
 Epitelio por encima de la Línea blanca punteada | ||
| TH | H3.11.07.0.01001 | |
| TH | H3.11.07.0.01001 | |
| Información anatómica | ||
| Sistema | Sistema olfatorio | |
| Nervio | Nervio olfatorio | |
| Precursor | Placoda olfativa y cresta neural | |
|
| ||

El epitelio olfativo o mucosa olfativa[1] es un epitelio sensorial especializado dentro de la cavidad nasal que está involucrado en el olor. En humanos, mide 9 cm² (3 cm x 3 cm) y se encuentra en el techo de la cavidad nasal aproximadamente 7 cm por encima y detrás de las fosas nasales.[2] El epitelio olfativo es la parte del sistema olfativo directamente responsable de detectar los olores.
Estructura
[editar]
El epitelio olfativo consta de cuatro tipos de células distintas:[3]
- Neuronas receptoras olfativas
- Células de apoyo o de sostén o de soporte
- Células basales
- Células en cepillo
Neuronas sensoriales olfativas
[editar]
Las neuronas olfativas son el tipo de neuronas sensoriales receptoras del epitelio olfativo. Son neuronas bipolares y sus polos apicales expresan receptores de olor en los cilios no móviles de la protuberancia dendrítica (dendritic knob),[4] que se extienden hacia el espacio aéreo para interactuar con los odorantes.[5]
Los receptores de olor se unen a los odorantes, que se hacen solubles por las secreciones serosas de las glándulas olfativas ubicadas en la lámina propia de la mucosa.[3]
Los axones de las neuronas sensoriales olfativas se congregan para formar el nervio olfatorio (Par craneal I). Una vez que los axones pasan a través de la placa cribiforme, terminan y hacen sinapsis con las dendritas de las células mitrales en los glomérulos del bulbo olfatorio.
Células de apoyo
[editar]
Las células de sostén o soporte (supporting cells) son células no neurales del epitelio olfativo, análogas a las células gliales, que se encuentran en la capa apical del epitelio columnar ciliado pseudoestratificado. Hay dos tipos de células de soporte en el epitelio olfativo: las células sustentaculares y las células microvillares.
Las células sustentaculares funcionan como soporte metabólico y físico para el epitelio olfativo.
Las células microvillares son otra clase de células de soporte que son morfológica y bioquímicamente distintas de las células sustentaculares, y surgen de una población de células basales que expresa la proteína de la superficie celular c-KIT.[6]
Células basales
[editar]
Descansando sobre o cerca de la lámina basal del epitelio olfativo, las células basales son células madre capaces de división y diferenciación en células de soporte u olfativas. Si bien algunas de estas células basales se dividen rápidamente, una proporción significativa permanece relativamente inactiva y repone las células epiteliales olfatorias según sea necesario. Esto lleva a que el epitelio olfativo sea reemplazado cada 6–8 semanas.[7]
Las células basales se pueden dividir en función de sus características celulares e histológicas en dos poblaciones: las células basales horizontales (HBC en inglés), que están dividiendo lentamente las células de reserva que expresan p63; y células basales globosas (GBC en inglés), que son una población heterogénea de células que consiste en células de reserva, células progenitoras amplificadoras y células precursoras inmediatas.[8]
Células en cepillo
[editar]Una célula en cepillo es una célula columnar portadora de microvellosidades con su superficie basal en contacto con las terminaciones nerviosas aferentes del nervio trigémino (Par craneal V) y está especializada para la transducción de la sensación general.
Glándulas olfativas o de Bowman
[editar]
Son glándulas secretoras serosas tubuloalveolares que se encuentran en la lámina propia de la mucosa olfatoria. Estas glándulas entregan una secreción proteica a través de los conductos a la superficie de la mucosa. El papel de las secreciones es atrapar y disolver sustancias odíferas para las neuronas bipolares. El flujo constante de las glándulas olfativas permite que los olores viejos se eliminen constantemente.[3]
Desarrollo
[editar]
El epitelio olfativo se deriva de dos estructuras durante el desarrollo embrionario: la placoda olfativa, que durante mucho tiempo se creía que era su único origen; y células de la cresta neural, cuyas contribuciones se han identificado más recientemente a través de estudios de mapeo del destino.[9]
El epitelio olfativo embrionario consta de menos tipos de células que en el adulto, incluidas las células progenitoras apicales y basales, así como las neuronas sensoriales olfativas inmaduras.[9] La neurogénesis embrionaria temprana se basa principalmente en las células apicales, mientras que la neurogénesis embrionaria en etapa posterior y la neurogénesis secundaria en adultos se basan en células madre basales.[10] Los axones de las neuronas sensoriales olfativas inmaduras, junto con una población mixta de células migratorias, incluidas las células de vaina olfativas inmaduras y las neuronas de la hormona liberadora de gonadotropina, forman una "masa migratoria" que viaja hacia el bulbo olfatorio . Al final de la etapa embrionaria, el epitelio se convierte en un epitelio columnar pseudoestratificado y comienza la neurogénesis secundaria.
Placoda olfativa
[editar]
Las placodas son agregaciones transitorias y focales de ectodermo ubicadas en la región de desarrollo de la futura cabeza de los vertebrados, y dan lugar a órganos sensoriales[11] Las primeras placodas sensoriales craneales están marcadas por la expresión de Six1, parte de la familia Six de factores de transcripción que regulan la especificación del ectodermo preplacodal . La placoda olfativa se forma como dos engrosamientos de la región no neural del ectodermo embrionario.[12] En ratones, la placoda olfativa se deriva de una porción anterior del tubo neural, aproximadamente 9 -9.5 días en el desarrollo y no mucho después del cierre de la placa neural.[9] El desarrollo de la placoda olfativa requiere la presencia de tejido mesenquimatoso derivado de la cresta neural subyacente.[13] La especificación del tejido de la placoda olfatoria implica señalización de múltiples redes de genes, comenzando con señales de proteínas morfogenéticas óseas (BMP), ácido retinoico (RA) y factor de crecimiento de fibroblastos (FGF), específicamente FGF8.[14] La expresión resultante regulada aguas abajo de factores de transcripción, como Pax6, Dlx3, Sox2 y otros, dentro del tejido de la presunta placoda olfativa son cruciales para la subregionalización en el futuro epitelio olfativo y es responsable de la diversidad de células que compondrán el epitelio futuro.[15]
Similar a las otras placodas embrionarias, la placoda olfativa da lugar a estructuras neurales y no neurales, lo que finalmente resulta en la formación del epitelio nasal.[16] La especificación del tejido neural versus no neural involucra señales tanto dentro de la placoda olfativa como entre la placoda olfativa y el compartimento mesenquimatoso subyacente.[13] La señalización continua por BMP, FGF y RA, los morfógenos que inicialmente indujeron la formación de la placoda, coordinan colectivamente el patrón del tejido de la placoda olfativao en los futuros tipos de células distintas que conformarán el epitelio olfativo. Los tipos de células derivadas de la placoda olfativa incluyen:[17]
- Neural: neuronas sensoriales olfativas, neuronas secretoras de LHRH y células ganglionares
- No neuronal: células basales, células de soporte olfativas, células ciliadas, glándulas de Bowman, células de Schwann, glándulas submucosas y células en cepillo.
Sin embargo, existe evidencia significativa de una cresta neural adicional -origen para muchos de estos tipos de células también.[12]
Desarrollo neuronal sensorial olfativo
[editar]

El olfato resulta del desarrollo y la interacción adecuados de los dos componentes de la vía olfatoria primaria: el epitelio olfativo y el bulbo olfatorio.[18] El epitelio olfativo contiene neuronas sensoriales olfativas, cuyos axones inervan el bulbo olfatorio. Para que las neuronas sensoriales olfativas funcionen correctamente, deben expresar los receptores de olor y las proteínas de transducción adecuadas en los cilios no móviles que se extienden desde la protuberancia dendrítica además de proyectar sus axones hacia el bulbo olfatorio.[19]
Las células del epitelio olfativo, incluidas las neuronas sensoriales olfativas, comienzan a diferenciarse poco después de la inducción de la placoda olfativa . Una vez que las neuronas sensoriales olfativas se diferencian, expresan receptores de olor, que transducen la información del olor del ambiente al sistema nervioso central y ayuda en el desarrollo del mapa del olor.[20] Las neuronas sensoriales olfativas diferenciadas extienden los axones pioneros, que siguen las señales de guía liberadas por el mesénquima subyacente, así como otras señales quimiotróficas liberadas por el telencéfalo.[10] A medida que avanza el desarrollo de la vía olfatoria, más axones inervan el bulbo olfatorio, que se desarrolla a partir de la región más rostral del telencéfalo. La organización y el procesamiento posterior de la información del olor son posibles debido a la convergencia de los axones de las neuronas sensoriales olfativas que expresan los mismos receptores de olor en el mismo glomérulo en el bulbo olfatorio.[21]
Recambio de epitelio olfativo
[editar]Las células del epitelio nasal desde el nacimiento están expuestas a sufrir daños, por estar directamente expuestas a contaminantes transportados por el aire y por ello suelen tener una vida útil corta.[22]
La renovación continua de las neuronas olfativas y su reposición después del daño, es crítica para mantener la integridad funcional del epitelio olfativo.
El neuroepitelio olfativo presenta un reemplazo constante de sus células, cuyas neuronas olfatorias poseen un rango de vida de entre 30-120 días.[23]
El epitelio olfativo contiene dos poblaciones de células madre y progenitoras que mantienen y reconstituyen este tejido durante la vida.[24]
Las células basales horizontales (HBC en inglés), son las células que se dividen lentamente. Las HBC son una población de células madre de reserva que aparecen tarde en el desarrollo y se activan luego de un daño epitelial severo, para reconstitir el epitelio.[25]
Significación clínica
[editar]El epitelio olfativo puede dañarse por inhalación de humos tóxicos, lesiones físicas en el interior de la nariz y posiblemente por el uso de algunos aerosoles nasales. Debido a su capacidad regenerativa, el daño al epitelio olfativo puede ser temporal, pero en casos extremos, la lesión puede ser permanente y provocar anosmia.
Imágenes adicionales
[editar]Complejo de células del epitelio olfativo.
-
Composición de la neurona receptora olfatoria (subtítulos en alemán)
-
epitelio olfativo de cerdo
Referencias
[editar]- ↑ OMS,OPS,BIREME (ed.). «Mucosa Olfatoria». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ Moran, David T.; Rowley Jc, 3rd; Jafek, BW; Lovell, MA (1982), «The fine structure of the olfactory mucosa in man», Journal of Neurocytology 11 (5): 721-746, PMID 7143026, doi:10.1007/BF01153516.
- ↑ a b c Ross M.H., (2007). «Cavidades nasales». Histologia: Texto y Atlas (5a. edición). pp. 686-687.
- ↑ «Dendritic knob». yeast genome.org. Consultado el 28 de julio de 2019.
- ↑ Barrett K.E.; Barman S.M.; Boitano S.; Brooks H.L. «cap11:Olfato y gusto». Ganong. Fisiología médica (25 edición). Consultado el 28 de junio de 2020.
- ↑ Goss, Garrett M.; Chaudhari, Nirupa; Hare, Joshua M.; Nwojo, Raphael; Seidler, Barbara; Saur, Dieter; Goldstein, Bradley J. (1 de marzo de 2016). «Differentiation potential of individual olfactory c-Kit+ progenitors determined via multicolor lineage tracing». Developmental Neurobiology 76 (3): 241-251. ISSN 1932-846X. PMC 4662645. PMID 26016700. doi:10.1002/dneu.22310.
- ↑ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Katz, Lawrence C.; LaMantia, Anthony-Samuel; McNamara, James O.; Williams, S. Mark (1 de enero de 2001). The Olfactory Epithelium and Olfactory Receptor Neurons (en inglés).
- ↑ Schwob, James E.; Jang, Woochan; Holbrook, Eric H.; Lin, Brian; Herrick, Daniel B.; Peterson, Jesse N.; Hewitt Coleman, Julie (1 de marzo de 2017). «Stem and progenitor cells of the mammalian olfactory epithelium: Taking poietic license». Journal of Comparative Neurology (en inglés) 525 (4): 1034-1054. ISSN 1096-9861. PMC 5805156. PMID 27560601. doi:10.1002/cne.24105.
- ↑ a b c Suzuki, Jun; Osumi, Noriko (1 de enero de 2015). Neural crest and placode contributions to olfactory development 111. pp. 351-374. ISBN 9780124077591. ISSN 1557-8933. doi:10.1016/bs.ctdb.2014.11.010.
- ↑ a b Treloar, Helen B.; Miller, Alexandra M.; Ray, Arundhati; Greer, Charles A. (1 de enero de 2010). Menini, Anna, ed. The Neurobiology of Olfaction. Frontiers in Neuroscience. Boca Raton (FL): CRC Press/Taylor & Francis. ISBN 9781420071979.
- ↑ Whitlock, Kathleen E. (1 de enero de 2004). «A new model for olfactory placode development». Brain, Behavior and Evolution 64 (3): 126-140. ISSN 0006-8977. PMID 15353905. doi:10.1159/000079742.
- ↑ a b Forni, Paolo E.; Wray, Susan (1 de octubre de 2012). «Neural crest and olfactory system: new prospective». Molecular Neurobiology 46 (2): 349-360. ISSN 1559-1182. PMC 3586243. PMID 22773137. doi:10.1007/s12035-012-8286-5.
- ↑ a b Moody, Sally A.; LaMantia, Anthony-Samuel (1 de enero de 2015). Transcriptional regulation of cranial sensory placode development 111. pp. 301-350. ISBN 9780124077591. ISSN 1557-8933. doi:10.1016/bs.ctdb.2014.11.009.
- ↑ Maier, Esther C.; Whitfield, Tanya T. (1 de diciembre de 2014). «RA and FGF signalling are required in the zebrafish otic vesicle to pattern and maintain ventral otic identities». PLOS Genetics 10 (12): e1004858. ISSN 1553-7404. PMC 4256275. PMID 25473832. doi:10.1371/journal.pgen.1004858.
- ↑ Bhattacharyya, Sujata; Bronner-Fraser, Marianne (1 de diciembre de 2008). «Competence, specification and commitment to an olfactory placode fate». Development 135 (24): 4165-4177. ISSN 0950-1991. PMID 19029046. doi:10.1242/dev.026633.
- ↑ Maier, Esther C.; Saxena, Ankur; Alsina, Berta; Bronner, Marianne E.; Whitfield, Tanya T. (1 de mayo de 2014). «Sensational placodes: neurogenesis in the otic and olfactory systems». Developmental Biology 389 (1): 50-67. ISSN 1095-564X. PMC 3988839. PMID 24508480. doi:10.1016/j.ydbio.2014.01.023.
- ↑ Farbman, A. I. (1 de febrero de 1994). «Developmental biology of olfactory sensory neurons». Seminars in Cell Biology 5 (1): 3-10. ISSN 1043-4682. PMID 8186394. doi:10.1006/scel.1994.1002.
- ↑ Ravi, Namasivayam; Sanchez-Guardado, Luis; Lois, Carlos; Kelsch, Wolfgang (1 de marzo de 2017). «Determination of the connectivity of newborn neurons in mammalian olfactory circuits». Cellular and Molecular Life Sciences 74 (5): 849-867. ISSN 1420-9071. PMID 27695873. doi:10.1007/s00018-016-2367-y.
- ↑ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Katz, Lawrence C.; LaMantia, Anthony-Samuel; McNamara, James O.; Williams, S. Mark (1 de enero de 2001). The Transduction of Olfactory Signals (en inglés).
- ↑ Valle-Leija, Pablo (1 de enero de 2015). «Odorant receptors signaling instructs the development and plasticity of the glomerular map». Neural Plasticity 2015: 975367. ISSN 1687-5443. PMC 4320882. PMID 25688305. doi:10.1155/2015/975367.
- ↑ Nishizumi, Hirofumi; Sakano, Hitoshi (1 de junio de 2015). «Developmental regulation of neural map formation in the mouse olfactory system». Developmental Neurobiology 75 (6): 594-607. ISSN 1932-846X. PMID 25649346. doi:10.1002/dneu.22268.
- ↑ Pfister S., Dietrich M.G., Sidler C., Fritschy J-M., Knuesel I., Elsaesser R. (2012). «Characterization and Turnover of CD73/IP3R3-positive Microvillar Cells in the Adult Mouse Olfactory Epithelium». Chemical Senses 37 (9): 859-868.
- ↑ Fuentes A., Fresno M.J., Santander H., Valenzuela S., Gutiérrez M.F. (2011). «Sensopercepción olfatoria: una revisión». Rev Med Chile (Revisión) (Santiago) 139 (3): 362-367. Consultado el 28 de junio de 2020.
- ↑ Krolewski RC, Packard A, Jang W, Wildner H, Schwob JE (2012). «Ascl1 (Mash1) Knockout Perturbs Differentiation of Nonneuronal Cells in Olfactory Epithelium». PLoS ONE 7 (12): e51737. doi:10.1371/journal.pone.0051737. Consultado el 27 de junio de 2020.
- ↑ Packard A., Schnittke N., Romano R.A., Sinha S., Schwob J.E. (2011). «ΔNp63 Regulates Stem Cell Dynamics in the Mammalian Olfactory Epithelium». Journal of Neuroscience 31 (24): 8748-8759. doi:10.1523/JNEUROSCI.0681-11.2011. Consultado el 2 de julio de 2020.
Enlaces externos
[editar]- Origen embrionario del sistema sensorial olfativo: mapa del destino, análisis de linaje y especificación de la placoda olfativa aviar y [1]
- Katoh, Hiroyuki; Shibata, Shinsuke; Fukuda, Kimiko; Sato, Momoka; Satoh, Etsuko; Nagoshi, Narihito; Minematsu, Takeo; Matsuzaki, Yumi et al. (2011). «The dual origin of the peripheral olfactory system: placode and neural crest». Molecular Brain 4 (1): 34. PMC 3215936. PMID 21943152. doi:10.1186/1756-6606-4-34.