Grupo protector
En química, un grupo protector es un ente químico que se introduce a una molécula por una modificación química de un grupo funcional, con el fin de obtener quimioselectividad en una reacción química subsecuente. Los grupos protectores juegan un rol importante en la síntesis orgánica en varios pasos.
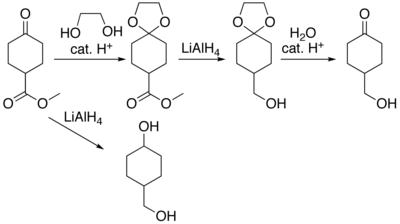
En muchas preparaciones de compuestos orgánicos reactivos, algunas partes específicas de sus moléculas no podrían sobrevivir a los reactivos o ambientes químicos requeridos. Entonces, estas partes o grupos deben ser protegidos. Por ejemplo, el hidruro de aluminio y litio es un agente reductor muy potente, útil debido a su capacidad de reducir a los ésteres a alcoholes. Siempre reaccionará con los grupos carbonilo, y esto no puede evitarse de ninguna forma. Cuando se requiere la reducción de un éster y a la vez existe en la molécula un grupo carbonilo no éster, tiene que impedirse el ataque de los iones hidruro (donados por el LiAlH4) al grupo carbonilo. Esto se puede hacer, por ejemplo, convirtiendo el grupo carbonilo en un acetal, que no reacciona con los hidruros. En consecuencia, al grupo acetal se le denomina grupo protector de los carbonilos. Después de que se completa la etapa que involucra la reducción con hidruros, se elimina el grupo acetal (mediante reacción de hidratación catalizada por ácidos), regenerando el carbonilo original. Este paso se denomina desprotección.
Los grupos protectores son usados más comúnmente en trabajo de laboratorio a pequeña escala y en desarrollos iniciales, más que en procesos de producción industrial, porque su uso agrega pasos adicionales y costo de materiales al proceso. Sin embargo, la disponibilidad de un bloque de construcción quiral puede estos costos adicionales (como el ácido shikímico para el oseltamivir). Aunque se requieren pasos adicionales de síntesis para la protección y desprotección, las reacciones suelen ser más limpias, proceden con mayores rendimientos, y requieren menos optimización con los grupos protectores que sin ellos.
Grupos protectores comunes
[editar]Grupos protectores de alcoholes
[editar]- Acetilo (Ac) - Eliminado por ácido o base. (ver grupo acetoxi)
- Benzoilo (Bz) - Removido por ácidos o bases; más estable que el grupo acetilo.
- Bencilo (Bn) - Removido por hidrogenólisis. Es ampliamente usado en química de azúcares y nucleósidos.
- β-Metoxietoximetil éter (MEM) - Eliminado por ácido.
- Metoximetiléter (MOM) - Eliminado por ácido.
- p-Metoxibenciléter (PMB)- Eliminado por ácido, hidrogenólisis, u oxidación.
- Metiltiometiléter - Eliminado por ácido.
- Pivaloil (Piv) - Eliminado por ácido, base o agentes reductores. Es más fuerte que otros grupos acilo protectores.
- Tetrahidropirano (THP) - Eliminado por ácido.
- Tetrahidrofurano (THF) - Removido por ácido.
- Éter de sililo (lo más populares incluyen al éter de trimetilsilano (TMS), tert-butildimetilsililo (TBDMS) y triisopropilsililo (TIPS) - Eliminados por ácido o iones fluoruro, como el NaF o el TBAF.
- Éteres de metilo - La apertura es por TMSI en DCM o MeCN o cloroformo, el otro método es abrir los éteres de metilo con BBr3 en DCM
- Éteres de etoxietilo (EE) - La apertura es más trivial que con éteres más simple, por ejemplo, con ácido clorhídrico 1N[1]
Grupos protectores de aminas
[editar]
- Acetilo (Ac) - Eliminado por ácido o base. (ver grupo acetoxi)
- Benzoilo (Bz) - Su uso es común en la síntesis de oligonucleótidos para la protección de N4 en la citosina y N6 en la adenina. Es removido por bases, usualmente por tratamientos con amoniaco en fase acuosa o gas, así como metilamina. El benzoilo es muy estable como para ser removido con amidas alifáticas.
- Carbamato - Removido por ácido y calentamiento leve.
- Carbobenciloxi (Cbz) - Eliminado por hidrogenólisis
- p-metoxibencilcarbonilo (Moz o MeOZ) - Eliminado por hidrogenólisis, más lábil que Cbz
- tert-butiloxicarbonilo (BOC), común en síntesis de péptidos en fase sólida - Eliminado por ácido fuerte concentrado (como el HCl o CF3COOH)
- 9-Fluorenilmetiloxicarbonil (FMOC), común en síntesis de péptidos en fase sólida - Eliminado por bases, como la piperidina
- Bencilo (Bn) - Eliminado por hidrogenólisis
- p-metoxibencilo (MPM) - Eliminado por hidrogenólisis, más lábil que el bencilo
- 3,4-dimetoxibencilo (DMPM) - Eliminado por hidrogenólisis, más lábil que el p-metoxibencilo
- p-metoxifenilo (PMP) - Eliminado por nitrato de amonio y cerio(IV) (CAN)
- Tosilo (Ts) - Eliminado por ácido concentrado (HBr, H2SO4) y agentes reductores fuertes (sodio en amoníaco líquido, naftalenuro de sodio)
- Otras sulfonamidas (Nosilo y Nps) - Eliminados por yoduro de samario, hidruro de tributilestaño[2]
Grupos protectores de carbonilo
[editar]- Acetales y cetales - Eliminados por ácido. Normalmente, la apertura de acetales no cíclicos es más fácil que la de acetales cíclicos.
- Acilales - Eliminados por ácidos de Lewis.
- Ditianos - Eliminados por sales de metales o agentes oxidantes.
Grupos protectores de ácidos carboxílicos
[editar]- Ésteres de metilo - Eliminados por ácidos o bases.
- Ésteres de bencilo - Eliminados por hidrogenólisis.
- Ésteres de ter-butilo - Eliminados por ácidos, bases, y algunos reductores.
- Éstes de fenoles 2,6-disustituidos (ejemplo: 2,6-dimetilfenol, 2,6-diisopropilfenol, 2,6-di-ter-butilfenol) - Removidos a temperatura ambiente por metanólisis catalizada con DBU bajo condiciones de alta presión.
- Ésteres de sililo - Eliminados por ácidos, bases y reactivos organometálicos.
Grupos protectores de fosfatos
[editar]- 2-cianoetil - removido por bases diluidas. El grupo es altamente usado en síntesis de oligonucleótidos.
- Metilo (Me) - removido por nucleófilos fuertes (ej. tiofenol).
Grupos protectores de alquinos terminales
[editar]- Alcoholes propargílicos mediante la reacción de Favorskii.
Misceláneos
[editar]- Los alquinos terminales pueden ser protegidos como alcohol de propargilo en la reacción de Favorskii.
- Grupos sililo, especialmente usados en la protección del acetileno.
Protección ortogonal
[editar]La protección ortogonal es una estrategia que permite la desprotección de grupos protectores múltiple uno a la vez, con un conjunto dedicado de condiciones de reacción, sin afectar los otros. Fue introducido en el campo de la síntesis de péptidos por Robert Bruce Merrifield en 1977.[3] Como una prueba del concepto, la deprotección ortogonal se demuestra en una transesterificación fotoquímica por trimetilsilidiazometano, utilizando el efecto cinético isotópico:[4]
Debido a este efecto, el rendimiento cuántico para la desprotección del grupo éster de la derecha está reducido y permanece intacto. Significativamente, al colocar los átomos de deuterio junto al grupo éster de la izquierda o al cambiar la longitud de onda a 254 nm, se obtiene el otro monoareno.
Críticas al uso de grupos protectores
[editar]El uso de grupos protectores esta ampliamente difundido, aunque ha sido criticado.[5] En térmicos prácticos, su uso añade dos pasos (protección y desprotección) a la síntesis, en los cuales (ya sea en uno o en ambos) se puede reducir considerablemente el rendimiento de la reacción. Fundamentalmente, la complejidad añadida impide el uso de la síntesis total en la investigación farmacéutica. En contraste, la síntesis biomimética, no utiliza grupos protectores.
Referencias
[editar]- ↑ Kamaya, Yasushi; T Higuchi (2006). «Metabolism of 3,4-dimethoxycinnamyl alcohol and derivatives by Coriolus versicolor». FEMS Microbiology Letters 24 (2-3): 225-229. doi:10.1111/j.1574-6968.1984.tb01309.x.
- ↑ Moussa, Ziad; D. Romo (2006). «Mild deprotection of primary N-(p-toluenesufonyl) amides with SmI2 following trifluoroacetylation». Synlett (19): 3294-3298. doi:10.1055/s-2006-951530.
- ↑ Merrifield, R. B.; Barany, G.; Cosand, W. L.; Engelhard, M.; Mojsov, S. Pept.: Proc. Am. Pept. Symp. 5th 1977
- ↑ Isotope Effects in Photochemistry: Application to Chromatic Orthogonality Aurélien Blanc and Christian G. Bochet Org. Lett.; 2007; 9(14) pp 2649 - 2651; (Letter) doi 10.1021/ol070820h
- ↑ Baran, Phil S.; Maimone, Thomas J.; Richter, Jeremy M. (2007-03). «Total synthesis of marine natural products without using protecting groups». Nature (en inglés) 446 (7134): 404-408. ISSN 1476-4687. doi:10.1038/nature05569. Consultado el 1 de marzo de 2020.

