Saguinus oedipus
| Mono Tití cabeciblanco | ||
|---|---|---|
 Saguinus oedipus | ||
| Estado de conservación | ||
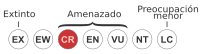 En peligro crítico (UICN 3.1)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Mammalia | |
| Orden: | Primates | |
| Suborden: | Haplorrhini | |
| Infraorden: | Simiiformes | |
| Parvorden: | Platyrrhini | |
| Familia: | Callitrichidae | |
| Género: | Saguinus | |
| Especie: |
S. oedipus (Linnaeus, 1758) | |
| Distribución | ||
 | ||
El tití cabeciblanco, tamarino algodonoso, Mono tití cabeza de algodón, tití piel roja [2] o tamarino cabeza de algodón (Saguinus oedipus) es una especie de primate platirrino de la familia Callitrichidae, de hábitos diurnos y territoriales, endémicos de los bosques del noreste de Colombia . El tití cabeciblanco tiene una distribución muy limitada en el noroeste de Colombia entre el río Atrato y el río Magdalena, en los departamentos de Atlántico, Bolívar, Sucre, Córdoba, y el Noreste Antioqueño, desde el nivel del mar hasta los 1500 metros, también han existido reportes de la especie en frontera con Venezuela.
Tienen una cresta de pelos blanquecinos, desde la frente hasta la nuca, que caen hacia atrás. La espalda es parda y los brazos y piernas blancos o amarillentos y la cola marrón en la base y negra en la punta. Pesan en promedio 500 g.
Comen frutas, néctar, hojas frescas o retoños, insectos y lagartijas. Viven en grupos familiares de 3 a 13 individuos, que se pueden unir a otros grupos y permanecer en grupos de hasta 20 individuos. El período de gestación dura en promedio 170 días, después de los cuales nacen entre una y tres crías y más comúnmente, dos. Las madres cargan las crías la primera semana, luego de la cual el padre y otros integrantes del grupo se hacen cargo, pero entregan cada cría a la madre para la lactancia. Por alguna razón hormonal, mientras la madre procrea, las hijas permanecen inhibidas a pesar de haber llegado a la madurez
Nombres comunes
[editar]Posee gran cantidad de nombres comunes tales como "tití cabeza de algodón", "tití piel-roja", "tití blanco", "tití leoncito", “Baqui”,"tití cabeciblanco" y "bichichi", incluso pueden encontrarse nombres en otros idiomas como "Cotton-top Tamarin" y "Cotton-headed Tamarin" en inglés y "Tamarin Á Perruque", "Tamarin D'Oedipe", "Tamarin Pinché" en francés.[1]
Taxonomía y filogenia
[editar]Fue descrita por Linneo en 1758.[1] HERSHKOVITZ realizó el primer análisis taxonómico de la especie en 1977[3][4] donde clasificó al tití panameño (Saguinus geoffroyi)[4] como subespecie de Saguinus oedipus, que es estrictamente colombiano, basándose en patrones de coloración del pelaje, morfología craneal y mandibular y el tamaño del pabellón auricular.
Otras revisiones realizadas por HERNÁNDEZ- CAMACHO &COOPER (1976) y luego MITTERMEIER Y COIMBRA-FILHO en 1981[3][4] ( MITTEMEIER en 1988 y RYLANDS en 1993;[3] RYLANDS et al (2000)[4])y finalmente GROOVES (2001);[4] Consideran S.oedipus y S. geoffroyi como distintas especies ya que entre estas no existe suficiente grado de diferenciación.
Algunas otras opiniones como THORINGTON (1976)[3] propone que Saguinus oedipus está más relacionado con S. leucopus, que con S. geoffroyi, esto es apoyado posteriormente por el análisis comparativo multivariable de HANIHARA & NATORI (1987)[3] basándose en la morfología dental de un amplio número de especies y las cuales confirman el punto de vista del estudio de 1976.
Finalmente SKINNER (1991)[3] realizó un estudio en el que examinó el peso corporal y un número de caracteres morfológicos; encontrando que S. geoffroyi es significativamente diferente a S. oedipus, este a su vez se relaciona mayoritariamente con S. leucopus, teniendo una similitud en 16 de 17 caracteres estudiados.
Se propone que esta especie de tití cabeciblanco divergió de las otras formas de la Amazonía como Saguinus leucopus, la prueba de esto es evidenciable en la transición de juvenil a adulto donde los patrones de coloración del pelaje presentan cambios significativos y que son similares en las dos especies.[5] Incluso HERSHKOVITZ (1977) propone que la separación entre estas dos especies sucedió en el Pleistoceno, a la altura del río Atrato en la intersección del río Cauca- Magdalena cuando esa zona estuvo cubierta por el mar, allí se generó una barrera geográfica lo que produjo la separación reproductiva y la divergencia de las dos nuevas especies que hoy en día se separan principalmente por el río Atrato.[5]
Anatomía y fisiología
[editar]La piel de la cara es negra, adornada con bandas grisáceas o blancas supra orbitales, presentes también en la esquina del ángulo formado por la mandíbula y los ojos también descritos como mechones coloreados que adornan la cabeza o la cara.[6] El pelaje corporal es generalmente color café o negro, pero bajo las piernas, brazos y partes bajas del cuerpo es blancuzco o amarillento; la es cola rojiza y los genitales se encuentran externamente pigmentados.[5]
Su cuerpo es bastante pequeño, su peso es de 500 gramos en promedio, desde la cabeza hasta la cola rara vez sobrepasan los 370 mm, la cola es ligeramente más larga que el cuerpo y no es prensil. Además es característico del género que en los dígitos poseen uñas como garras, tal como lo describe HOFFMANNSEGG (1807).[6]
Posee pelo sobre todas las superficies externas del cuerpo, excepto sobre las palmas de las manos, plantas de los pies, labios, párpados, borde de las narinas, pezones, ano, pene. El pelaje se distribuye con diferentes densidades a lo largo del cuerpo: las regiones genitales (escroto y zonas púbicas), axilares y la base de la cola el pelo poseen bajas densidades, mientras que en la zona dorsal es muy alta. Posee vibrisas supra orbitales, mistaciales, y en los rinarios, además puede ostentar franjas y verticilos de pelaje de coloraciones llamativas en la zona gular.[5]
Esta especie expresa dos caracteres importantes que pueden ser diagnósticos al momento de su determinación taxonómica, en primer lugar, la reducción de la superficie auditiva donde la oreja es pequeña y tiene la mayor parte de la porción ventral de la lámina auricular profundamente emarginada u obsoleta. Y por otra parte la reducción en la pilosidad (evolutivamente llamada Depilación), principalmente en la zona facial.[5]
El cráneo es contorno, posee un frontal bien redondeado con crestas temporales convergentes en el frontal y el parietal. El perfil nasal es cóncavo, con senos frontales inflados y el borde ventral de la mandíbula en forma de U o V.[5]
En el macho adulto los genitales están profundamente pigmentados, la superficie del pene expuesta es arrugada, junto con glándulas que también son pigmentadas, el escroto es globoso: pedunculado, más ancho que largo. La piel del escroto y los testículos es corrugada, sin pelos excepto en la base. El diámetro del escroto es de 18 mm, el báculo indistinguible; la región perineal y anal están ligeramente pigmentadas o carecen este.[5]
En la hembra los genitales externos son más largos que anchos, el labio mayor es altamente glandular y se encuentra profundamente pigmentado. Las glándulas clitoríferas son glabras y ocasionalmente arrugadas.[5]
Morfología dental
[editar]Los incisivos superiores son espatulados, los centrales son más grandes que los laterales que tienen una forma puntiaguda, los 4 poseen cíngulo lingual. Se dirigen hacia delante de tal manera que no tienen contacto al cerrar la mandíbula.[7]
Similar al género Leonthopithecus, tienen los caninos inferiores con coronas altas que superan a las de los incisivos, con un cíngulo lingual bien desarrollado en el robusto canino, por tanto los caninos son más largos que los incisivos.
Las cúspides bucales están más desarrolladas en los primeros 2 premolares; el primer premolar carece de cúspide y por tanto es algo caninoforme, el tamaño del protocono tiende a incrementa desde el primer al tercer premolar, este último puede tener un talónido distal pequeño.[7] La presencia de cortos colmillos ayuda a roer las cortezas e inducir el flujo de exudados de las plantas.[7]
Esta especie sufre de enfermedades dentales tales como: periodontismo y gingivitis, las cuales provocan principalmente pérdida parcial o total de la porción ósea de las encías.[5]
Fisiología
[editar]EPPLE (1993) reporta que el género posee unas glándulas odoríferas en la región gular-esternal, a mediados del pecho y alrededor de los genitales, y que sus secreciones son despedidas junto con la orina y otras descargas, cuando son frotadas en varios lugares, su función está relacionada con territorio o con brindar información acerca de la identidad, el estatus, la receptividad sexual entre otros factores.[8]
Existen algunos cambios fisiológicos relacionados con el entorno en el que se encuentre el animal, ejemplo de es que el pelaje pueda cambiar con la humedad, puesto que existe una correlación entre la humedad y el crecimiento capilar, indicando que el cabello crece de manera más activa durante periodos extensos de lluvia y suprime su crecimiento, en ocasiones totalmente, en épocas secas.[5]
Distribución geográfica y hábitat
[editar]Esta especie es endémica de Colombia y la frontera con Venezuela.[1][3] Restringido al noroeste de Colombia entre el río Atrato, el bajo Río Cauca (oeste del río Cauca y la isla de Mompós) y el río Magdalena, en los departamentos de Atlántico, Sucre, Córdoba y el oeste de Bolívar, al noroeste de Antioquia (de la región de Urabá, al oeste del río Cauca) y el noreste de Chocó, al este del río Atrato, desde el nivel del mar hasta 1.500 m .[1][3]
Existen algunos grupos en las Islas del Rosario y Parque nacional Tayrona en la Sierra Nevada de Santa Marta . Sin embargo, estas poblaciones fueron fundadas por los animales en cautiverio que fueron lib[9] erados en la zona y las poblaciones remanentes son consideradas como fuera del área de distribución histórica de la especie.[1] También se han visto grupos en la región del Magdalena medio Caldense, en las riberas del río guarino entre la población de Victoria y la autopista Bogotá-Medellín, (avistamientos personales) seriamente amenazados por el avance de terrenos para la ganadería y por las obras de construcción y adecuación de la bocatoma de aguas del acueducto del municipio de la Dorada que afecta los bosques ribereños del río Guarino.
Las especies S. oedipus y S. geoffroyi habitan bosques secos caducos, lo que los diferencia de la mayoría del género, ya que este se encuentra en selva húmeda tropical baja, y prefieren los bosques secundarios y de borde.[10]
Comportamiento
[editar]Dieta
[editar]Los principales componentes de la dieta son insectos (39,4 %), frutos maduros (38,4%), exudados de plantas y néctar (14,4%), su dieta tiene una buena calidad de nutrientes y un alto contenido calórico, lo que es importante para suplir sus necesidades energéticas. Ya que como bien se sabe los animales pequeños tienen mayor costo metabólico por unidad de peso corporal, lo que les dificulta almacenar y utilizar las reservas de grasa de manera eficiente (KLEIBER, 1961).[10][11]
El exudado constituye una fracción grande de la alimentación anual, aprovechándolo sobre todo durante la época seca y a inicios de la temporada de lluvias[10] se han observado aferrándose a los troncos de Anacardium excelsum (Anacardiaceae) y de Spondias mombin (Anacardiaceae), mientras que se alimentan de exudados. En donde invierten más del 14% del tiempo total de la alimentación.[11] Los análisis nutricionales indican que los exudados Anacardium proporcionan una rica fuente de calcio, minerales, así como de proteínas, hidratos de carbono y agua.
Sin embargo esta especie aprovecha gran cantidad de familias de plantas para su alimentación, entre las que se encuentran: Anacardiaceae, Anonaceae, Apocynaceae, Bignoniaceae, Bombacaceae, Boraginaceae, Flacourticaceae, Meliaceae, Moraceae, Myrsinaceae, Rubiaceae, Sapindaceae, Sterculiaceae, entre muchas otras, según RYLANDS.[12]
El patrón estacional de la alimentación de exudado observado en S. oedipus parece coincidir con algunos períodos sensibles del ciclo reproductivo y puede servir para compensar el desequilibrio mineral generado durante la fase terminal de la gestación y la lactancia.[11]
Así, en África, Madagascar, América Central y del Sur, parece haber sido una radiación paralela de primates consumidores de exudados. Cada una de las especies en cuestión presenta una serie de comportamientos y caracteres morfológicos en común. Como los siguientes:[13]
- el tamaño del cuerpo diminuto.
- incisivos procumbentes o especializados.
- clavos tégulas de garra o puntiagudos.
- la habilidad de aferrarse a los grandes troncos verticales.
- de proteínas de insectos una parte importante de la dieta.
- planta de exudados un componente esencial de la dieta.
Locomoción y patrones de comportamiento
[editar]En esta especie se encuentra un caminar primitivo, no muy duradero, cuando corren lo hacen cuadrúpedamente y frecuentemente saltan entre las ramas terminales, descienden de las ramas de manera vertical, la cola o la cabeza adelante.[7]
La actividad de un grupo de Saguinus oedipus inicia a las 05:50 horas de la mañana, y presenta un pico de actividad hasta aproximadamente las 06:50 a. m. La principal actividad diaria es el forrajeo, el cual se desarrolla en un radio de aproximadamente 35 m y durante el cual emiten sonidos o llamados de localización, por medio de los cuales se mantienen en contacto, así mismo se mueven entre los árboles frutales que son visitados más de una vez al día. Se desplazan con una velocidad de 0,12 a 0,24 km por hora y diariamente el grupo avanza entre 1,5 y 1,9 km. cerca al mediodía se toman un breve descanso en un lugar sombreado.[12]
La mayoría de interacciones sociales ocurren alrededor de la comida, el forrajeo es individual y no hay anunciantes de la aparición de un recurso.[12] Se ha observado que los integrantes de este género son los únicos capaces de adherirse a los troncos de los árboles mientras exploran los recursos que la planta les provee, tales como exudados u hoyos de insectos.[10]
Organización social
[editar]Los pequeños grupos familiares tienen en promedio de 3 a 13 individuos, donde 2 a 6 son adultos de ambos sexos, y hay algunos juveniles que son descendientes.[8][12] Generalmente hay mayor cantidad de machos que de Hembras que sean activas reproductivamente.[8][14] Por lo que es normal observar que después de que la cría tiene 6 meses la madre desaparece seguida poco después por los machos originales del grupo.[12] Se ha encontrado que pueden llegar a vivir 25 años.[8]
En general los Saguinus oedipus exhiben una muy baja agresividad, una alta cooperación y alta tolerancia incluso entre machos reproductivamente activos (CAINE (1993))[8]
Reproducción
[editar]Los titíes cabeza de algodón se caracterizan por una estrategia reproductiva que incluye el nacimiento de múltiples crías, generalmente 2 y un sistema de crianza comunal en el que el cuidado infantil es compartida entre todos los miembros del grupo, tanto los criadores y los ayudantes los cuales poseen una inhibición reproductiva, estos son generalmente hijos juveniles de camadas anteriores.[15]
El apareamiento ocurre durante todo el ciclo femenino y durante al menos las primeras 2-3 semanas de embarazo. Por lo que se deduce que no refleja fielmente el estado hormonal de las hembras en la cantidad de cópulas realizadas.[16]
El período de gestación es de 170 a 172 días o al menos 166 días.[16] al nacer presentan una forma única de atención de los parentales, en la que el macho y los otros integrantes participan en una medida sin precedentes, incluso asisten el nacimiento.[8] El tití macho generalmente transporta a los jóvenes desde el momento de su nacimiento, y pasa la cría a una única hembra que realiza los cuidados.[17] Esto concuerda con lo que se ha observado en donde el cuidado de las madres disminuye a lo largo del tiempo, mientras que en este tiempo, que es generalmente 3-5 semanas después del parto es cargado por el padre y los otros hijos, generalmente juveniles mayores.[15]
En las hembras de esta familia se alcanzan un posicionamiento reproductivo seguro según la dominancia, y esta a su vez relacionada con edad.[18] Las hembras pueden permanecer en sus grupos natales con una posición clara de dominancia reproductiva, y las hembras subordinadas pueden ser liberadas de su inhibición cuando son expuestas de nuevo a machos inmigrantes.[18]
Hay problemas evidentes de filopatría frente a la dispersión en estos organismos, ya que son territoriales, evita el incesto, y vive en familias nucleares. Generalmente los hijos tienen 3 opciones:[19]
(a) pueden quedarse con el núcleo familiar esperando heredar alguno o todos los territorios de la familia y puede estar perdiendo un tiempo valioso, sobre todo después de la madurez sexual.
(b) Dejar el núcleo familiar implica renunciar a los recursos familiares, enfrentar peligros desconocidos, mientras se está en la búsqueda de una vacante en otro lugar.
(c)Una tercera alternativa es que la familia de aumente su territorio, lo que permitiría a los hijos dispersarse, lo que representa un compromiso familiar en la que la ayuda de otros miembros de la familia es probable que se necesite.
Estos problemas se incrementan ya que esta especie no es migratoria, tiene una vida larga, y produce más de una cría por vez. Por tanto el espacio para el animal recientemente maduro es probable que sea muy escaso y probablemente esté disponible solo cuando una familia existente disminuya o se desintegre.[19]
Depredación y parasitismo
[editar]Depredación
[editar]Esta especie es depredada por aves rapaces de las familias Accipitridae y Falconidae junto con algunas especies de reptiles como Boa constrictor y Eira barbara (Moynihan, Martin-Humphrey, 1970).[20]
De igual forma se observó algún tipo de comportamiento agresivo de C. capucinus hacia S. oedipus (Neyman, 1977); se ha registrado huidas silenciosas de los titis ante la cercanía de individuos de C. capucinus y vocalizaciones de alarma y huidas cuando han detectado la presencia de Boas (García-Castillo, 1996, 2008) (Proyecto Tití).[20] Las interacciones existentes con Alouatta seniculus son pasivas, incluso alimentándose y descansando simultáneamente en el mismo árbol[10][20] por lo que se sospecha que Cebús es un depredador de estos pequeños micos.[20]
Parasitismo
[editar]Herpesvirus saguinus, Herpesvirus saimirí puede llegar a ser mortal para S. oedipus, además induce a lipomas malignos.
Naturalmente pueden contraer Virus de la estomatitis vesicular (VSV) y el Virus del sarcoma de Rous que en ellos induce fibrosarcomas, rhabdomiosarcomas, osteosarcomas.
Por contacto con humanos contraen: la Influenza tipo A2, de origen asiático, la Hepatitis tipo A, a la cual son muy susceptibles y es de rápida transmisión de saguinus a saguinus.
Puede verse afectado por diferentes especies de los géneros pseudomonas, Escherichia, Klebsiella, Proteus, salmonella y shigella según MURPHY (1972)
Según DEANHART, HOLMES, DEVINE (1967) De la familia mastogophora (flagelados)
- hesamitidos, giardia intestinalis (lambia)
- trichomonadidae, Trichomonas hominis
- tripanosomatidos, Trypanosomaque están dispuestos en 2 secciones:
- ESTERCORARIA: ciclo de desarrollo en el insecto vector completados en heces, transmitido a mamíferos por contaminación, están en todos los órdenes de mamíferos
- SALIVARIA: los cuales desarrollan su ciclo de vida en un insecto hematófago vector que lo completa en un medio salival, y se da un contagio por inoculación o mordida.
De Sufilum sarcodina:
- Entamoeba histolytica: la cual produce amebiasis o disentería amébica
De la clase Sporozoa:
- (Eimeriidae) Eimeria sp
- (Isospora)Isospora arctopitheci, Se han encontrado animales infectados en su rango natural
De la familia Toxoplasmidae (toxoplasma):
- Toxoplasma gondii, el cual es transmitido por heces.
Otros como Strigiformes, Plagiorchiiformes ( Conspicuum conspicuum), Zonorchis (Zonorchis goliath), Athesmia (Athesmia heterolecithodes), Fascioliformes (Echinostoma aphylactum)
Del orden Cyclophyllidae:
- Anoplocephalidae(Oochoristica megastoma)
- Davaineidae (raillietina, Paratrotaenia oedipomidatis, Paratriotaenia sp)
- Hymenolepidae (Hymenolepis cebidarun)
Del orden Pseudophyllidae:
- Diphyllobothriidae (Sprimoetra reptans, Sprimoetra mansonoide, Diphyllobothrium erinacei)
De la familia Rhabtidia:
- Strongyloides ( Strongylodes cebus)
- Stronggylida (Molineus torulosus, Molineus vexillarius)
De la familia Ascarida:
- Ascaris (Ascarid)
- Trypanoxyuris (T. minutus) la cual provoca la muerte. (T. oedipus, T callithricis)
De la familia Subuluridae
- Primasubulura (Primasubulura jacchis)
Del orden Spirurida:
- Spiruridae (Protospirura guianensis)
- Trichospirura (Trichospirura leptostoma)
Del orden Physalopteridae:
- (Physaloptera sp.)
De la familia Filariidae:
- (microfilaria sp.)
Otros como Dipetalonema marmosetae, Diperalonema zakii, y Tetrapetalonema sp.
De Gigantorhychidea:
- Prosthenorchis ( Prosthenorchis elegans, Prosthenorchis spiula, Prosthenorchis lenti)
- larvas de acantocéfalos
Superorden Parasitiformes:
- Superfamilia Ixodoidea
- oArgasidae (Ornithodoros rudis, Ornithodoros talaje)
- oixodidae (Amblyomma sp.)
Superorden Acariformes:
- Familia Trombobiodea
- (Eutrombicula alfreddugesi, Eutrombicula goeldil)
- oistrophoridea (Rhyncoptes ansstosi)
- opsosoptoidea (Cebalgoides cebi)
Interacción con el ser humano
[editar]La especie se encuentra amenazada desde 1969 y hasta 1974 fue incluida en el apéndice 1, por lo cual su exportación es considerada ilegal, ya que se encontraba bajo una fuerte amenaza por la exportación para el comercio de mascotas, zoológicos y la investigación biomédica.[1] Actualmente se encuentra en la categoría CR lo que significa que se encuentra críticamente amenazados, debido a la pérdida acelerada de la población, cerca del 80% en 3 generaciones, es decir más o menos 18 años.[1] El tití cabeza blanca fue incluido en la publicación bianual Los 25 primates en mayor peligro del mundo, 2008-2010.[21]
Existen tres zonas protegidas para la conservación de esta especie: el Parque nacional natural Paramillo (460.000 ha), decretado en 1977, Los Colorados Santuario de Fauna y Flora Silvestres (1000 ha) decretó en 1977 y Reserva Forestal Cerro de Coraza-Monte de Marja (7.460 hectáreas) decretó en 1983. Se introdujeron también Parque nacional natural Tayrona en 1974 (Defler 1994).[1][20]
Medidas para su conservación
[editar]El tití cabeciblanco es uno de los primates más amenazados del mundo. Más de 20.000-40.000 titíes cabeciblancos fueron exportados de Colombia a los Estados Unidos (Hernadez-Camacho & Cooper, 1976) para su uso en investigación biomédica, por tal motivo en 1973 se declararó la especie en peligro de extinción. A partir de esa fecha se estipularon las normas y reglamentos de la CITES para minimizar el riesgo de extinción y número de animales capturados en el medio silvestre para la exportación. Mientras vivían en cautiverio, se descubrió que los titíes cabeciblancos desarrollaban espontáneamente adenocarcinoma de colon y sirvieron como modelo primario de primates no humanos para los estudios de esta enfermedad (Clapp, 1993). Hoy en día muchas de las colonias en cautiverio de titíes cabeciblancos para estudios biomédicos, se han disuelto y la mayoría de los titíes cabeciblancos permanecen en zoológicos, universidades, santuarios privados y en organizaciones privadas.
Proyecto Tití, es un programa de conservación del tití cabeciblanco, que inició en 1987 como el primer estudio de campo a largo plazo sobre esta especie en colaboración con biólogos colombianos, educadores, ONGs Y las autoridades gubernamentales (INDERENA, Ministerio del Medio Ambiente) (SAVAGE 1988, 1993, 1995, 1996, 1997;. SAVAGE et al, 1996a, b, 1997, 2001a, b). La investigación inicial se centró en la comprensión de los factores que influyen en las estrategias reproductivas de esta especie, pero rápidamente se convirtió en un programa de conservación global que incluía los esfuerzos educativos, la creación de capacidad, la formación de estudiantes colombianos, el desarrollo de alternativas económicas, y el desarrollo de un programa de capacitación agrícola para disminuir la presión sobre el bosque por las comunidades locales (Savage y Giraldo 1990;. Savage et al 1990, 1996, 1997). Actualmente, El Proyecto Tití es reconoce como un programa de conservación integral, que tiene como misión promover la conservación a largo plazo de los titíes cabeciblancos y de los bosques en los que habitan. Busca aportar a la conservación de poblaciones silvestres saludables del tití cabeciblanco, en bosques conservados e interconectados, conviviendo en armonía con las comunidades humanas locales y siendo reconocida la especie como símbolo del patrimonio natural de la Costa Caribe colombiana.
Además de los estudios en el campo, ha habido una evaluación importante y amplia del hábitat restante dentro de la distribución histórica del Saguinus oedipus en Colombia, junto con las encuestas para evaluar el número de la población restante. Esta información ha proporcionado importantes conocimientos sobre la viabilidad a largo plazo de esta población dada la tasa actual de destrucción de su hábitat.[1][22]
El Proyecto Titi, empezado por Anne Savage y sus colaboradores colombianos actualmente cuenta con dos sedes de investigación en campo, una en el Parque Natural Regional El Ceibal Mono Tití, en jurisdicción del Municipio de Santa Catalina en Bolívar, y en su propia Reserva “Los Titíes de San Juan”, ubicada en San Juan Nepomuceno, Bolívar (Savag e et al., 1986, 1987, 1988, 1990c, 1996a, etc.).[20][22]
En 2020, con motivo del Día de la Tierra, National Geographic dio visibilidad al Proyecto Tití con un spot sobre el tití cabeciblanco en el que Rosamira Guillén, directora ejecutiva y Premio National Geographic Society/Buffett al liderazgo ambiental en Latinoamérica,[23] resaltaba la necesidad de seguir realizando actividades ciéntificas y sociales para proporcionar un futuro a esta especie.
Galería de imágenes
[editar]Referencias
[editar]- ↑ a b c d e f g h i j Savage, A. & Causado, J. (2010). «Saguinus oedipus». Lista Roja de especies amenazadas de la UICN 2010.3 (en inglés). ISSN 2307-8235. Consultado el noviembre de 2010.
- ↑ Saguinus oedipus (Cotton-headed Tamarin, Cotton-top Tamarin) (en inglés)
- ↑ a b c d e f g h Estrada, A (2006). New perspectives in the study of Mesoamerican primates: distribution, ecology, behavior, and conservation (en inglés). Birkhäuser.
- ↑ a b c d e Defler, T (2003). José Vicente Rodríguez Mahecha, ed. Primates de Colombia (2° edición). Bogotá: Editorial UN.
- ↑ a b c d e f g h i j k l m n ñ o p Hershkovitz, P (1977). Living New World monkeys (Platyrrhini): with an introduction to Primates (en inglés). Living New World monkeys (Platyrrhini): with an introduction to Primates. Consultado el 22 de noviembre de 2010. (requiere registro).
- ↑ a b Eisenberg, John F; Redford, Kent H (1999). Mammals of the Neotropics: The central neotropics: Ecuador, Peru, Bolivia, Brazil. University of Chicago Press.
- ↑ a b c d Simons, F (2007). Primate anatomy: an introduction (en inglés). Academic Press.
- ↑ a b c d e f Nowak, M; Walker, E; Rylands, A; Konstant, W (Walker's primates of the world.). Mammals of the Neotropics: The central neotropics: Ecuador, Peru, Bolivia, Brazil. JHU Press.
- ↑ Avistamientos personales
- ↑ a b c d e Kinzey, W. G; American Anthropological Association Meeting (.1997). New world primates: ecology, evolution, and behavior. Transaction Publishers.
- ↑ a b c Garber, Paul (1984). «Proposed Nutritional Importance of Plant Exudates in the Diet of the Panamanian Tamarin, Saguinus oedipus geoffroyi». Internctional Journal of Primatology 5 (1).
- ↑ a b c d e Neyman, P (1979). Aspects of the ecology and social organization o free-ranging Cotton-Top Tamarins (Saguinus oedipus) and the Conservation Status of the especies (en inglés).
- ↑ Garber, Paul (1980). «Locomotor Behavior and Feeding Ecology of the Panamanian Tamarin (Saguinus oedipus geoffroyi, Callitrichidae, Primates)». Internctional Journal of Primatology 1 (2).
- ↑ Else, J.G (1936). Primate ecology and conservation (en inglés). CUP Archive.
- ↑ a b Price, Eluned (1992). «Contributions to Infant Care in Captive Cotton-Top Tamarins (Saguinus oedipus): The Influence of Age, Sex, and Reproductive Status». Internctional Journal of Primatology 13 (2).
- ↑ a b Brand, H.M; Martin, R.d (1983). «The Relationship Between Female Urinary Estrogen Excretion and Mating Behavior in Cotton-Topped Tamarins, Saguinus oedipus oedipus». International Journal of Primatology 4 (3).
- ↑ Eisenberg, J. F; Muckenhirn, N.A; Rudran, R (1972). «The Relation between Ecology and Social Structure in Primates». Science, New Series 176 (4037).
- ↑ a b Lee, P.C (2001). Comparative primate socioecology (en inglés). Cambridge University Press.
- ↑ a b McGrew, W.C; McLuckie, E (1986). International Journal of Primatology 7 (4).
- ↑ a b c d e f Defler, T (2010). Historia Natural de los Primates colombianos (2° edición). Bogotá: Editorial UN.
- ↑ Mittermeier, R.A.; Wallis, J.; Rylands, A.B.; Ganzhorn, J.U.; Oates, J.F.; Williamson, E.A.; Palacios, E.; Heymann, E.W.; Kierulff, M.C.M., et ál, eds. (2009). Primates in Peril: The World's 25 Most Endangered Primates 2008–2010 (PDF). Ilustrado por S.D. Nash. IUCN/SSC Primate Specialist Group (PSG), International Primatological Society (IPS) y Conservation International (CI). pp. 1-92. ISBN 978-1-934151-34-1. Archivado desde el original el 23 de julio de 2011.
- ↑ a b Pereira-Bengoa, V (2003). Primatología del nuevo mundo biología, medicina, manejo y conservación. Bogotá: Centro de Primatología Araguatos Ltda.
- ↑ Society, National Geographic. «Rosamira Guillen». www.nationalgeographic.org (en inglés). Consultado el 19 de junio de 2021.
Enlaces externos
[editar] Wikispecies tiene un artículo sobre Saguinus oedipus.
Wikispecies tiene un artículo sobre Saguinus oedipus. Wikimedia Commons alberga una galería multimedia sobre Saguinus oedipus.
Wikimedia Commons alberga una galería multimedia sobre Saguinus oedipus.- ARKive - images and movies of the cotton-headed tamarin (Saguinus oedipus)
- Tamarino Cabeza de Algodón
- Primate Info Net Saguinus oedipus Factsheet




