Données: Pka Des Couples de Références, (H
Données: Pka Des Couples de Références, (H
Transféré par
alaadoubekhDroits d'auteur :
Formats disponibles
Données: Pka Des Couples de Références, (H
Données: Pka Des Couples de Références, (H
Transféré par
alaadoubekhTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Droits d'auteur :
Formats disponibles
Données: Pka Des Couples de Références, (H
Données: Pka Des Couples de Références, (H
Transféré par
alaadoubekhDroits d'auteur :
Formats disponibles
2 ème année pharmacie TD N°2
Chimie analytique
Exercice 01:
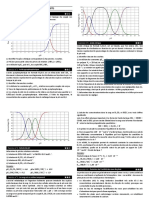
Soient les pKa des couples acido-basiques suivants dans l’eau :
HCl/Cl -= - 6 HF/F-= 3,2 HNO3/NO3- = - 4
HClO/ClO- = 7,5
a) Quels sont les acides soumis à l’effet de nivellement dans l’eau ? Peut-on les classer dans
l’échelle d’acidité par rapport à l’eau ? Justifier.
b) Ecrire la réaction acido-basique correspondant à chacun de ces acides dans l’eau.
c) On considère un autre solvant, le méthanol CH3OH, préciser le comportement des acides HCl et
HNO3 dans ce solvant sachant que leurs pKa sont respectivement égaux à 1,2 et 3,2, justifier.
Ecrire pour chaque acide, la réaction qui a lieu dans ce solvant ?
Donner l’expression de la constante d’acidité dans chacun des cas.
Données : pKa des couples de références, (H3O+/H2O = -1,74) , (H2O/OH- =15,74) ,
(CH3OH2+ / CH3OH = -1 ,38), (CH3OH/CH3O- = 17,98).
Exercice 02:
On considère l’acide méthanoïque HCOOH, on donne le tableau suivant :
Solution S1 S2 S3
[HCOOH] 0,1 0,01 0,001
pH 2,9 3,4 3,9
1) Calculer le coefficient de dissociation pour les trois solutions.
2) Comment varie α en fonction de la dilution ?
Exercice 03:
Calculez le pH des solutions aqueuses suivantes :
a)Acide acétique : 0,15 M.
b) Ammoniac : 0,2 M
c)acide chlorhydrique : 10-8 M
Données : CH3COOH : pKa = 4,7 ; NH3 = 9,2 ; HCl : pKa = - 6,3
Vous aimerez peut-être aussi
- Exercice Mineur-V2-2020-2021Document3 pagesExercice Mineur-V2-2020-2021Sandy GosselinPas encore d'évaluation
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- TD Acide Faible Base Faible Constante Dacidite TS2 2023 2024Document12 pagesTD Acide Faible Base Faible Constante Dacidite TS2 2023 2024fallccheikhPas encore d'évaluation
- Risa Exercices Application CH2 TC Epss 2020Document2 pagesRisa Exercices Application CH2 TC Epss 2020Jean Luc KonanPas encore d'évaluation
- Travaux Dirigés de Chimie N° 5: Exercice 1: Ecriture de La Constante de RéactionDocument2 pagesTravaux Dirigés de Chimie N° 5: Exercice 1: Ecriture de La Constante de RéactionSerigne Fallou PouyePas encore d'évaluation
- Couple Acide - Base: ExercicesDocument16 pagesCouple Acide - Base: ExercicesAhamadi ElhouyounPas encore d'évaluation
- TD1 kechDocument4 pagesTD1 kechhaibsoh2Pas encore d'évaluation
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- S2 - Equilibres Acido-Basiques en Solution AqueuseDocument4 pagesS2 - Equilibres Acido-Basiques en Solution AqueuseZAguirPas encore d'évaluation
- TD1 Réactions de Transfert ProtoniqueDocument2 pagesTD1 Réactions de Transfert ProtoniqueanastytiPas encore d'évaluation
- Solutions Aqueuses IpDocument13 pagesSolutions Aqueuses IpEmmanuel Polvensky100% (1)
- TD #1 Exercice 1: Gaz Parfaits: P Atm PaDocument4 pagesTD #1 Exercice 1: Gaz Parfaits: P Atm Payouness benPas encore d'évaluation
- Série D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFDocument2 pagesSérie D'exercices N°7 - Chimie Série Physique Dipole RLC SCIENCE & MATH - Bac Sciences Exp (2011-2012) MR TLILI TOUHAMI PDFAzizElheni100% (1)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- Exercice de DosageDocument1 pageExercice de DosageghizlanaitlabadPas encore d'évaluation
- Exercice SDocument16 pagesExercice SekaterinafpPas encore d'évaluation
- Serie 12 Acide BaseDocument4 pagesSerie 12 Acide Basemazen chebbiPas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument2 pagesTD Acide Faible-2024-Lsll - Wahabdiopxydj5wh2wb100% (1)
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (2)
- C6 TDDocument2 pagesC6 TDKld Mnt0% (1)
- C.P 22-23 Solution AqueusesDocument2 pagesC.P 22-23 Solution AqueusesdiarratogsibPas encore d'évaluation
- Série D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024Document3 pagesSérie D'éxercices Des Transformations Associées Aux Réactions Acido-Basiques2024sassin2006Pas encore d'évaluation
- Solutionaqueusechap 2TDDocument2 pagesSolutionaqueusechap 2TDHamzaPas encore d'évaluation
- F Spect P 10 CorrigeDocument2 pagesF Spect P 10 CorrigeMohamed EL AminePas encore d'évaluation
- Livre Vers Le Bacc T2Document27 pagesLivre Vers Le Bacc T2Hanine Hmida50% (2)
- Série de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesDocument3 pagesSérie de Chimie - 4ème Année Sc. Exp - Technique & MathématiquesأشرفالمبروكPas encore d'évaluation
- TransReaAcideBaseExercices 16-17 PDFDocument7 pagesTransReaAcideBaseExercices 16-17 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument4 pagesTD Acide Faible-2024-Lsll - WahabdiopAmadou Oury DialloPas encore d'évaluation
- Exercice 1 (6 Points) Cinétique D'une Réaction D'estérificationDocument7 pagesExercice 1 (6 Points) Cinétique D'une Réaction D'estérificationAli RammalPas encore d'évaluation
- Serie Academique Acide Et Base Faibles TS2 2024Document2 pagesSerie Academique Acide Et Base Faibles TS2 2024pfym9dsrt5Pas encore d'évaluation
- Série Réaction Acide BaseDocument5 pagesSérie Réaction Acide BaseScriblouPas encore d'évaluation
- Acides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeDocument5 pagesAcides Faibles Et Bases Faibles Couples Acide-Base & Constante D'AciditeNjuga Sene100% (1)
- Acides Et Bases PCDocument15 pagesAcides Et Bases PCrkibi.khadija2006Pas encore d'évaluation
- TD PH COUPLE-ACIDE-BASE 2016Document13 pagesTD PH COUPLE-ACIDE-BASE 2016Oumar TraoréPas encore d'évaluation
- MPSI2 TD1 R Acido BasiqueDocument4 pagesMPSI2 TD1 R Acido Basiquehidamohamed326Pas encore d'évaluation
- Exercices 2 Réaction S'effectuant Dans Les Deux Sens - CopieDocument1 pageExercices 2 Réaction S'effectuant Dans Les Deux Sens - CopieMohamed SalhPas encore d'évaluation
- (C5) TDDocument4 pages(C5) TDMenePas encore d'évaluation
- Série 1 - Équilibre ChimiqueDocument6 pagesSérie 1 - Équilibre ChimiqueMed RT100% (2)
- Exercices Chapitre 2 Et 3 R actionsAB PDFDocument2 pagesExercices Chapitre 2 Et 3 R actionsAB PDFAnas HasniPas encore d'évaluation
- 201701271158125 (3)Document9 pages201701271158125 (3)Ali RammalPas encore d'évaluation
- ExoDocument2 pagesExotoiliiPas encore d'évaluation
- TD PHDocument7 pagesTD PHghada gattouch100% (1)
- Série pHDocument3 pagesSérie pHnahdyseifPas encore d'évaluation
- Série 4 en Chimie Générale EIB S1Document3 pagesSérie 4 en Chimie Générale EIB S1M'VOULABOLOPas encore d'évaluation
- Exam B Dec 2021Document2 pagesExam B Dec 2021Carmel BABAPas encore d'évaluation
- TD 2 - Chimie: LyceeDocument5 pagesTD 2 - Chimie: LyceeChaimae MaimouniPas encore d'évaluation
- PH Des Solutions Aqueuses EnonceDocument8 pagesPH Des Solutions Aqueuses Enonceaziz0% (1)
- Exercices Corriges Chimie en SolutionDocument157 pagesExercices Corriges Chimie en SolutionKhalid Zeg83% (23)
- Bacc Blanc Chimie 2022Document3 pagesBacc Blanc Chimie 2022luciletsopgni100% (1)
- GROUPE LE SUCCES TleD N21Document1 pageGROUPE LE SUCCES TleD N21romaricagbokaPas encore d'évaluation
- Séries État D'équilibreDocument17 pagesSéries État D'équilibreEl Mehdi SahnounPas encore d'évaluation
- TD Chimie Solution - Acide-Base 23-24Document6 pagesTD Chimie Solution - Acide-Base 23-24lalalolo6721Pas encore d'évaluation
- TD Exercices-Corrigés PDFDocument21 pagesTD Exercices-Corrigés PDFabdelouahed.rhaouiPas encore d'évaluation
- Chimie TD Force Acide BaseDocument3 pagesChimie TD Force Acide BaseJunior Le PyromanePas encore d'évaluation
- DM Nâ°1Document8 pagesDM Nâ°1grégoire beraudPas encore d'évaluation
- TD 1,2 Acide BaseDocument3 pagesTD 1,2 Acide BasehoufihafidaPas encore d'évaluation
- ACFrOgCjgdozTiOq6R5GlhKOzZnBTb6I7JEG_4jpAhlLJ1m30BAk_U3JFHE4rpP499CXw68CtjsR3puDocument16 pagesACFrOgCjgdozTiOq6R5GlhKOzZnBTb6I7JEG_4jpAhlLJ1m30BAk_U3JFHE4rpP499CXw68CtjsR3pulionel GbaguidiPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation