Gaz noble
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| 1 | H | He | ||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| 6 | Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | ⁂ | Uth | Uts | Uto | Ute | Uqn | Uqu | Uqb | ||||||||
| ↓ | ||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||
| ** | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||
| ⁂ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | Ubo | Ube | Utn | Utu | Utb | Utt | Utq | Utp | |||
| Li | Métaux alcalins | Al | Métaux pauvres | |||||||||||||||
| Be | Métaux alcalino-terreux | B | Métalloïdes | |||||||||||||||
| La | Lanthanides | Non-métaux : | ||||||||||||||||
| Ac | Actinides | H | « CHNOPS » et sélénium | |||||||||||||||
| Sc | Métaux de transition | F | Halogènes | |||||||||||||||
| Mt | Nature chimique inconnue | He | Gaz nobles | |||||||||||||||
| Uue | Éléments hypothétiques (dont les superactinides) | |||||||||||||||||
Les gaz nobles, ou gaz rares sont un sous-ensemble d’éléments chimiques du groupe 18 (anciennement « groupe VIIIA », voire « groupe 0 ») du tableau périodique. Ce sont l'hélium 2He, le néon 10Ne, l'argon 18Ar, le krypton 36Kr, le xénon 54Xe et le radon 86Rn, ce dernier étant radioactif, avec une période de 3,8 jours pour le radon 222, son isotope le plus stable. Ils forment une famille d'éléments chimiques très homogène de gaz monoatomiques incolores et inodores chimiquement très peu réactifs, voire totalement inertes pour les deux plus légers — hormis dans des conditions très particulières. L'oganesson 118Og, découvert au début du XXIe siècle, prolonge le 18e groupe, mais ses propriétés chimiques sont encore trop largement méconnues pour pouvoir le ranger dans une quelconque famille ; les effets relativistes d'un noyau atomique très chargé sur son cortège électronique pourraient en altérer suffisamment les propriétés, de sorte que cet élément, qui serait probablement solide et non gazeux, ne serait plus nécessairement un gaz noble.
Les propriétés des gaz nobles s'accordent bien avec les théories modernes décrivant la structure des atomes. Leur couche de valence est saturée, de sorte qu'ils n'établissent normalement pas de liaison covalente avec d'autres atomes, d'où leur inertie chimique. On ne connaît que quelques centaines[a] de composés de gaz nobles, essentiellement du xénon. À pression atmosphérique, la différence entre la température d'ébullition et la température de fusion d'un gaz noble n'excède jamais 10 °C, de sorte qu'ils n'existent à l'état liquide que dans un intervalle de températures très étroit.
On obtient le néon, l'argon, le krypton et le xénon à partir de l'atmosphère terrestre par liquéfaction et distillation fractionnée. L'hélium provient du gaz naturel, dont il est extrait par des techniques de séparation cryogénique. Le radon est généralement isolé à partir de la désintégration radioactive de composés de radium, de thorium ou d'uranium dissous.
La nature chimiquement inerte des gaz nobles les rend utiles pour toutes les applications où les réactions chimiques sont indésirables. L'argon est ainsi utilisé dans les ampoules à incandescence pour éviter l'oxydation du filament de tungstène. Dans un autre registre, l'hélium est utilisé en plongée sous-marine comme gaz respiratoire sous forme d'héliox ou de trimix pour limiter à la fois les turbulences du gaz circulant dans l'équipement respiratoire, la toxicité de l'azote (narcose à l'azote) et la toxicité de l'oxygène (hyperoxie). Les gaz nobles sont par ailleurs utilisés dans des domaines aussi divers que l'éclairage, le soudage, ou encore l'astronautique.

Terminologie
[modifier | modifier le code]L’appellation gaz rares vient de la faible prévalence historique des gaz nobles comme substances chimiques, bien que cette désignation soit techniquement impropre car l'hélium constitue 24 % de la matière baryonique de l'univers, et l'argon 0,93 % de l'atmosphère terrestre au niveau de la mer, de sorte qu'ils ne sont pas rares.
L'appellation gaz inertes rencontrée jadis est tombée en désuétude depuis qu'on a synthétisé près d'un millier de composés et d'espèces chimiques contenant chacun des six gaz rares, bien que ces espèces requièrent souvent — mais pas nécessairement — des conditions hors équilibre très particulières pour exister.
Préconisée par l'IUPAC et le Bulletin officiel du ministère français de l'Éducation nationale[1], l'appellation gaz nobles, issue de l'allemand Edelgas, inventée par le chimiste allemand Hugo Erdmann en 1908 par analogie avec les métaux nobles (tels que l'or, également peu réactif), apparaît donc de plus en plus comme devant légitimement remplacer à terme celle de gaz rares ; c'est celle retenue dans cet article.
Propriétés
[modifier | modifier le code]Les gaz nobles présentent des interactions interatomiques faibles, de sorte que leur température d'ébullition est très basse. Dans les conditions normales de température et de pression, ce sont tous des gaz monoatomiques : le radon est ainsi gazeux alors que sa masse atomique est supérieure à celle du plomb et du bismuth, par exemple. L'hélium se distingue des autres gaz nobles à différents égards : sa température de fusion et sa température d'ébullition sont plus basses que celles de toutes les autres substances connues ; c'est le seul élément connu qui ne peut être solidifié à pression atmosphérique (il faut une pression d'au moins 2,5 MPa à −272,2 °C pour ce faire) ; c'est le seul élément connu présentant le phénomène de superfluidité. Les températures de fusion et d'ébullition des gaz nobles augmentent avec leur numéro atomique, c'est-à-dire en descendant le long de leur colonne du tableau périodique.
La configuration électronique des gaz nobles est caractérisée par le fait que leurs sous-couches s et p externes sont complètes, avec respectivement deux et six électrons[b], de sorte qu'il ne leur reste pas d'électron de valence disponible pour établir une liaison chimique avec un autre atome, en vertu de la règle de l'octet. C'est ce qui explique leur inertie chimique. Cette inertie est plus relative pour le krypton et plus encore pour le xénon, dont on a isolé plusieurs centaines de composés, certains étant stables à température ambiante. Le radon semble également assez réactif, mais sa radioactivité en a freiné l'étude. L'oganesson aurait, selon les simulations numériques, une configuration électronique affectée par des couplages spin-orbite lui conférant une réactivité chimique comparable à celle de la plupart des autres éléments ; les données numériques ci-dessous relatives à l'oganesson sont issues d'extrapolations numériques et sont présentées à titre indicatif, cet élément n'étant a priori pas rangé parmi les gaz nobles.
Élément Masse
atomiqueTempérature
de fusionTempérature
d'ébullitionMasse
volumiqueRayon de
covalenceConfiguration
électronique[2]Énergie
d'ionisationÉlectronégativité Pauling Allen[3] Hélium 4,002 602 u —[c] −268,928 °C 0,178 6 g·L-1 28 pm 1s2 2 372,3 kJ·mol-1 — 4,16 Néon 20,179 7(6) u −248,59 °C −246,046 °C 0,900 2 g·L-1 58 pm [He] 2s2 2p6 2 080,7 kJ·mol-1 — 4,79 Argon 39,948(1) u −189,34 °C −185,848 °C 1,784 g·L-1 106 ± 10 pm [Ne] 3s2 3p6 1 520,6 kJ·mol-1 — 3,24 Krypton 83,798(2) u −157,37 °C −153,415 °C 3,749 g·L-1 116 ± 4 pm [Ar] 4s2 3d10 4p6 1 350,8 kJ·mol-1 3,00 2,97 Xénon 131,293(6) u −111,75 °C −108,099 °C 5,894 g·L-1 140 ± 9 pm [Kr] 5s2 4d10 5p6 1 170,4 kJ·mol-1 2,6 2,58 Radon [222] −71 °C −61,7 °C 9,73 g·L-1 150 pm [Xe] 6s2 4f14 5d10 6p6 1 037 kJ·mol-1 2,2 2,60 Oganesson [294] — 80 ± 30 °C 4,9 à 5,1 g·cm-3 157 pm [Rn] 7s2 5f14 6d10 7p6 839,4 kJ·mol-1 — —
Les gaz nobles jusqu'au xénon ont chacun plusieurs isotopes stables ; le radon, en revanche, n'en a aucun : c'est un élément radioactif. Le radon 222, son isotope le plus stable, présente une période radioactive de 3,8 jours et donne du polonium 218 par désintégration α, qui donne en fin de compte du plomb.
Le rayon atomique des gaz nobles augmente en descendant le long de la 18e colonne en raison du nombre croissant de sous-couches électroniques. La taille de ces atomes détermine plusieurs de leurs propriétés. Ainsi, le potentiel d'ionisation décroît lorsque le rayon atomique augmente car les électrons de valence sont de plus en plus éloignés du noyau et interagissent par conséquent de moins en moins étroitement avec ce dernier. Le potentiel d'ionisation des gaz nobles est le plus élevé des éléments de chaque période, ce qui reflète la stabilité de leur configuration électronique, caractérisée par la saturation de leur couche de valence.
La valeur élevée de leur potentiel d'ionisation est également liée à leur faible réactivité chimique. Les gaz nobles les plus lourds, en revanche, ont une énergie d'ionisation qui devient comparable à celle d'autres éléments chimiques et de certaines molécules. C'est l'observation du fait que l'énergie d'ionisation du xénon est du même ordre que celle de la molécule d'oxygène O2 qui a conduit Neil Bartlett à tenter d'oxyder le xénon avec de l'hexafluorure de platine PtF6, connu pour oxyder l'oxygène, ce qui permit de synthétiser l'hexafluoroplatinate de xénon[d], premier composé du xénon connu.
Les gaz nobles ne sont pas des accepteurs d'électrons susceptibles de former des anions stables : leur affinité électronique est négative.
Les propriétés macroscopiques des gaz nobles sont dominées par leurs faibles forces de van der Waals entre les atomes. Cette force attractive augmente avec la taille des atomes car leur polarisabilité augmente et leur potentiel d'ionisation diminue. Il s'ensuit que, lorsqu'on descend le long de la colonne, les températures de fusion et d'ébullition croissent, de même que l'enthalpie de vaporisation et la solubilité.
Les gaz nobles sont pratiquement des gaz parfaits aux conditions normales de température et de pression, mais les écarts observés par rapport à la loi des gaz parfaits a fourni des éléments clés permettant l'étude des interactions intermoléculaires. Leur potentiel de Lennard-Jones, souvent utilisé pour modéliser les interactions intermoléculaires, a été déduit par John Lennard-Jones à partir de données expérimentales sur de l'argon, avant que le développement de la mécanique quantique fournisse les outils permettant de les comprendre[4]. Les analyses théoriques de ces interactions étaient relativement aisées dans la mesure où les gaz nobles sont monoatomiques, avec des atomes sphériques, de sorte que les interactions entre atomes sont indépendantes de leur directions, c'est-à-dire qu'elles sont isotropes.
Élément Point critique[5] Point triple[5] Spectre d'émission Couleur de décharge Hélium 3 3,309 3 K 114,59 kPa 0,041 19 g·cm-3 Inexistant 

Hélium 4 5,201 4 K 227,5 kPa 0,069 45 g·cm-3 Néon 44,448 K 2,66 MPa 0,483 5 g·cm-3 24,54 K 43,3 kPa 

Argon 150,7 K 4,87 MPa 0,535 g·cm-3 83,798 K 68,892 kPa 

Krypton 209,40 K 5,51 MPa 0,909 g·cm-3 115,96 K 732 kPa 

Xénon 289,777 K 5,88 MPa 1,105 g·cm-3 161,35 K 816 kPa 

Radon[6] 377,7 K 6,19 MPa 1,528 g·cm-3 200,0 K 58,8 kPa
Abondance naturelle
[modifier | modifier le code]L'abondance des gaz nobles dans l'univers est d'autant plus faible que leur numéro atomique est plus grand. L'hélium est le plus abondant d'entre eux, et le deuxième élément le plus abondant dans l'univers après l'hydrogène, constituant environ 24 % de la masse de la matière baryonique. L'essentiel de l'hélium de l'univers a été formée lors de la nucléosynthèse primordiale à la suite du Big Bang, et sa quantité totale augmente régulièrement en raison des réactions de fusion de l'hydrogène en hélium de la nucléosynthèse stellaire[7].
Sur Terre, l'abondance relative des gaz nobles est différente. L'hélium n'est que le troisième gaz noble le plus abondant de l'atmosphère terrestre. L'hélium est en effet trop léger pour que l'hélium primordial ait pu être retenu par la gravité terrestre, de sorte que l'hélium présent sur Terre provient de la désintégration α d'éléments radioactifs tels que l'uranium et le thorium de l'écorce terrestre[8].
L'argon, en revanche, est plus abondant sur Terre que dans l'univers car il provient essentiellement de la capture électronique du potassium 40, présent lui aussi dans l'écorce terrestre, et qui donne de l'argon 40, principal isotope de l'argon terrestre, qui est pourtant assez rare dans le Système solaire : ce phénomène est à la base de la datation par le potassium-argon.
Le xénon est anormalement peu abondant sur Terre, ce qui a longtemps constitué une énigme. Il est possible qu'il soit piégé dans les minéraux[9], le dioxyde de xénon XeO2 pouvant se substituer au dioxyde de silicium SiO2 dans les silicates, comme le quartz.
Le radon se forme dans la lithosphère par désintégration α du radium.
L'hélium est obtenu par distillation fractionnée à partir du gaz naturel, qui peut contenir jusqu'à 7 % d'hélium. Le néon, l'argon, le krypton et le xénon sont obtenus à partir de l'air par liquéfaction puis distillation fractionnée. L'argon est celui dont le coût de revient est le plus bas, tandis que le xénon est le gaz noble le plus cher.
Composés
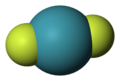
[modifier | modifier le code]La chimie des gaz nobles[10] est étudiée expérimentalement depuis les années 1960 et les travaux de Neil Bartlett[11] sur l'hexafluoroplatinate de xénon. Le xénon est en effet le plus réactif des gaz nobles — hormis le radon, trop radioactif pour être étudié en détail — et il forme de nombreux oxydes et fluorures dans lesquels le xénon présente des états d'oxydation 2, 4, 6 et 8 :
- État d'oxydation +2 : difluorure de xénon XeF2 ;
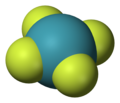
- État d'oxydation +4 : tétrafluorure de xénon XeF4, oxydifluorure de xénon XeOF2, dioxyde de xénon XeO2 ;
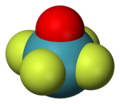
- État d'oxydation +6 : hexafluorure de xénon XeF6, oxytétrafluorure de xénon XeOF4, dioxydifluorure de xénon XeO2F2, trioxyde de xénon XeO3 ;
- État d'oxydation +8 : dioxytétrafluorure de xénon XeO2F4, trioxydifluorure de xénon XeO3F2, tétraoxyde de xénon XeO4.
- Quelques fluorures du xénon
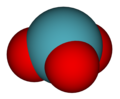
Les trioxyde XeO3 et tétraoxyde XeO4 de xénon sont solubles dans l'eau, où ils donnent deux oxoacides, respectivement l'acide xénique H2XeO4 et l'acide perxénique H4XeO6. Ce dernier donne des perxénates tels que le perxénate de sodium Na4XeO6, le perxénate de potassium K4XeO6, ou encore le perxénate de baryum Ba4XeO6.
- Oxydes et oxoacides du xénon
La grande majorité des composés du xénon produits jusque dans les années 1980 combinaient le fluor et/ou l'oxygène avec le xénon[12] ; lorsqu'ils intégraient d'autres éléments, comme l'hydrogène ou le carbone, c'étaient généralement avec des atomes électronégatifs d'oxygène et/ou de fluor[13]. Néanmoins, une équipe animée par Markku Räsänen de l'Université d'Helsinki a publié en 1995 la synthèse du dihydrure de xénon XeH2, puis celle de l'hydroxyhydrure de xénon HXeOH, de l'hydroxénoacétylène HXeCCH et d'autres composés du xénon[14],[15]. Par la suite, Khriatchev et al. ont publié la synthèse du composé HXeOXeH par photolyse d'eau dans une matrice de xénon cryogénique[16]. Ils ont également fait état des molécules deutérées HXeOD et DXeOD[17]. Le nombre de composés connus du xénon est aujourd'hui de l'ordre du millier, certains présentant des liaisons entre le xénon et le carbone, l'azote, le chlore, l'or ou le mercure[13],[18], tandis que d'autres, observés dans des conditions extrêmes (matrices cryogéniques ou jets gazeux supersoniques) présentent des liaisons entre le xénon et l'hydrogène, le bore, le béryllium, le soufre, l'iode, le brome, le titane, le cuivre et l'argent[18].
L'un des composés les plus inattendus du xénon est le complexe qu'il forme avec l'or. Le cation tétraxénon-or AuXe42+ a en effet été caractérisé par l'équipe allemande de Konrad Seppelt dans le complexe AuXe42+(Sb2F11−)2[19].
Si la chimie des gaz nobles est essentiellement celle du xénon, il existe néanmoins des composés chimiques avec d'autres gaz nobles que le xénon. On connaît ainsi le trioxyde de radon RnO3 ainsi que le difluorure de radon RnF2. Le krypton forme du difluorure de krypton KrF2, lequel donne les cations KrF+ et Kr2F3+[20]. Les gaz nobles plus légers forment également des exciplexes, c'est-à-dire des molécules qui ne sont stables qu'à l'état excité, notamment utilisés pour faire des lasers (laser à excimère). On connaît également de nombreux ions moléculaires de gaz nobles, même des moins réactifs d'entre eux, comme le néon, qui donne les ions HNe+, HeNe+, Ne2+ et NeAr+.
Applications
[modifier | modifier le code]
Les gaz nobles présentent une température de fusion et une température d'ébullition particulièrement basses, d'où leur utilisation comme réfrigérants cryogéniques. En particulier, l'hélium liquide, qui bout à −268,95 °C à pression atmosphérique, est utilisé avec les électroaimants supraconducteurs (en) comme ceux utilisés en imagerie par résonance magnétique (IRM) et en résonance magnétique nucléaire (RMN)[21]. Le néon liquide est également utilisé en cryogénie, malgré le fait qu'il n'atteint pas les températures aussi froides que l'hélium liquide, car il présente une capacité réfrigérante quarante fois supérieure à celle de l'hélium liquide, et plus du triple de celle de l'hydrogène liquide.

L'hélium est utilisé comme constituant des gaz respiratoires à la place de l'azote en raison de sa faible solubilité dans les fluides physiologiques, notamment dans les lipides. Les gaz sont absorbés par le sang et les tissus biologiques sous pression, par exemple en plongée sous-marine, provoquant un effet anesthésiant appelé narcose à l'azote. En raison de sa solubilité réduite, l'hélium est peu absorbé dans les membranes cellulaires, de sorte que l'utilisation de l'hélium à la place de l'azote dans le héliox ou le trimix réduit l'effet narcotique du gaz respiratoire au cours de la plongée. Cette faible solubilité présente également l'avantage de limiter les risques d'accident de décompression, car les tissus comportent moins de gaz dissous susceptible de former des bulles lorsque la pression diminue lors de la remontée. L'argon, quant à lui, est considéré comme le meilleur candidat pour remplir les combinaisons de plongée.

L'hélium est utilisé, pour des raisons de sécurité, à la place de l'hydrogène dans les dirigeables et les ballons, malgré une perte de portance de 8,6 %.
Les gaz nobles sont également utilisés dans de nombreuses applications requérant une atmosphère chimiquement inerte. L'argon est utilisé pour la synthèse de composés sensibles à l'azote atmosphérique. L'argon solide permet d'étudier les molécules très instables en les immobilisant dans une matrice solide à très basse température qui empêche les contacts et les réactions de décomposition[22]. L'hélium peut être utilisé en chromatographie en phase gazeuse (CPG), pour remplir les thermomètres à gaz, et dans les appareils de mesure de la radioactivité, comme les compteurs Geiger et les chambres à bulles. L'hélium et l'argon sont couramment utilisés pour isoler les métaux de l'atmosphère lors de la découpe ou du soudage à l'arc électrique, ainsi que pour divers autres procédés métallurgiques et pour la production de silicium par l'industrie des semiconducteurs.

Les gaz nobles sont couramment utilisés pour l'éclairage en raison de leur inertie chimique. L'argon mélangé à l'azote est utilisé pour remplir les ampoules des lampes à incandescence[5], ce qui prévient l'oxydation de filament en tungstène tout en limitant la redéposition du tungstène sublimé sur les parois de l'ampoule. Le krypton est utilisé pour les ampoules à hautes performance avec une température de couleur plus élevée et un meilleur rendement énergétique car il réduit le taux d'évaporation du filament par rapport aux ampoules à argon ; en particulier, les lampes à halogènes utilisent un mélange de krypton avec de petites quantités de composés d'iode et de brome. Les gaz nobles luisent avec des couleurs particulières lorsqu'ils sont utilisés dans les lampes à décharge, comme les « tubes au néon ». Malgré leur appellation commune, ces lampes contiennent généralement d'autres gaz que du néon comme substance phosphorescente, ce qui ajoutent de nombreuses teintes à la couleur rouge orangé du néon. Le xénon est couramment utilisé dans les lampes au xénon en raison de leur spectre quasiment continu qui ressemble à la lumière du jour, avec des applications comme projecteurs de cinéma et phares automobiles.
Les gaz nobles sont utilisés pour réaliser des lasers à excimères, dont le principe repose sur l'excitation électronique de molécules pour former des excimères. Il peut s'agir de dimères tels que Ar2, Kr2 ou Xe2, ou plus souvent d'espèces halogénées telles que ArF, KrF, XeF ou XeCl. Ces lasers produisent une lumière ultraviolette dont la faible longueur d'onde (193 nm pour ArF et 248 nm pour KrF) permet de réaliser des images à haute résolution. Les lasers à excimères ont de nombreuses applications industrielles, médicales et scientifiques. On les utilise en microlithographie et en microfabrication, technologies essentielles à la réalisation des circuits intégrés, ainsi que pour la chirurgie au laser, comme l'angioplastie et la chirurgie oculaire.
Certains gaz nobles ont des applications directes en médecine. L'hélium est parfois utilisé pour faciliter la respiration des personnes asthmatiques[5], et le xénon est utilisé en anesthésie à la fois en raison de sa solubilité élevée dans les lipides, qui le rend plus efficace que le protoxyde d'azote N2O, et parce qu'il s'élimine facilement de l'organisme, ce qui permet une récupération plus rapide[23]. Le xénon est également utilisé en imagerie médicale des poumons par IRM hyperpolarisée[24]. Le radon, qui n'est disponible qu'en petites quantités, est utilisé en radiothérapie.
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- L'estimation du nombre de composés de gaz nobles observés varie sensiblement selon les auteurs, de quelques centaines à plus d'un millier, essentiellement en raison de la présence de nombreuses espèces chimiques observées hors équilibre (ions moléculaires, exciplexes, espèces observées en matrice cryogénique d'argon gelé, etc.) qui sont, ou ne sont pas, comptées comme composés chimiques véritables.
- Hormis bien sûr l'hélium, qui n'a qu'une sous-couche s et pas de sous-couche p puisqu'il n'a que deux électrons.
- L'hélium à pression atmosphérique n'existe pas à l'état solide ; il se solidifie à 0,95 K sous une pression d'au moins 2,5 MPa.
- Bartlett publia la formule Xe+[PtF6]− pour cette substance, mais elle est très certainement fausse, s'agissant en réalité d'un mélange d'espèces moléculaires comme XeF+[PtF6]−, XeF+[Pt2F11]− et [Xe2F3]+[PtF6]−, qui ne contient pas ce sel précis.
Références
[modifier | modifier le code]- BO physique-chimie.pdf, p 17.
- (en) CRC Handbook of Chemistry and Physics, section 1 : Basic Constants, Units, and Conversion Factors, sous-section : Electron Configuration of Neutral Atoms in the Ground State, 84e édition en ligne, CRC Press, Boca Raton, Floride, 2003.
- (en) Leland C. Allen, « Electronegativity is the average one-electron energy of the valence-shell electrons in ground-state free atoms », Journal of the American Chemical Society, vol. 111, no 25, , p. 9003-9014 (DOI 10.1021/ja00207a003, lire en ligne)
- (en) N. F. Mott, « John Edward Lennard-Jones. 1894-1954 », Biographical Memoirs of Fellows of the Royal Society, vol. 1, , p. 174-184 (DOI 10.1098/rsbm.1955.0013, JSTOR 769250, lire en ligne)
- (en) Peter Häussinger, Reinhard Glatthaar, Wilhelm Rhode, Helmut Kick, Christian Benkmann, Josef Weber, Hans-Jörg Wunschel, Viktor Stenke, Edith Leicht et Hermann Stenger, « Noble Gases », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a17_485, lire en ligne)
- (en) A. G. M. Ferreira et L. Q. Lobo, « On the vapour pressure of radon », The Journal of Chemical Thermodynamics, vol. 39, no 10, , p. 1404-1406 (DOI 10.1016/j.jct.2007.03.017, lire en ligne)
- (en) Alain Coc, Elisabeth Vangioni-Flam, Pierre Descouvemont, Abderrahim Adahchour et Carmen Angulo, « Updated Big Bang Nucleosynthesis Compared with Wilkinson Microwave Anisotropy Probe Observations and the Abundance of Light Elements », The Astrophysical Journal, vol. 600, no 2, , p. 544-552 (DOI 10.1086/380121, Bibcode 2004ApJ...600..544C, arXiv 0309480, lire en ligne)
- (en) P. Morrison et J. Pine, « Radiogenic Origin of the Helium Isotopes in Rock », Annals of the New York Academy of Sciences, vol. 62, no 3, , p. 71-92 (DOI 10.1111/j.1749-6632.1955.tb35366.x, Bibcode 1955NYASA..62...71M, lire en ligne)
- (en) Chrystèle Sanloup, Burkhard C. Schmidt, Eva Maria Chamorro Perez, Albert Jambon, Eugene Gregoryanz et Mohamed Mezouard, « Retention of Xenon in Quartz and Earth's Missing Xenon », Science, vol. 310, no 5751, , p. 1174-1177 (PMID 16293758, DOI 10.1126/science.1119070, Bibcode 2005Sci...310.1174S, lire en ligne)
- Benny Gerber, « La surprenante chimie », Pour la Science, no 341, (lire en ligne, consulté le ).
- (en) Neil Bartlett, « Xenon hexafluoroplatinate Xe+[PtF6]− », Proceedings of the Chemical Society of London, , p. 218 (DOI 10.1039/PS9620000197, lire en ligne)
- (en) G. J. Moody, « A Decade of Xenon Chemistry », Journal of Chemical Education, vol. 51, no 10, , p. 628-630 (DOI 10.1021/ed051p628, Bibcode 1974JChEd..51..628M, lire en ligne)
- (en) Charlie J. Harding et Rob Janes, Elements of the P Block, Cambridge, Royal Society of Chemistry, , 305 p. (ISBN 978-0-85404-690-4, LCCN 2005472333, lire en ligne)
- (en) R. B. Gerber, « Formation of novel rare-gas molecules in low-temperature matrices », Annual Reviews, vol. 55, , p. 55-78 (PMID 15117247, DOI 10.1146/annurev.physchem.55.091602.094420, Bibcode 2004ARPC...55...55G, lire en ligne)
- Bartlett, 2003 : cf. § commençant par « Many recent findings ».
- (en) Leonid Khriachtchev, Karoliina Isokoski, Arik Cohen, Markku Räsänen et R. Benny Gerber, « A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH », Journal of the American Chemical Society, vol. 130, no 19, , p. 6114-6118 (PMID 18407641, DOI 10.1021/ja077835v, lire en ligne)
- (en) Mika Pettersson, Leonid Khriachtchev, Jan Lundell et Markku Räsänen, « A Chemical Compound Formed from Water and Xenon: HXeOH », Journal of the American Society, vol. 121, no 50, , p. 11904-11905 (DOI 10.1021/ja9932784, lire en ligne)
- (en) « Atypical compounds of gases, which have been called 'noble' », Chemical Society Reviews, vol. 36, no 10, , p. 1632-1655 (PMID 17721587, DOI 10.1039/B702109G, lire en ligne)
- (en) Stefan Seidel et Konrad Seppelt, « Xenon as a Complex Ligand: The Tetra Xenono Gold(II) Cation in AuXe42+(Sb2F11−)2 », Science, vol. 290, no 5489, , p. 117-118 (PMID 11021792, DOI 10.1126/science.290.5489.117, Bibcode 2000Sci...290..117S, lire en ligne)
- (en) John F. Lehmann, Hélène P. A. Mercier et Gary J. Schrobilgen, « The chemistry of krypton », Coordination Chemistry Reviews, vol. 233-234, , p. 1-39 (DOI 10.1016/S0010-8545(02)00202-3, lire en ligne)
- (en) C. J. Zhang, X. T. Zhou et L. Yang, « Demountable coaxial gas-cooled current leads for MRI superconducting magnets », IEEE Transactions on Magnetics, vol. 28, no 1, , p. 957-959 (DOI 10.1109/20.120038, Bibcode 1992ITM....28..957Z, lire en ligne)
- (en) I. R. Dunkin, « The matrix isolation technique and its application to organic chemistry », Chemical Society Reviews, vol. 9, , p. 1-23 (DOI 10.1039/CS9800900001, lire en ligne)
- (en) Robert D. Sanders, Daqing Ma et Mervyn Maze, « Xenon: elemental anaesthesia in clinical practice », British Medical Bulletin, vol. 71, , p. 115-135 (PMID 15728132, DOI 10.1093/bmb/ldh034, lire en ligne)
- (en) M. S. Albert et D. Balamore, « Development of hyperpolarized noble gas MRI », Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, vol. 402, nos 2-3, , p. 441-453 (PMID 11543065, DOI 10.1016/S0168-9002(97)00888-7, Bibcode 1998NIMPA.402..441A, lire en ligne)
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- UICPA : Page de liens vers le tableau périodique
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |