Phosgène
| Dichlorure de méthanoyle | |
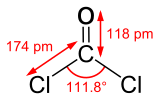
| |
| Structure du phosgène. | |
| Identification | |
|---|---|
| Nom UICPA | Dichlorure de méthanoyle |
| Synonymes |
Chlorure de carbonyle |
| No CAS | |
| No ECHA | 100.000.792 |
| No CE | 200-870-3 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé, liquefié, incolore, d'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | CCl2O [Isomères] |
| Masse molaire[3] | 98,916 ± 0,005 g/mol C 12,14 %, Cl 71,68 %, O 16,17 %, |
| Moment dipolaire | 1,17 ± 0,01 D[2] |
| Propriétés physiques | |
| T° fusion | −118 °C[1] |
| T° ébullition | 8 °C[1] |
| Solubilité | dans l'eau : réaction[1] |
| Masse volumique | 1,4 g cm−3[1] |
| Pression de vapeur saturante | à 20 °C : 161,6 kPa[1] |
| Point critique | 56,7 bar, 181,85 °C[4] |
| Thermochimie | |
| S0gaz, 1 bar | 283,5 J mol−1 K−1[réf. souhaitée] |
| ΔfH0gaz | –219,1 kJ/mol[réf. souhaitée] |
| Cp | |
| Précautions | |
| SGH[7] | |
| H314 et H330 |
|
| SIMDUT[8] | |
   A, D1A, E, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | Toux, sensation de brûlure aux poumons, crachats sanglants, destruction des tissus pulmonaires |
| Peau | Très irritant, surtout sur une peau humide |
| Yeux | Très irritant |
| Ingestion | Nausée et vomissements |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,12 ppm haut : 5,7 ppm[9] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le phosgène, aussi nommé oxychlorure de carbone, dichlorure de méthanoyle ou dichlorure de carbonyle, est un composé chimique de la famille des oxychlorures.
C'est un gaz hautement toxique à température ambiante, qui fait partie des armes chimiques et gaz de combat de la classe des agents suffocants (comme le dichlore, le sulfure d'hydrogène ou le dibrome). En cas d'inhalation, après une phase d'irritation et larmoiements, une période asymptomatique de 20 minutes à plus de 24 heures précède un syndrome de détresse respiratoire aiguë (SDRA) puis la mort. Les symptômes et leur gravité varient selon le degré d'exposition, l'état de santé initial du patient, son degré d'activité physique au moment de l'inhalation, avec des symptômes allant d'une irritation bénigne à un œdème pulmonaire conduisant à une mort rapide[10].
En dépit de ce que son nom pourrait laisser penser, le phosgène ne comporte aucun atome de phosphore et n'appartient donc pas à la famille des composés organophosphorés (dans laquelle on trouve des gaz neurotoxiques comme le sarin) mais à la famille des organochlorés (sa formule chimique est COCl2).
Histoire
[modifier | modifier le code]
Le phosgène fut synthétisé par le chimiste John Davy (1790-1868) en 1812. Ce dernier l'obtint en exposant à la lumière un mélange de monoxyde de carbone et de dichlore. Le nom du composé, formé à partir des radicaux grecs φως / phos (lumière) et γενὴς / gene (créé) fait référence à cette méthode de synthèse.
Le phosgène a été déployé pour la première fois comme arme chimique par les Français en 1915 pendant la Première Guerre mondiale[11]. Ce gaz fut également employé par l'armée allemande le , durant le même conflit, à Verdun[10], mélangé à du dichlore, et sous forme de vague gazeuse dérivante. L’armée française l'utilisa à son tour, mélangé à un opacifiant, sous le nom de « collongite », chargé en obus dès 1916.
L'armée allemande préféra utiliser un de ses dérivés, le chloroformiate de méthyle chloré, pour le charger à l'intérieur de projectiles. Le phosgène fut ainsi le responsable de plus de cent mille gazés pendant la Première Guerre mondiale, « responsable de 80 % des décès causés par les armes chimiques »[10] ; plus tard, il fut utilisé par l'armée impériale japonaise contre les Chinois lors de la guerre sino-japonaise (1937-1945).
Production
[modifier | modifier le code]Le phosgène peut être produit par la réaction de deux gaz : le dichlore (Cl2) et le monoxyde de carbone (CO). Voici l'équation d'oxydoréduction :
- CO + Cl2 → COCl2
Le chlore oxyde le carbone en lui prenant deux électrons. Le carbone perd donc deux électrons, il est oxydé alors que le chlore en captant deux électrons est réduit.
Le carbone passe du nombre d'oxydation +2 à +4 et le chlore de 0 à –1.
Cette réaction est exothermique, c'est pourquoi il faut employer un système réfrigérant (la température peut sinon s'élever dangereusement). Au-delà de 300 °C, le phosgène se décompose, notamment en monoxyde de carbone et en dichlore.
Il peut aussi être considéré comme le dichlorure de l'acide carbonique (Cl-CO-Cl).
Il peut être accidentellement produit et inhalé lors de la combustion de certains produits chimiques[10].
Caractéristiques physicochimiques
[modifier | modifier le code]Dans les conditions ambiantes de température et de pression, il se présente comme un gaz incolore, plus lourd que l'air (densité de vapeur par rapport à l'air : 3,4, masse molaire est de 98,92 daltons). Il bout dès 8,2 °C, ce qui en fait un agent chimique très volatil, non persistant mais pouvant — par temps froid et sans vent — subsister plusieurs jours au niveau du sol ou dans les tranchées, caves, trous, dépressions[10], etc.
Son odeur est proche de celle du foin récemment coupé, c'est ainsi que les soldats l'identifiaient lors de la Première Guerre mondiale. Les poils, cheveux, le feutre et la laine des vêtements peuvent adsorber et piéger des vapeurs de phosgène, puis les relarguer plus tard quand la température augmente (par exemple dans une ambulance, dans n'importe quel autre espace confiné ou dans une salle d'accueil d'hôpital)[10].
Très peu soluble dans l'eau, il s'hydrolyse à son contact en générant de l'acide chlorhydrique (HCl) et du dioxyde de carbone (CO2). Il est très soluble dans les solvants organiques et dans les huiles.
Brûlé ou chauffé à plus de 300 °C, il se décompose en émettant du chlore (Cl2) et du CO2[10].
Toxicité
[modifier | modifier le code]Elle apparaît dès 2 ppm (2 cm3/m3), soit une concentration atmosphérique de 8,0 mg/m3, inférieure au seuil de détection par l'odorat (22 mg/m3) ; certaines personnes à l'odorat plus sensible pourraient cependant le détecter dès 1 ppm (4 mg/m3). Le degré de toxicité varie selon la dose absorbée (cf. concentration, durée d'exposition) ainsi qu'en fonction de l'activité physique des personnes exposées[10].
Si le patient a eu un contact avec du phosgène liquide (à une température inférieure à 8,2 °C), il subit alors des brûlures de la peau et des yeux[10].
Symptômes
[modifier | modifier le code]Après inhalation, ils apparaissent en trois phases[10] :
- Phase de pénétration : au contact du produit, les yeux larmoient et s'irritent. La personne ressent des douleurs ou un prurit oropharyngé, subit une toux irritative, une douleur thoracique et une sensation d'oppression. Ces signes précurseurs de l'intoxication ont une intensité et durée variant selon la dose et l'individu ;
- Phase d'intervalle libre (asymptomatique) : apparaissant dès la fin de l'exposition ou dans les 20 minutes qui suivent, elle dure de 2 à 36 heures. Durant ce temps, du liquide s'accumule dans le tissu interstitiel et alvéolaire. La victime doit alors être mise au repos. Cette phase se conclut par une respiration plus courte et hachée, avec ou sans douleur thoracique, parfois accompagnée de crépitements perceptibles par l'auscultation de la base des poumons. Ces crépitements s'intensifient tout en gagnant les deux champs pulmonaires. Une atteinte alvéolaire ou interstitielle est alors visible à la radiographie. Un œdème aigu du poumon qui apparaît tôt (dès la quatrième heure) est de mauvais pronostic ;
- Phase d'œdème aigu du poumon (OAP) : l'hypoxie induit une cyanose, pendant que l'accumulation de liquide plasmatique dans le poumon induit une hypovolémie et une hypotension puis un syndrome de détresse respiratoire aiguë terminal (le patient se noie dans son propre liquide plasmatique)[10]. Si la victime survit à cet OAP, l'œdème se résorbe progressivement mais des complications infectieuses et séquelles peuvent apparaître (bronchopneumonie, puis bien plus tard une fibrose pulmonaire[10]).
Selon la dose…
[modifier | modifier le code]Dans tous les cas, une hypoxie est induite par une mauvaise diffusion de l'oxygène dans la membrane alvéolocapillaire dégradée[10] :
- à partir de 3 ppm (12 mg de phosgène par m3 d'air), il cause une immédiate et douloureuse irritation des yeux et des muqueuses (due à l'apparition d'acide chlorhydrique), ainsi qu'une simple irritation de la gorge ;
- à partir de 4 ppm (16 mg/m3) l'irritation est plus vive ;
- à partir 4,8 ppm (19,2 mg/m3), une toux apparaît, puis un syndrome de détresse respiratoire aiguë (SDRA).
Mécanismes toxicologiques
[modifier | modifier le code]Inhalé, une partie du phosgène est hydrolysée au contact des muqueuses humides des voies aériennes supérieures en libérant alors de l'acide chlorhydrique, mais comme le phosgène est très peu soluble dans l'eau, une grande partie de la dose inhalée atteint (en quelques secondes) les alvéoles pulmonaires.
Là, le groupe carbonyle de la molécule de phosgène, très réactif, induit des réactions d'acylation avec les fonctions nucléophiles (amine [-NH2], hydroxyle [-OH], sulfhydryle [-SH]), portées par les macromolécules des cellules constituant l'interface air-sang. L'acylation dénature irréversiblement certaines protéines et lipoprotéines des membranes de structure, ce qui dérègle le métabolisme cellulaire et la fonction pulmonaire.
Si la dose n'a pas déjà été mortelle, après quelques jours, le taux de deux enzymes (glutathion réductase et superoxyde dismutase) augmente dans les tissus, marquant le début d'une tentative de réparation ou cicatrisation des tissus lésés par l'organisme. La glycolyse et le métabolisme cellulaire des poumons sont cependant dégradés et les teneurs intracellulaires en ATP et AMP cyclique sont perturbées, alors que l'altération de la barrière sang-air peut encore progresser. Ceci induit une hémolyse et une fuite continue de fluides des capillaires vers l'épithélium interstitiel et les espaces alvéolaires qui finit par dépasser les capacités de drainage lymphatique conduisant à une détresse respiratoire puis un SDRA (syndrome de détresse respiratoire aiguë caractérisé par une apnée et bronchoconstriction/œdème conduisant à la mort en quelques minutes[10].
Antidotes, traitements
[modifier | modifier le code]Ils visent à réoxygéner le sang du patient, tout en augmentant la concentration d'AMP cyclique intracellulaire :
- soit en stimulant sa production (bêta-2 adrénergiques) ;
- soit en inhibant sa dégradation (par un inhibiteur de la phosphodiestérase tels que l'aminopylline)[10].
Soins : dans les cas les plus simples, une simple oxygénothérapie chez le patient mis au repos et en observation suffit, sinon une ventilation artificielle en pression d'expiration positive continue est nécessaire[10].
Usages
[modifier | modifier le code]Malgré son caractère dangereux, le phosgène est couramment utilisé par l'industrie chimique en raison de ses autres propriétés. Les réactions sont généralement bien connues et bien maîtrisées, et des mesures de sécurité très strictes sont adoptées. Le phosgène est majoritairement employé dans la production de polymères, dont les polyuréthanes et les polycarbonates. Il est aussi utilisé pour produire des isocyanates et des chlorures d'acyle destinés aux industries pharmaceutiques, de détergents et de pesticides.


On peut théoriquement employer le phosgène pour séparer les métaux comme l'aluminium et l'uranium de leurs minerais, mais cette technique n'est pas répandue.
Au laboratoire, le phosgène gazeux a depuis longtemps été remplacé par le diphosgène (liquide) ou le triphosgène (cristallin)[12].
Synthèse de polycarbonates
[modifier | modifier le code]Par réaction d'un diol avec du phosgène, on obtient des polycarbonates[13] :
- HO-R-OH + COCl2 → 1/n [-O-R-OC(O)-]n + 2HCl
L'application la plus importante de cette synthèse utilise le bisphénol A, elle permet la production d'un million de tonnes par an de polycarbonate utilisé principalement dans les composants électroniques et en matériau de construction.
Synthèse d'isocyanates
[modifier | modifier le code]La méthode la plus courante pour synthétiser les isocyanates est de faire réagir des amines avec du phosgène[14] :
- R-NH2 + COCl2 → R-NCO + 2 HCl
Les deux amines les plus utilisées sont le 2,4 diaminotoluène et des dérivés de l'aniline, on obtient alors le diisocyanate de toluène et le 4,4'-diisocyanate de diphénylméthylène qui sont utilisés pour la production des mousses de polyuréthane.
Notes et références
[modifier | modifier le code]- PHOSGENE, Fiches internationales de sécurité chimique .
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, 2 et 3, Huston, Texas, Gulf Pub., , 396 p. (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- « Phosgène », sur ESIS (consulté le 11 février 2009).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- « Phosgène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Phosgene », sur hazmap.nlm.nih.gov (consulté le ).
- Beaume, Sébastien (2006), « Prise en charge de victimes en ambiance chimique : concepts actuels et intérêts d’une médicalisation de l’avant », thèse (médecine des armées) ; Faculté de médecine Paris-Descartes (voir chap. 4.4.1.3.1. Le phosgènep p. 101)
- (en) Nye, Mary Jo, Before big science: the pursuit of modern chemistry and physics, 1800–1940, Harvard University Press, (ISBN 0-674-06382-1), p. 193.
- (en) Dr Heiner Eckert et Dr Barbara Forster, « Triphosgene, a Crystalline Phosgene Substitute », Angew. Chem. Int. Ed. Engl., vol. 26, no 9, , p. 894-895 (DOI 10.1002/anie.198708941).
- (en) Volker Serini, « Polycarbonates », Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a21_207).
- (en) R. L. Shriner, « p-Nitrophenyl Isocyanate », Organic Syntheses ; Collective Volume, vol. 2, , p. 453.
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- Fiche toxicologique no 72 [PDF], INRS.
- Fiche internationale de sécurité chimique, sur cdc.gov.
- Les vagues gazeuses dérivantes durant la Première Guerre mondiale, sur guerredesgaz.fr.
- Intoxication aux suffocants, sur guerredesgaz.fr.









