Fosgeen
| Fosgeen | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Structuurformule van fosgeen
| |||||

| |||||
Molecuulmodel van fosgeen
| |||||
| Algemeen | |||||
| Molecuulformule | COCl2 | ||||
| IUPAC-naam | carbonyldichloride | ||||
| Andere namen | carbonylchloride, chloorkooloxide, koolstofoxychloride | ||||
| Molmassa | 98,92 g/mol | ||||
| SMILES | O=C(Cl)Cl
| ||||
| CAS-nummer | 75-44-5 | ||||
| EG-nummer | 200-870-3 | ||||
| Wikidata | Q189090 | ||||
| Beschrijving | Kleurloos prikkelend gas | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H280 - H314 - H330 | ||||
| EUH-zinnen | EUH071 | ||||
| P-zinnen | P260 - P280 - P301+P310 - P305+P351+P338 - P310 | ||||
| Omgang | Dampen niet inademen, blootstelling vermijden | ||||
| Opslag | Bij bewaring in gasfles: bewaartemperatuur mag niet boven 52°C uitkomen. | ||||
| MAC-waarde | 0,02 ml/m³ | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | gasvormig | ||||
| Kleur | kleurloos | ||||
| Dichtheid | (damp, 0°C) 4,531 g/L (vloeistof, 7,6°C) 1,4028 g/cm³ | ||||
| Smeltpunt | −127,76 °C | ||||
| Kookpunt | 7,6 °C | ||||
| Dampdruk | 161.600 Pa | ||||
| Goed oplosbaar in | azijnzuur, benzeen, tolueen | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Fosgeen is een giftig gas dat in de Eerste Wereldoorlog als strijdmiddel is gebruikt. De IUPAC naam is carbonyldichloride en de brutoformule is COCl2. Fosgeen heeft een karakteristieke geur van vers hooi. Het behoort tot de stofklasse der acylhalogeniden. Door de grote elektronegativiteit van het zuurstofatoom en de chlooratomen is het koolstofatoom sterk elektrofiel. Hierdoor kan het heftig reageren met nucleofielen, hetgeen dan ook de hoofdoorzaak is van zijn grote toxiciteit.
Geschiedenis
[bewerken | brontekst bewerken]Ontdekking
[bewerken | brontekst bewerken]Fosgeen werd voor het eerst gesynthetiseerd in 1812 door de Britse scheikundige John Davy. Hij deed dit door chloorgas en koolstofmonoxide bij elkaar te brengen, met actieve kool als katalysator.[1] De energie die nodig was voor de reactie verkreeg hij door zonlicht op het mengsel te laten schijnen. Fosgeen is genaamd naar de Griekse woorden phos (licht) en genesis (geboorte), verwijzend naar de allereerste synthesemethode.[2] Het werd gedurende de 19e eeuw een steeds belangrijkere verbinding, vooral bij de productie van verf.
Fosgeen als wapen
[bewerken | brontekst bewerken]Fosgeen werd voor het eerst als wapen gebruikt in de Eerste Wereldoorlog door de Fransen[3], op 19 december 1915. Bij deze aanval gebruikten de Duitsers ongeveer 4000 cilinders met fosgeengas tegen de Britten. Later gebruikten de Fransen, de Britten en de Amerikanen ook fosgeen als wapen. Vaak werd fosgeen gecombineerd met chloorgas in bommen, hierdoor is het niet duidelijk hoeveel mensen er daadwerkelijk door fosgeen gewond zijn geraakt of dood gegaan. De effectiviteit van deze stof ligt in de manier van oorlogvoering. In de Eerste Wereldoorlog werd veelvuldig gebruikgemaakt van loopgraven, hier kon fosgeen zeer gemakkelijk inkomen omdat het zwaarder is dan lucht. Gebombardeerde loopgraven werden dus eenvoudig en snel gevuld met fosgeen. Na de Eerste Wereldoorlog is fosgeen nauwelijks meer gebruikt als wapen.[1]
Incidenten
[bewerken | brontekst bewerken]In het verleden zijn er een aantal ernstige incidenten geweest met fosgeen, het grootste hiervan vond plaats in de Duitse stad Hamburg. Op 20 mei 1928 ontsnapte er elf ton fosgeen uit een industriële opslagtank, waarna het gas zich langzaam uit de fabriek verspreidde.[4] Binnen 5 dagen raakten meer dan 300 mensen gewond, van wie er 10 overleden. Een meer recent incident met fosgeen vond plaats op 16 juni 2004 in Fuzhou (China): bij een ongeluk in een laboratorium kwam fosgeen vrij, waardoor meer dan 260 mensen gewond raakten en één persoon overleed. Eenzelfde soort incident vond plaats in 2000 in Thailand: in een plasticfabriek ontstond een lek waardoor fosgeen vrijkwam. Hierbij overleed één persoon en raakten er 814 gewond.[1]
Synthese
[bewerken | brontekst bewerken]Er zijn verschillende methoden om fosgeen te bereiden. Op industriële schaal wordt het meestal geproduceerd door koolstofmonoxide te laten reageren met chloorgas:
Hierbij wordt actieve kool gebruikt als katalysator. De reactie wordt uitgevoerd bij een temperatuur van 40° tot 100°C. Omdat er bij de reactie warmte vrijkomt moet het reactievat gekoeld worden, zodat de temperatuur niet boven 100°C uitkomt. Boven deze temperatuur is de reactie minder efficiënt, doordat het evenwicht dan terug naar links wordt gedrongen, hetgeen in overeenstemming is met het principe van Le Châtelier. De aanwezigheid van chloor in het uiteindelijke product is niet gewenst. Er wordt dan ook een kleine overmaat (3-10%) koolstofmonoxide gebruikt.[5] De uitstoot van koolstofmonoxide kan verminderd worden door na de eerste reactie fosgeen en koolstofmonoxide te scheiden. Vervolgens wordt dit koolstofmonoxide in een ander reactievat opnieuw in de reactie gebracht. Dit proces kan een aantal malen herhaald worden, waardoor de uitstoot van koolstofmonoxide aanzienlijk verminderd wordt.[6] Vanwege de gezondheidsrisico's wordt fosgeen in meer dan 99% van de gevallen geproduceerd op de plek waar het verder verwerkt wordt. Geschat wordt dat er in 1998 ongeveer 6 miljoen ton fosgeen werd geproduceerd.[7]
Fosgeen kan ook spontaan ontstaan uit chloroform onder invloed van licht of warmte. Om dit te voorkomen wordt chloroform gestabiliseerd met ethanol en moet chloroform op een donkere plaats bewaard worden.[8]
Op laboratoriumschaal kan fosgeen bereid worden door reactie van zwavelzuur met zwaveltrioxide en tetrachloormethaan:
Toepassing
[bewerken | brontekst bewerken]Industrieel gebruik
[bewerken | brontekst bewerken]Fosgeen werd aanvankelijk in de Eerste Wereldoorlog gebruikt als strijdgas. Tegenwoordig wordt het gebruikt voor de productie van een breed scala aan producten, vooral isocyanaten en zuurchloriden. Verder doet het ook dienst bij de productie van sommige kleurstoffen, pesticiden en geneesmiddelen.
Isocyanaten
[bewerken | brontekst bewerken]De productie van isocyanaten is veruit de belangrijkste toepassing van fosgeen. Hierbij reageert een amine met fosgeen. Het reactiemechanisme is als volgt: het vrij elektronenpaar van het stikstofatoom voert een nucleofiele aanval uit op het zeer elektronenarme koolstofatoom in fosgeen. Hierbij wordt tijdelijk de negatieve lading op zuurstof geconcentreerd en de positieve op stikstof, waardoor een alkoxide en een ammoniumgedeelte ontstaan. Vervolgens wordt de carbonylgroep (een thermodynamisch zeer stabiele functionele groep) hervormd en wordt een chloride-ion uitgestoten. Het chloride-ion kan hierbij een proton van het ammoniumgedeelte opnemen. De verschuiving van ladingen kan nog een keer optreden, maar nu is het een intra-moleculair proces, hetgeen vervolgens een isocyanaat oplevert.
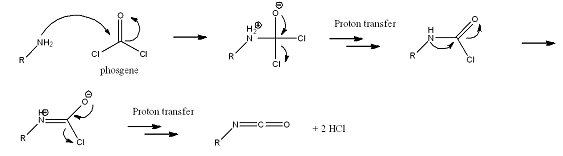
Als in plaats van een mono-amine een diamine wordt gebruikt, is het mogelijk moleculen met 2 isocyanaatgroepen te vormen, waaruit polymeren te vormen zijn. De bekendste toepassing hiervan is de vorming van polyurethanen met een di-isocyanaat (methyleendifenyldi-isocyanaat of 2,4-tolueendi-isocyanaat) en polyolen.
Zuurchloriden
[bewerken | brontekst bewerken]De reactie van een carbonzuur met fosgeen levert een zuurchloride op. Een van de resonantiestructuren van een carbonzuur zal het fosgeen aanvallen op het koolstofatoom. Deze zal tijdelijk een alkoxide vormen. De carbonylgroep wordt echter opnieuw gevormd, waarbij een chloride-ion uitgestoten wordt. Dit chloride zal het koolstofatoom van de carbonylgroep uit het carbonzuur aanvallen, hierbij wordt de dubbele binding met het zuurstofatoom verbroken en ontstaat een alcohol. Later wordt de carbonylgroep opnieuw gevormd en zullen koolstofdioxide en een chloride-ion uitgestoten worden.
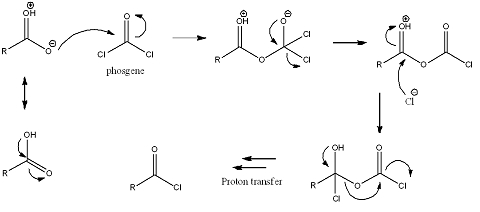
Omdat tijdens de reactie een gas (koolstofdioxide) ontsnapt, is deze reactie aflopend.
Pesticiden
[bewerken | brontekst bewerken]1-naftol reageert in de aanwezigheid van natriumhydroxide met fosgeen tot chloorformiaat. Dit wordt vervolgens door reactie met monomethylamine omgezet tot het pesticide carbaryl:
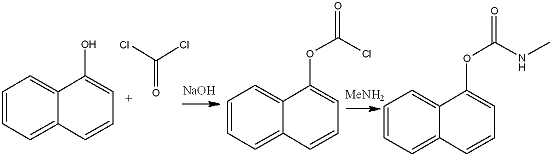
Opname
[bewerken | brontekst bewerken]Fosgeen heeft een kookpunt van 8°C; bij kamertemperatuur is fosgeen dus een gas. De belangrijkste opnameroute voor fosgeengas is via de longen (door inhalatie). De opnamesnelheid is dan afhankelijk van de ademhalingssnelheid en minder van de hoeveelheid bloed die door de longen stroomt. Aangezien fosgeen vaak in vloeibare vorm wordt getransporteerd, kan het in deze vorm in contact komen met de huid of de ogen. Dit vloeibare fosgeen kan echter ook snel verdampen bij kamertemperatuur, waardoor ook bij vloeibaar fosgeen het risico op inhalatie aanwezig is.
Toxicokinetiek
[bewerken | brontekst bewerken]Absorptie
[bewerken | brontekst bewerken]Fosgeen is slecht oplosbaar in water, waardoor het bijna niet wordt opgenomen in de keel, luchtpijp of bronchiën. Het kan daarom gemakkelijk tot diep in de longen, in de pulmonaire alveolen (longblaasjes), terechtkomen.
Metabolisme
[bewerken | brontekst bewerken]Het metabolisme van fosgeen kan op verschillende manier plaatsvinden. De eenvoudigste reactie is de hydrolyse van fosgeen met water tot koolstofdioxide en waterstofchloride.[9] Daarnaast kan fosgeen ook conjugeren met glutathion. Hierbij wordt diglutathionyldithiocarbonaat gevormd.[10][11] Dit lijkt de reden te zijn voor het feit dat fosgeen de hoeveelheid glutathion in het lichaam sterk kan laten afnemen. Alleen wanneer er geen glutathion meer aanwezig is, blijkt fosgeen te reageren met macromoleculen in celmembranen.[10]. Dit toxische effect komt voort uit hetzelfde type reactie als de reactie met glutathion.

Een laatste reactie die plaats kan vinden is een reactie met het zwavelhoudende aminozuur cysteïne. Hierbij worden de elektrofiele eigenschappen van het koolstofatoom gebruikt om een ringsluiting uit te voeren. Zowel het zwavel- als het stikstofatoom in cysteïne binden aan fosgeen. Hierbij ontstaan twee moleculen waterstofchloride. Het product wordt 2-oxothiazolidine-4-carbonzuur genoemd[12] en kan bijvoorbeeld als antioxidant dienen.[13]
Fosgeen kan zelf ook een metaboliet zijn van andere gechloreerde koolwaterstoffen. Zo kunnen zowel chloroform als tetrachloormethaan in het lichaam en in vitro worden omgezet in fosgeen.[11] Hierbij wordt waarschijnlijk een koolstof-waterstofbinding in chloroform geoxideerd door cytochroom P450, waarna het product (trichloormethanol) spontaan ontleedt in waterstofchloride en fosgeen.[14]
Toxicodynamiek
[bewerken | brontekst bewerken]De toxische uitwerking van fosgeen vindt plaats in de longen. Eenmaal in de longen ondergaat het met water hydrolyse tot koolstofdioxide en waterstofchloride (zoutzuur). Dit laatste is een zeer corrosief gas dat zeer gemakkelijke oplosbaar is in water. Dit zal het membraan, dat zuurstofgas doorlaat van de longen tot het bloed, aantasten, waardoor zuurstof dus minder goed opgenomen wordt.[15] Een andere reactie die plaatsvindt in de longen is een acylering door fosgeen aan eiwitten op membranen in de longen. Dit kan leiden tot denaturatie van deze eiwitten en veranderingen in de permeabiliteit van de membranen, waardoor de bloed-luchtbarrière verstoord wordt. Dit kan leiden tot longoedeem. Deze reactie vindt vooral plaats in de bronchioli en longblaasjes, aangezien deze niet door een slijmlaag beschermd worden.[10]
Door binding aan glutathion kan fosgeen glutathion-depletie veroorzaken. Aangezien glutathion als geen andere lichaamsstof de cel beschermt tegen externe biochemische aanvallen (zoals door vrije radicalen), leidt een glutathion-depletie tot extreme kwetsbaarheid van de cel. Celdood (necrose) is in veel gevallen het onvermijdelijke gevolg.[16]
Verder kan fosgeen ook irriterend voor de huid zijn. Door de kleine omvang van de molecule en haar lipofilie, zal ze gemakkelijk opgenomen worden in de huid. Eenmaal daar kan het fosgeen, vanwege zijn elektrofiele karakter, vrij gemakkelijk reageren en zo irritatie en zelfs brandwonden veroorzaken.[17]
Symptomen
[bewerken | brontekst bewerken]Fosgeen vertoont bij verschillende concentraties verschillende symptomen:
- 3 ppm: irritatie aan de ogen, neus en ademhaling, afhankelijk van de dosis die geïnhaleerd is, kan schade ontstaan aan de bloedsomloop.
- 10 ppm: irritatie aan ademhalingsorganen met kans op een permanente beschadiging. Dit kan zich pas na enkele uren openbaren.
- 150 ppm: kan zich openbaren als longoedeem, afhankelijk van de inhalatie kan dit pas na 20 uur gebeuren. Bij een hogere dosis gebeurt dit al binnen enkele uren, door inspanning wordt het extra versterkt. Medische behandeling is daarom genoodzaakt. Behalve een bloedanalyse, zijn bij een röntgenscan van de long vaak in een vroeg stadium (al voor dat de klinische symptomen zich openbaren) de verschijnselen van een longoedeem te zien.
- 300 ppm: mogelijkheid tot overlijden (ook na 24 tot 30 uur na de blootstelling)
Fosgeenvergiftiging is verraderlijk omdat er een latente periode optreedt waarin het slachtoffer zich prima voelt en zelfs euforisch kan zijn, alvorens na enkele uren de symptomen verschijnen.
Behandeling
[bewerken | brontekst bewerken]Er is geen specifiek tegengif voor fosgeen, maar er kunnen wel tal van andere maatregelen worden getroffen. Over het toedienen van geneesmiddelen zijn geen goede onderzoeksresultaten beschikbaar en dit is dan ook nog punt van discussie.[1]
Inademing
[bewerken | brontekst bewerken]Fosgeen is zeer giftig bij inademing. Langdurige blootstelling aan lage concentraties kan leiden tot longoedeem, ook op de langere termijn kunnen nadelige gevolgen optreden. Wanneer iemand fosgeen heeft ingeademd moet het slachtoffer eerst verplaatst worden naar een onbesmette ruimte met frisse lucht. Hierbij moet adembescherming gebruikt worden. Vervolgens is het noodzakelijk om een arts te waarschuwen, ook als het slachtoffer beweert dat hij zich prima voelt en dat er niets aan de hand is. Als de ademhaling stopt dient kunstmatige beademing toegepast te worden.[18]
Contact met huid of ogen
[bewerken | brontekst bewerken]Wanneer fosgeen in contact komt met de huid of de ogen kunnen brandwonden ontstaan op de huid en het hoornvlies. Dit kan leiden tot vertroebeling van het zicht. Bij contact met fosgeen dienen de ogen en/of de huid onmiddellijk gedurende minimaal 15 minuten gespoeld te worden met water. Besmette kledij moet zo snel mogelijk verwijderd worden.[19] Aangezien hierbij vaak sprake is van vloeibaar fosgeen, moet de hulpverlener beschermende kleding dragen.
Zie ook
[bewerken | brontekst bewerken]Externe links
[bewerken | brontekst bewerken] fosgeen - International Chemical Safety Card
fosgeen - International Chemical Safety Card- (en) Gegevens van fosgeen in de GESTIS-stoffendatabank van het IFA
- MSDS van fosgeen
- ↑ a b c d https://emedicine.medscape.com/article/832454-overview. Gearchiveerd op 10 april 2023.
- ↑ http://www.hpa.org.uk/web/HPAwebFile/HPAweb_C/1202487130304. Gearchiveerd op 7 juli 2011.
- ↑ Nye, Mary Jo (1999). Before big science: the pursuit of modern chemistry and physics, 1800 - 1940. Harvard University Press, Cambridge, Mass.. ISBN 978-0-674-06382-2.
- ↑ http://www.inchem.org/documents/ehc/ehc/ehc193.htm
- ↑ U.S. Patent 4764308 "Process for the production of phosgene with simultaneous generation of steam"
- ↑ http://www.faqs.org/patents/app/20090143619. Gearchiveerd op 24 september 2015.
- ↑ http://www.inchem.org/documents/hsg/hsg/hsg106.htm#SectionNumber:1.5
- ↑ https://web.archive.org/web/20110106175851/http://www.bath.ac.uk/internal/bio-sci/bbsafe/chloroform.htm
- ↑ CBRNE - Lung-Damaging Agents, Phosgene, Joy C Wethern / Kermit D Huebner
- ↑ a b c Toxicity, Phosgene, Daniel Noltkamper / Stephen W Burgher
- ↑ a b The formation of diglutathionyl dithiocarbonate as a metabolite of chloroform, bromotrichloromethane and carbon tetrachloride, Pohl LR et al, Lab. of Chem. Pharmacol., National Heart, Lung, and Blood Inst., National Inst. of Health, Bethesda, Md. 20205
- ↑ Syntheses and Properties of 2-Oxothiazolidine-4-carboxylic Acid and Its Derivatives, Takeo Kaneko, Takeo Shimokobe, Yoshimoto Ota, Ekido Toyokawa, Toshishige Inui and Tetsuo Shiba, Bulletin of the Chemical Society of Japan, Vol.37 , No.2(1964)pp.242-244
- ↑ A Prodrug of Cysteine, L-2-Oxothiazolidine-4-carboxylic Acid, Regulates Vascular Permeability by Reducing Vascular Endothelial Growth Factor Expression in Asthma, Kyung Sun Lee et al.
- ↑ Pohl LR et al; Biochem Biophys Res Commun 79 (3): 684-91 (1977)
- ↑ John A Timbrell - Principles of Biochemical Toxicology 4th Ed (page 205)
- ↑ https://web.archive.org/web/20091104104218/http://www.nijbakker-morra.nl/documenten/2005%20Hulsman%20-%20Achtergrond%20artikel.pdf
- ↑ Derek, https://web.archive.org/web/20110814124506/http://dereknetworked.lhasalimited.org/
- ↑ https://web.archive.org/web/20160305001803/http://baical-nl-be.airliquide.com/nl-BE/Msdsnl/099.pdf
- ↑ http://www.idph.state.il.us/Bioterrorism/factsheets/phosgene.htm. Gearchiveerd op 6 juni 2023.





