Sulfure de gallium(III)
| Sulfure de gallium(III) | |||
| |||
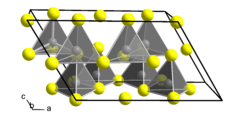
| __ Ga __ S Maille cristalline du sulfure de gallium(III) |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.031.526 | ||
| No CE | 234-692-2 | ||
| PubChem | 16684827 | ||
| Apparence | solide inodore[1] | ||
| Propriétés chimiques | |||
| Formule | Ga2S3 |
||
| Masse molaire[2] | 235,641 ± 0,017 g/mol Ga 59,18 %, S 40,82 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 255 °C[1] | ||
| Masse volumique | 3,77 g/cm3[1] à 20 °C 3,74 g/cm3[3] (polymorphe α) 3,67 g/cm3[3] (polymorphe β) |
||
| Précautions | |||
| SGH[1] | |||
| H314, EUH032, P280, P310, P301+P330+P331, P303+P361+P353 et P305+P351+P338 |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
| modifier |
|||
Le sulfure de gallium(III) est un composé chimique de formule Ga2S3. Il s'agit d'un solide blanc à jaune[3], inodore, soluble dans les acides en solution aqueuse et qui s'hydrolyse lentement dans l'air avec libération de sulfure d'hydrogène H2S[4] :
Structure
[modifier | modifier le code]Ga2S3 cristallise essentiellement sous deux polymorphes : une forme α à basse température de structure blende (cubique F43m no 216) et une forme β à haute température de structure wurtzite (hexagonale P63mc no 186), avec une transition de phase vers 550 à 600 °C. Après plusieurs jours de recuit à 1 000 °C, il se forme une structure cristalline monoclinique α’ du groupe d'espace Cc (no 9) avec pour paramètres a = 1 111 pm, b = 639,5 pm, c = 702,1 pm et β = 121,2° conduisant à un arrangement ordonné des atomes métalliques[3],[5],[6].
Synthèse
[modifier | modifier le code]Le sulfure de gallium(III) peut être obtenu en faisant réagir du gallium métallique avec du soufre élémentaire à 1 250 °C[3] :
Il est également possible de procéder par réaction de l'oxyde de gallium(III) Ga2O3 ou de l'hydroxyde de gallium(III) Ga(OH)3 avec le sulfure d'hydrogène H2S[3] :
Propriétés
[modifier | modifier le code]Les sulfures ternaires de la forme MIGaS2, MIIGa2S4 et MIIIGaS3 ont été étudiés en raison de leurs propriétés électriques particulières, et certains être obtenus par des réactions de Ga2S3 avec des sulfures de métal[7], comme CdGa2S4 à partir de sulfure de cadmium CdS :
- Ga2S3 + CdS ⟶ CdGa2S4.
Bien que Ga2S3 ne génère pas lui-même de verres, il peut réagir avec des sulfures de terres rares pour former des verres de chalcogénures, par exemple avec le sulfure de lanthane(III) La2S3 pour former des verres de sulfures de lanthane et de gallium (en) (La,Ga)2(O,S)3, semiconducteurs ayant des propriétés optiques intéressantes[8].
Notes et références
[modifier | modifier le code]- « Fiche du composé Gallium(III) sulfide, 99.999% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart, 1975, p. 857. (ISBN 3-432-02328-6)
- (en) A. J. Downs, Chemistry of Aluminium, Gallium, Indium, and Thallium, Springer, 1993, p. 162. (ISBN 0-7514-0103-X)
- (en) J. Goodyear, W. J. Duffin et G. A. Steigmann, « The unit cell of α-Ga2S3 », Acta Crystallographica, vol. 14, no 11, , p. 1168-1170 (DOI 10.1107/S0365110X61003399, lire en ligne).
- (en) C. Y. Jones, J. C. Bryan, K. Kirschbaum et J. G. Edwards, « Refinement of the crystal structure of digallium trisulfide, Ga2S3 », Zeitschrift für Kristallographie - New Crystal Structures, vol. 216, nos 1-4, , p. 349-350 (DOI 10.1524/ncrs.2001.216.14.349, lire en ligne).
- (en) Andrew R. Barron et Andrew N. MacInnes, « Gallium: Inorganic chemistry », R. Bruce King, Encyclopedia of Inorganic Chemistry, John Wiley and Sons, 1994, p. 100-110. (ISBN 0-471-93620-0)
- (en) Robert Fairman et Boris Ushkov, Semiconducting Chalcogenide Glass III: Applications of Chalcogenide Glasses, Elsevier, 2004. (ISBN 978-0080541068)



