Sunitinib
| Sunitinib | |
| |
| Identification | |
|---|---|
| No CAS | |
| Code ATC | L01 |
| PubChem | 5329102 |
| Propriétés chimiques | |
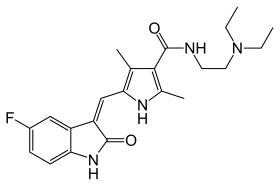
| Formule | C22H27FN4O2 [Isomères] |
| Masse molaire[1] | 398,473 8 ± 0,020 9 g/mol C 66,31 %, H 6,83 %, F 4,77 %, N 14,06 %, O 8,03 %, |
| Inhalation | = |
| Données pharmacocinétiques | |
| Liaison protéique | 95 % |
| Métabolisme | Hépatique |
| Demi-vie d’élim. | 40 à 60 heures |
| Excrétion |
Fécale (61 %) et |
| Considérations thérapeutiques | |
| Voie d’administration | Orale |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le sunitinib (DCI) est un médicament destiné au traitement du cancer du rein avancé et/ou métastatique et des tumeurs stromales digestives, en cas d'échec à l'imatinib.
Il est développé par les laboratoires Pfizer qui le commercialise sous le nom de Sutent.
Mode d'action
[modifier | modifier le code]Il s'agit d'un inhibiteur de plusieurs tyrosines kinases, dont les récepteurs au facteur de croissance de l’endothélium vasculaire, au PDGF (en), au CD117. Il bloque ainsi des signaux de transduction, inhibant la croissance tumorale, l'angiogenèse, la formation de métastases[2].
Efficacité
[modifier | modifier le code]Il améliore la survie des tumeurs neuroendocriniennes pancréatiques[3] celle des tumeurs stromales digestives résistantes à l'imatinib[4].
Il a été testé dans certains types de mélanome, avec un succès initial mais apparition de résistance[5].
Il est largement utilisé en première ligne dans le cancer du rein métastatique mais le taux de réponse peut chuter au bout de quelques mois[6]. Les patients réfractaires ont alors un mauvais pronostic[7]. Cette résistance serait due à des modifications de type épigénétique avec une expression augmentée du EZH2 (en)[8].
Effets secondaires
[modifier | modifier le code]Il existe un certain degré de toxicité pour le cœur[9].
Notes et références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Aparicio-Gallego G, Blanco M, Figueroa A et al. New insights into molecular mechanisms of sunitinib-associated side effects, Mol Cancer Ther (de), 2011;10:2215–2223.
- (en) Raymond E, Dahan L, Raoul JL et al. Sunitinib malate for the treatment of pancreatic neuroendocrine tumors, N Engl J Med, 2011;364:501–513.
- (en) Younus J, Verma S, Franek J, Coakley N, Sunitinib malate for gastrointestinal stromal tumour in imatinib mesylate-resistant patients: recommendations and evidence, Curr Oncol (en), 2010;17:4–10.
- (en) Minor DR, Kashani-Sabet M, Garrido M, O’Day SJ, Hamid O, Bastian BC, Sunitinib therapy for melanoma patients with KIT mutations, Clin Cancer Res, 2012;18:1457–1463.
- (en) Morais C, Sunitinib resistance in renal cell carcinoma, Journal of Kidney Cancer and VHL, 2014;1:1–11.
- (en) Busch J, Seidel C, Weikert S et al. Intrinsic resistance to tyrosine kinase inhibitors is associated with poor clinical outcome in metastatic renal cell carcinoma, BMC Cancer (en), 2011;11:295.
- (en) Adelaiye R, Ciamporcero E, Miles KM et al. Sunitinib dose escalation overcomes transient resistance in clear cell renal cell carcinoma and is associated with epigenetic modifications, Mol Cancer Ther (de), 2015;14:513–522.
- (en) Chu TF, Rupnick MA, Kerkela R et al.. Cardiotoxicity associated with tyrosine kinase inhibitor sunitinib, Lancet, 2007; 370:2011-2019.
Liens externes
[modifier | modifier le code]- Compendium suisse des médicaments : spécialités contenant Sunitinib
- Page spécifique sur Le Vidal.fr
- Sutent (Sunitinib sous forme de malate) : Notices, Mentions légales et Avis de transparence sur www.pfizer.fr
