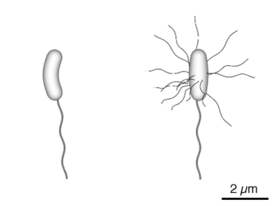
Vibrio cholerae
| Domaine | Bacteria |
|---|---|
| Embranchement | Proteobacteria |
| Classe | Gammaproteobacteria |
| Ordre | Vibrionales |
| Famille | Vibrionaceae |
| Genre | Vibrio |
Vibrio cholerae (le vibrion cholérique ou le bacille virgule en français) est une bactérie à gram négatif, en forme de bâtonnet incurvé, mobile et responsable chez l'Homme du choléra, une maladie épidémique contagieuse.
Histoire
[modifier | modifier le code]Pendant des siècles, la maladie reste inconnue en Europe, se propageant surtout en Asie et en Afrique. La première mention de cette maladie en Europe est faite en 1503 par un officier portugais revenant des Indes, racontant une maladie y ayant fait 20 000 morts. Elle apparait en Europe au début du XIXe siècle pour faire l'objet d'une foule d'interprétations et de théories de la part des médecins.
C'est lors de l'épidémie de choléra de Broad Street en 1854 que la compréhension de la maladie connait une avancée majeure. On se rendit compte que la maladie frappait à proximité de certains puits, suggérant une contamination par l'eau. Mais cette hypothèse ne fut pas immédiatement admise à l'époque.
En 1849, William Budd décrit des corps microscopiques dans des selles de cholériques, qu'il présente comme des champignons causant le choléra[1]. La nature végétale de ces corps est d'abord discutée par des botanistes, comme le français Charles Robin dans son Histoire des végétaux parasites qui croissent sur l'homme et sur les animaux vivants (1853) ou l'allemand Ernst Hallier (1831-1904) dans Das Cholerakontagium (1867)[2].
Entretemps la découverte et l'observation correcte de l'agent responsable du choléra est faite par l'anatomiste italien Filippo Pacini qui décrit un vibrion recourbé en 1854. Mais ces résultats passent inaperçus à cause de la prédominance de la théorie des miasmes, la publication restera longtemps ignorée, enfouie dans une des bibliothèques de Florence, pour être reconnue et republiée en 1924[3].
Trente ans plus tard, en 1883, Robert Koch, qui n'est pas au courant des résultats de Pacini, publie le résultat de ses travaux effectués en Égypte durant la cinquième pandémie. Il isole et identifie un bacille incurvé qu'il nomme Kommabacillus, Vibrio comma ou bacille virgule. Koch poursuit ses recherches en Inde où il réussit la première culture pure du vibrion en 1884.
Si Pacini doit être considéré comme le vrai découvreur du vibrion cholérique, il n'en reste pas moins que c'est Koch qui a su convaincre la communauté scientifique. Il a pu le faire d'abord par sa rigueur méthodologique (« élégance technique[2] ») et surtout en intégrant cette découverte au sein d'une théorie scientifique générale sur la nature, les mécanismes de transmission et les observations épidémiologiques des maladies infectieuses[1].
En 1965, la bactérie est renommée en Vibrio cholerae Pacini, 1854 en hommage à Filippo Pacini.
Habitat
[modifier | modifier le code]La bactérie Vibrio cholerae vit dans l'eau et a une grande capacité de survie environnementale. Elle tolère très bien la salinité mais ne se retrouve pas vraiment en mer mais plutôt dans les estuaires, les rivières et les nappes phréatiques et toutes les sources d'eau contaminées par des déjections humaines. La sueur, riche en vibrions, joue un rôle important dans les contaminations inter-humaines surtout en zone tropicale sèche.
Il semble que certains crustacés (notamment les crevettes[4]) jouent un rôle de vecteur grâce à des récepteurs situés sur leurs carapaces dorsales[5].
Pouvoir pathogène
[modifier | modifier le code]Le choléra est une maladie exclusivement humaine avec pour seul réservoir, semble-t-il, l'être humain. Il touche les zones surpeuplées et défavorisées car l'absence d'hygiène hydrique et la dénutrition favorisent la contraction de la maladie. Il touche les âges extrêmes de la vie et en particulier les enfants.
Depuis 1992, il n'y a pas eu de cas endogène humain en France. C'est à cette même date que l'on découvre une nouvelle souche qui est une adaptation de la souche historique précédente qui s'appelait Vibrio cholerae O1. Cette nouvelle souche nommée Vibrio cholerae O139 semble avoir acquis une capacité à disséminer des infections qui va en faire la source d'une hypothétique 8e pandémie, au Bangladesh[6].
Le Vibrion est très contagieux car il contamine les selles massivement (jusque 108 vibrions par ml de selles), la diarrhée cholérique est très importante en volume, avec des pertes en eau qui peuvent atteindre 15 à 20 litres par jour occasionnant en même temps un déséquilibre ionique avec acidose et hypokaliémie. Le vibrion étant détruit dans l'estomac par l'acidité gastrique, il faut généralement des ingestions massives de vibrions pour forcer la barrière acide. L'incubation est en général rapide pour les sujets en état de sous-nutrition : l'absence d'acidité gastrique favorise l'infection. Selon la taille de l'inoculum, les débuts des symptômes surviennent en quelques heures à quelques jours après la contamination.
Le mucus intestinal est détruit par une mucinase et il est possible qu'une exotoxine modifie la perméabilité vasculaire. Le vibrion n'a qu'une agressivité relative et l'éclosion de la maladie est fortement favorisée par un état de malnutrition ou d'irritation intestinale ; la maladie prend de ce fait une allure plus grave et plus épidémique dans les régions sous-développées.
La diarrhée est sans fièvre (au stade terminal, la température peut descendre sous la normale), violente, aqueuse légèrement turbide : elle est dite en "eau de riz" et, à terme, provoque une sévère déshydratation et des troubles électrolytiques majeurs (fuite de chlore et une inhibition de l'absorption du sodium) qui vont être la cause de décès par collapsus cardio-vasculaire, celle-ci survenant selon l'état des patients, dans 25 à 50 % des cas ; si tous les soins nécessaires sont appliqués (ce qui est rarement le cas dans les pays les plus durement touchés), la létalité passe en dessous de 1 %.
La bactérie n'entre pas dans l'organisme et ne fait qu'y transiter, elle a un faible pouvoir invasif. Elle doit toute sa pathogénicité à son pouvoir toxique. Extrêmement mobile, comme la plupart des vibrions, elle se déplace très vite dans l'eau et s'y multiplie très vite. Elle est halotolérante et résiste bien aux variations de pH (en particulier alcalines).
Elle possède une affinité particulière avec le mucus qui recouvre la barrière entérocytaire, elle va le pénétrer et grâce à la présence de complexes pili-TCP (assimilable à de l'adhésine) à l'extrémité polaire du corps bactérien, près du flagelle, va s'accrocher aux cellules de l'intestin. Ces mêmes pili sont aussi les récepteurs de bactériophages CTX dont le génome encode une puissante toxine qu'est la toxine cholérique (voir paragraphe suivant).
La toxine est composée de deux groupes de structures, les cinq structures B qui vont servir à la fixation de la toxine sur les membranes des entérocytes en se fixant sur un ganglioside membranaire GM1, et de l'unique structure A (qui peut être subdivisée en deux sous-unités) qui active une enzyme : l'adénylate cyclase qui catalyse l'adénosine triphosphate en adénosine monophosphate cyclique[7], ce dernier étant responsable, chez les entérocytes, de la fuite d'eau et de chlore dans la lumière intestinale et du blocage du sodium.
Épidémiologie
[modifier | modifier le code]L'épidémiologie est dominée par la transmission hydrique, comme c'est le cas dans d'autres maladies entériques. Il est donc peu probable que des épidémies étendues puissent survenir dans les pays où le contrôle bactériologique des eaux est strictement appliqué, même si des foyers localisés éclataient. La surpopulation, le manque d'hygiène corporelle et alimentaire peuvent aussi contribuer à la propagation de la maladie.
Les mouches jouent également un rôle considérable dans la dissémination des vibrions[8].
Caractères bactériologiques
[modifier | modifier le code]Caractères génétiques :
- Génome réparti sur deux chromosomes :
- Chromosome principal (chromosome 1) : environ 3 Mpb
- Chromosome secondaire (chromosome 2 / chromide) : Environ 1Mpb
Caractères morphologiques :
- Vibrion peu incurvé, très mobile par ciliature monotriche : mobilité en bac de poisson.
Caractères culturaux :
- Culture sur milieux usuels mais le vibrion tolère des pH très élevés, d'où l'emploi d'une eau peptonée alcaline (pH 8,5) et hypersalée (halotolérance) (NaCl 3 %) qui permet l'enrichissement du germe à partir des selles et inhiber la plupart des autres bactéries non-halotolérantes.
- Milieu sélectif : milieu TCBS et milieux alcalins.
Caractères biochimiques :
- Glucose positif
- Nitrate réductase positive
- Oxydase positive
- Sensible au composé vibriostatique O129
Caractères antigéniques :
- Ag O : l'antigène de paroi permet de différencier environ 200 sérogroupes[9] mais les sérogroupes qui sont responsables des grandes épidémies de choléra sont O139 et O1. Le sérogroupe O renferme trois sérotypes : A, B et C.
- Ag H : l'antigène flagellaire n'a pas d'intérêt.
Substances élaborés :
- Enzymes : neuraminidases, protéases, mucinases.
- Entérotoxine cholérique : exotoxines protéique cholérique
- Entérotoxine A:2 sous unités :
- A2 : pénétration de A1 dans la cellule ;
- A1 : active l'adénylate cyclase.
- Entérotoxine B:5 sous unités : rôle de fixation.
- Entérotoxine A:2 sous unités :
Diagnostic
[modifier | modifier le code]La coproculture permet de mettre le germe en évidence après enrichissement sur eau peptonée alcaline. Il existe également des milieux sélectifs solides pour l'isolement.
Le choléra est une maladie infectieuse à déclaration obligatoire en France.
Prophylaxie
[modifier | modifier le code]- Contrôle bactériologique de l'eau potable et surveillance des porteurs de germes.
- Lutte contre la sous-nutrition.
- Immunisation au moyen d'un vaccin tué, contenant les différents types antigéniques. On pratique deux injections sous-cutanées à huit jours d'intervalle. La protection n'est pas parfaite mais non négligeable. Elle est de courte durée : un rappel est conseillé après 6 mois ou même plus tôt en période endémique.
Traitement
[modifier | modifier le code]L'essentiel est la réhydratation et le rétablissement de l'équilibre électrolytique par des perfusions de liquide contenant 5 g de NaCl, 4 g de NaHCO3 et 1 g de KCl par litre. Ce traitement est à lui seul suffisant pour réduire la mortalité de façon spectaculaire. Les antibiotiques ne constituent qu'un adjuvant.
Vibrio cholerae et le bactériophage CTX
[modifier | modifier le code]Vibrio cholerae n'est pas à l'origine pathogène, c'est le bactériophage CTXϕ qui le rend ainsi, lui transmettant le gène permettant la production des deux toxines[10].
La particularité de CTXϕ est qu'il arrive à introduire son matériel génétique dans l'ADN de Vibrio cholerae alors que leurs génomes n'ont pas la même structure. En effet, Vibrio cholerae a un ADN circulaire double brin alors que celui de CTX est à simple brin. Il s'intègre grâce aux recombinases XerCD.
Galerie
[modifier | modifier le code]-
Schéma de la bactérie V. cholerae
-
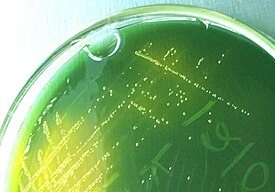
Colonies jaunes (fermentant du saccharose) de V. cholerae sur gélose TCBS.
-
Image au microscope électronique à transmission de V. cholerae qui a été colorée négativement.
Notes et références
[modifier | modifier le code]- B. Fantini (trad. de l'italien), La microbiologie médicale, Paris, Seuil, , 422 p. (ISBN 2-02-022141-1), p. 122-123 et 130-134dans Histoire de la pensée médicale en Occident, Du romantisme à la science moderne, vol. 3, M.D. Grmek (dir.).
- (en) R.S. Speck, Cholera, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 648.dans The Cambridge World History of Human Disease, K.F. Kiple (dir.).
- (it) F. Pacini, « Osservazioni microscopiche e deduzioni patalogiche sul cholera asiatico. », Gazzetta medica italiana federativa toscana, Florence, vol. 4, déc. 1854; réimprimé dans Lo Sperimentale, Florence, 1924, 78: 277-282.
- La pêche à la crevette joue un rôle non négligeable dans l'activité économique au Bangladesh (voir Organisation des Nations Unies pour l'alimentation et l'agriculture 9C0758 RÉPUBLIQUE POPULAIRE DU BANGLADESH), un des pays berceaux de la nouvelle souche O139 de Vibrio cholerae.
- Adhérence et colonisation de Vibrio cholerae O1 sur des carapaces de crevettes et de crabes
- Rapport d'activité de l'unité Choléra et des Vibrions pour l'année 2003 Institut Pasteur
- Cassel D, Pfeuffer T, Mechanism of cholera toxin action: covalent modification of the guanyl nucleotide-binding protein of the adenylate cyclase system, Proc Natl Acad Sci USA, 1978;75:2669-2673
- Liste-hygiene.org
- Harris JB, LaRocque RC, Qadri F, Ryan ET, Calderwood SB, Cholera, Lancet, 2012;379:2466-2476
- Waldor MK, Mekalanos JJ, Lysogenic conversion by a filamentous phage encoding cholera toxin, Science, 1996;272:1910-1914