Ciclooxixenase 2
- COX-2 redirixe aquí. Para a subunidade II da citocromo c oxidase (COX2 ou COXII) ver MT-CO2.
| PTGS2 | |||
|---|---|---|---|
 | |||
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Símbolos | PTGS2 (HGNC: 9605) COX-2, COX2, GRIPGHS, PGG/HS, PGHS-2, PHS-2, hCox-2, prostaglandina-endoperóxido sintase 2 | ||
| Identificadores externos |
Bases de datos de encimas
| ||
| Número EC | 1.14.99.1 | ||
| Locus | Cr. 1 q31.1 | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A ciclooxixenase 2 (COX-2), tamén chamada prostaglandina-endoperóxido sintase 2, prostaglandina G/H sintase e ciclooxixenase ou PGHS-2 (cuxo símbolo oficial de HUGO é PTGS2; HGNC:9605), é un encima que nos humanos está codificado no xene PTGS2 do cromosoma 1.[1] É unha das dúas ciclooxixenases que posúen os humanos; a outra é a ciclooxixenase 1. Intervén na conversión do ácido araquidónico en prostaglandina H2, un importante precursor da prostaciclina, entre outros compostos.
Función
[editar | editar a fonte]A COX-2 (PTGS2) converte o ácido araquidónico en prostaglandina endoperóxido H2. As ciclooxixenases son dianas para os AINE e para os inhibidores específicos deste encima chamados coxibs. A COX-2 é un homodímero de secuencia. Cada monómero do encima ten un sitio activo PTGS (COX) e de peroxidase. As ciclooxixenases catalizan a conversión do ácido araquidónico en prostaglandinas en dous pasos. Primeiro, quítase o hidróxeno do carbono 13 do ácido araquidónico, e despois a COX-2 (PTGS2) engade dúas moléculas de oxíxeno, orixinando a prostaglandina G2 (PGG2). En segundo lugar, a PGG2 é reducida a PGH2 no sitio activo da actividade de peroxidase. A PGH2 é convertida noutras prostaglandinas (PGD2, PGE2, PGF2α), prostaciclina (PGI2), ou tromboxano A2 por isomerases específicas de tecido.[2]
Aínda que a COX-2 metaboliza principalmente a conversión de ácido araquidónico en PGG2, este encima tamén converte este ácido graxo en pequenas cantidades dunha mestura racémica de ácidos 15-hidroxiicosatetraenoicos (15-HETE) composta de ~22% do estereoisómero 15(R)-HETE e un ~78% do 15(S)-HETE e de pequenas cantidades de 11(R)-HETE.[3] Os dous estereoisómeros 15-HETE teñen actividades biolóxicas intrínsecas, e, o que é máis importante, poden ser posteriormente metabolizados a lipoxinas. Ademais, a COX-2 tratada con aspirina metaboliza o ácido araquidónico case exclusivamente a 15(R)-HETE, que á súa vez pode ser metabolizado a epi-lipoxinas.[4] As lipoxinas e epi-lipoxinas son importantes axentes antiinflamatorios e poden contribuír ás actividades globais de ambos os encimas COX e da aspirina.
A COX-2 é inhibida de forma natural polo calcitriol (a forma activa da vitamina D).[5][6]
Mecanismo
[editar | editar a fonte]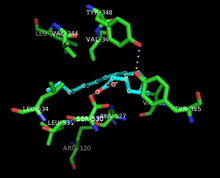

Tanto as actividades peroxidase coma PTGS son inactivadas durante a catálise por procesos de primeira orde baseados no mecanismo, o cal significa que a as actividades de peroxidase PGHS-2 ou de PTGS descenden a cero en 1 ou 2 minutos, mesmo en presenza de suficiente substrato.[8][9][10]
A conversión do ácido araquidónico en PGG2 pode describirse como unha serie de reaccións de radical análogas ás da autooxidación dos ácidos graxos poliinsaturados.[11] O hidróxeno 13-pro(S) é eliminado e o dioxíxeno atrapa o radical pentadienilo no carbono 11. O radical 11-peroxil cíclase no carbono 9 e o radical centrado no carbono xerado no C-8 cíclase no carbono 12, xerando un endoperóxido. O radical alilo xerado é atrapado polo dioxíxeno no carbono 15 para formar o radical 15-(S)-peroxilo; este radical é despois reducido a PGG2. Este esquema está apoiado polas seguintes evidencias: 1) obsérvase un significativo efecto isotópico cinético para a extracción do hidróxeno 13-pro (S ); 2) os radicais centrados no carbono son atrapados durante a catálise;[12] 3) fórmanse pequenas cantidades de produtos de oxidación debido ao atrapamento polo oxíxeno dun radical alilo intermediario nas posicións 13 e 15.[13][14]
Teoricamente é posible outro mecanismo polo cal se desprotona o hidróxeno 13-pro (S ) e o carbanión é oxidado a un radical. Porén, a oxixenación do ácido 10,10-difluoroaraquidónico a ácido 11-(S )-hidroxieicosa-5,8,12,14-tetraenoico non é consistente coa xeración dun intermediario carbanión porque eliminaría fluoruro para formar un dieno conxugado.[15] A ausencia de produtos que conteñan endoperóxido derivados do ácido 10,10-difluoroaraquidónico pensouse que indicaba a importancia dun carbocatión C-10 na síntese de PGG2.[16] Porén, o mecanismo catiónico require que a formación de endoperóxido teña lugar antes da extracción do hidróxeno 13-pro (S ). Isto non está en concordancia cos resultados dos experimentos isotópicos da oxixenación do ácido araquidónico.[17]
Estrutura
[editar | editar a fonte]
A COX-2 (PTGS2) está en forma de homodímero e cada monómero ten un peso molecular duns 70 kDa. As estruturas terciarias e cuaternarias dos encimas COX-1 (PTGS1) e COX-2 (PTGS2) son case idénticas. Cada subunidade ten tres dominios estruiturais: un curto dominio de tipo EGF N-terminal; un resto para a unión á membrana α-helicoidal; e o dominio catalítico C-terminal. Os encimas cilooxixenases son proteínas monotópicas de membrana; o dominio de unión á membrana consiste nunha serie de hélices α anfipáticas con varios aminoácidos hidrófobos expostos a unha monocapa da membrana. A COX-1 (PTGS1) e a COX-2 (PTGS2) son encimas bifuncionais que levan a cabo dúas reaccións químicas consecutivas en sitios activos espacilmente distintos pero mecanisticamente acoplados. Tanto o sitio activo de ciclooxixenase coma o de peroxidase están localizados no dominio catalítico, que comprende aproximadamente o 80% da proteína. O dominio catlítico é homólogo das peroxidases de mamíferos, como a mieloperoxidase.[19][20]
A COX-2 (PTGS2) humana funciona como un heterodímero conformacional e ten un monómero catalítico (E-cat) e un monómero alostérico (E-alo). O hemo únese só ao sitio de peroxidase de E-cat, mentres que os substratos, así como certos inhibidores (por exemplo, celecoxib), únense ao sitio COX de E-cat. E-cat está regulado por E-alo de maneira dependente do ligando que se una a E-alo. Ácidos graxos substrato e non substrato e algúns inhibidores de ciclooxixenases (por exemplo, naproxén) únense preferentemente ao sitio E-alo do encima. O ácido araquidónico pode unirse a E-cat ou a E-alo, pero a afinidade deste ácido por E-allo é 25 veces maior que por Ecat. O ácido palmítico, un estimulador da eficacia de huPGHS-2, únese só a E-alo en cocristais de ácidopalmítico/PGHS-2 murina. Os ácidos graxos non substratos poden potenciar ou atenuar os inhibidores das ciclooxixenases dependendo do ácido graxo de que se trate e de se o inhibidor se une a E-cat ou a E-alo. Os estudos suxiren que a concentración e composición do conxunto de ácidos graxos libres no ambiente no cal funciona a PGHS-2 nas células, tamén denominado ton de ácidos graxos, é un factor clave para regular a actividade da PGHS-2 e a súa resposta aos inhibidores de COX (PTGS).[18]
Importancia clínica
[editar | editar a fonte]
A COX-2 (PTGS1) non se expresa en condicións normais na maioría das células, pero os seus niveis son elevados durante as inflamacións. Ao contrario, a COX-1 (PTGS1) exprésase constitutivamente en moitos tecidos e é a forma predominante na mucosa gástrica e nos riles. A inhibición de COX-1 (PTGS1) reduce a produción basal dos citoprotectores PGE2 e PGI2 no estómago, que poden contribuír o desenvolvemento dunha úlcera gástrica. Como xeralmente a COX-2 (PTGS2) se expresa só en células nas que as prostaglandinas están reguladas á alza (por exemplo, durante a inflamación), os fármacos candidatos que inhiben selectivamente COX-2 (PTGS2) esperábase que producisen poucos efectos secundarios,[20] pero demostraron aumentar substancialmente o risco de sufrir episodios cardiovasculares como ataques ao corazón e ictus. Estes efectos contraditorios poden explicarse por medio de dous mecanismos. A aspirina a baixas doses protexe contra os ataques cardíacos e accidentes cerebrovasculares ao bloquear COX-1 (PTGS1) e impedirlle que forme unha prostaglandina chamada tromboxano A2. Este favorece a agregación plaquetaria e promove a coagulación; a inhibición da súa formación axuda a impedir os ataques cardíacos. Por outra parte, a COX-2 (PTGS2) é unha fonte moi importante de prostaglandinas, especialmente de prostaciclina, que se encontra no recubrimento interno dos vasos sanguíneos. A prostaciclina relaxa ou despega as plaquetas nos agregados, de modo que os inhibidores selectivos de COX-2 (como coxibs) incrementan o risco de episodios cardiovasculares debido á formación de coágulos.[22]
Os antiinflamatorios non esteroides (AINE) inhiben a produción de prostaglandinas que realizan as dúas ciclooxixenases, COX-1 e COX-2. Os AINE selectivos parra inhibición de COX-2 (PTGS2) é menos probable que causen efectos adversos gastrointestinais que os fármacos tradicionais, pero poden causar efectos cardiovasculares, como insuficiencia cardíaca, infarto de miocardio e ictus. Os estudos de farmacoloxía e xenética humana, e os realizados en roedores manipulados xeneticamente e noutros modelos animais e os ensaios aleatorios indican que isto se debe á supresión das prostaglandinas cardioprotectoras dependentes de COX-2 (PTGS2), especialmente a prostaciclina.[23]
A expresión de COX-2 (PTGS2) está regulada á alza en moitos cancros. A sobreexpresión de COX-2 (PTGS2) xunto cun incremento da anxioxénese e a expresión de SLC2A1 (GLUT-1) está significativamente asociada con carcinomas de vexiga.[24] Ademais, o produto de COX-2 (PTGS2), a PGH2, é convertido pola prostaglandina E2 sintase en PGE2, a cal á súa vez pode estimular a progresión do cancro. En consecuencia, a inhibición de COX-2 (PTGS2) pode ser beneficiosa na prevención e tratamento deste tipo de cancros.[25][26]
A expresión de COX-2 detectouse en membranas epirretinais humanas.[27] O bloqueo das ciclooxixenases polo lornoxicam en estdos agudos de inflamación reduciu a frecuencia de formación destas membranas nun 43% no modelo da protease dispase de vitrorretinopatía proliferativa e nun 31% no modelo de concanavalina. O lornoxicam non só normalizaba a expresión das ciclooxixenases en ambos os modelos de vitrorretinopatía proliferativa, senón tamén neutralizaba os cambios de grosor da coroide e da retina causados pola inxección de axentes proinflamatorios. Estes feitos subliñan a importancia das ciclooxixenases e as prostaglandinas no desenvolvemento da vitrorretinopatía proliferativa.[28]
Na China fixéronse estudos sobre mutacions no xene PTGS2. Os portadores do alelo mutante PTGS2 5939C na poboación han chinesa teñen un maior risco de sufrir cancro gástrico. Ademais, atopuse unha conexión entre a infección pola bacteria Helicobacter pylori e a presenza do alelo 5939C.[29]
Interaccións
[editar | editar a fonte]A COX-2 ou PTGS2 interacciona coa caveolina 1.[30]
Notas
[editar | editar a fonte]- ↑ Hla T, Neilson K (August 1992). "Human cyclooxygenase-2 cDNA". Proc. Natl. Acad. Sci. U.S.A. 89 (16): 7384–8. Bibcode:1992PNAS...89.7384H. PMC 49714. PMID 1380156. doi:10.1073/pnas.89.16.7384.
- ↑ O'Banion MK (1999). "Cyclooxygenase-2: molecular biology, pharmacology, and neurobiology". Crit Rev Neurobiol 13 (1): 45–82. PMID 10223523.
- ↑ Mulugeta S, Suzuki T, Hernandez NT, Griesser M, Boeglin WE, Schneider C (2010). "Identification and absolute configuration of dihydroxy-arachidonic acids formed by oxygenation of 5S-HETE by native and aspirin-acetylated COX-2". J. Lipid Res. 51 (3): 575–85. PMC 2817587. PMID 19752399. doi:10.1194/jlr.M001719.
- ↑ Serhan CN (2005). "Lipoxins and aspirin-triggered 15-epi-lipoxins are the first lipid mediators of endogenous anti-inflammation and resolution". Prostaglandins Leukot. Essent. Fatty Acids 73 (3–4): 141–62. PMID 16005201. doi:10.1016/j.plefa.2005.05.002.
- ↑ Wang Q1, He Y, Shen Y, Zhang Q, Chen D, Zuo C, Qin J, Wang H, Wang J, Yu Y. (2014). "Vitamin D inhibits COX-2 expression and inflammatory response by targeting thioesterase superfamily member 4". J Biol Chem 289 (17): 11681–11694. PMC 4002078. PMID 24619416. doi:10.1074/jbc.M113.517581.
- ↑ Kassi E1, Adamopoulos C, Basdra EK, Papavassiliou AG. (2013). "Role of Vitamin D in Atherosclerosis". AHA 128 (23): 2517–2531. PMID 24297817. doi:10.1161/CIRCULATIONAHA.113.002654.
- ↑ PDB 3OLT
- ↑ Smith WL, Garavito RM, DeWitt DL (December 1996). "Prostaglandin endoperoxide H synthases (cyclooxygenases)-1 and -2". J. Biol. Chem. 271 (52): 33157–60. PMID 8969167. doi:10.1074/jbc.271.52.33157.
- ↑ Wu G, Wei C, Kulmacz RJ, Osawa Y, Tsai AL (April 1999). "A mechanistic study of self-inactivation of the peroxidase activity in prostaglandin H synthase-1". J. Biol. Chem. 274 (14): 9231–7. PMID 10092596. doi:10.1074/jbc.274.14.9231.
- ↑ Callan OH, So OY, Swinney DC (February 1996). "The kinetic factors that determine the affinity and selectivity for slow binding inhibition of human prostaglandin H synthase 1 and 2 by indomethacin and flurbiprofen". J. Biol. Chem. 271 (7): 3548–54. PMID 8631960. doi:10.1074/jbc.271.7.3548.
- ↑ Porter NA (1986). "Mechanisms for the autoxidation of polyunsaturated lipids". Accounts of Chemical Research 19 (9): 262–8. doi:10.1021/ar00129a001.
- ↑ Mason RP, Kalyanaraman B, Tainer BE, Eling TE (June 1980). "A carbon-centered free radical intermediate in the prostaglandin synthetase oxidation of arachidonic acid. Spin trapping and oxygen uptake studies". J. Biol. Chem. 255 (11): 5019–22. PMID 6246094.
- ↑ Hecker M, Ullrich V, Fischer C, Meese CO (November 1987). "Identification of novel arachidonic acid metabolites formed by prostaglandin H synthase". Eur. J. Biochem. 169 (1): 113–23. PMID 3119336. doi:10.1111/j.1432-1033.1987.tb13587.x.
- ↑ Xiao G, Tsai AL, Palmer G, Boyar WC, Marshall PJ, Kulmacz RJ (February 1997). "Analysis of hydroperoxide-induced tyrosyl radicals and lipoxygenase activity in aspirin-treated human prostaglandin H synthase-2". Biochemistry 36 (7): 1836–45. PMID 9048568. doi:10.1021/bi962476u.
- ↑ Kwok PY, Muellner FW, Fried J (June 1987). "Enzymatic conversions of 10,10-difluoroarachidonic acid with PGH synthase and soybean lipoxygenase". Journal of the American Chemical Society 109 (12): 3692–3698. doi:10.1021/ja00246a028.
- ↑ Dean AM, Dean FM (May 1999). "Carbocations in the synthesis of prostaglandins by the cyclooxygenase of PGH synthase? A radical departure!". Protein Sci. 8 (5): 1087–98. PMC 2144324. PMID 10338019. doi:10.1110/ps.8.5.1087.
- ↑ Hamberg M, Samuelsson B (November 1967). "On the mechanism of the biosynthesis of prostaglandins E-1 and F-1-alpha". J. Biol. Chem. 242 (22): 5336–43. PMID 6070851.
- ↑ 18,0 18,1 Dong L, Vecchio AJ, Sharma NP, Jurban BJ, Malkowski MG, Smith WL (May 2011). "Human cyclooxygenase-2 is a sequence homodimer that functions as a conformational heterodimer". J. Biol. Chem. 286 (21): 19035–46. PMC 3099718. PMID 21467029. doi:10.1074/jbc.M111.231969.
- ↑ Picot D, Loll PJ, Garavito RM (January 1994). "The X-ray crystal structure of the membrane protein prostaglandin H2 synthase-1". Nature 367 (6460): 243–9. Bibcode:1994Natur.367..243P. PMID 8121489. doi:10.1038/367243a0.
- ↑ 20,0 20,1 Kurumbail RG, Kiefer JR, Marnett LJ (December 2001). "Cyclooxygenase enzymes: catalysis and inhibition". Curr. Opin. Struct. Biol. 11 (6): 752–60. PMID 11751058. doi:10.1016/S0959-440X(01)00277-9.
- ↑ PDB 3PGH
- ↑ Ruan, C. H.; So, S. P.; Ruan, K. H. (2011). "Inducible COX-2 dominates over COX-1 in prostacyclin biosynthesis: Mechanisms of COX-2 inhibitor risk to heart disease". Life Sciences 88 (1–2): 24–30. PMC 3046773. PMID 21035466. doi:10.1016/j.lfs.2010.10.017.
- ↑ Wang D, Patel VV, Ricciotti E, Zhou R, Levin MD, Gao E, Yu Z, Ferrari VA, Lu MM, Xu J, Zhang H, Hui Y, Cheng Y, Petrenko N, Yu Y, FitzGerald GA (May 2009). "Cardiomyocyte cyclooxygenase-2 influences cardiac rhythm and function". Proc. Natl. Acad. Sci. U.S.A. 106 (18): 7548–52. Bibcode:2009PNAS..106.7548W. PMC 2670242. PMID 19376970. doi:10.1073/pnas.0805806106.
- ↑ Legan M (August 2010). "Cyclooxygenase-2, p53 and glucose transporter-1 as predictors of malignancy in the development of gallbladder carcinomas". Bosn J Basic Med Sci 10 (3): 192–6. PMID 20846124.
- ↑ Modelo:EntrezGene
- ↑ Menter DG, Schilsky RL, DuBois RN (March 2010). "Cyclooxygenase-2 and cancer treatment: understanding the risk should be worth the reward". Clin. Cancer Res. 16 (5): 1384–90. PMC 4307592. PMID 20179228. doi:10.1158/1078-0432.CCR-09-0788.
- ↑ KASE, SATORU; SAITO, WATARU; OHNO, SHIGEAKI; ISHIDA, SUSUMU. "CYCLO-OXYGENASE-2 EXPRESSION IN HUMAN IDIOPATHIC EPIRETINAL MEMBRANE". Retina 30 (5): 719–723. doi:10.1097/iae.0b013e3181c59698. Arquivado dende o orixinal o 18 de outubro de 2019. Consultado o 22 de setembro de 2018.
- ↑ Tikhonovich, Marina V.; Erdiakov, Aleksei K.; Gavrilova, Svetlana A. (2017-06-21). "Nonsteroid anti-inflammatory therapy suppresses the development of proliferative vitreoretinopathy more effectively than a steroid one". International Ophthalmology (en inglés): 1–14. ISSN 0165-5701. doi:10.1007/s10792-017-0594-3.
- ↑ Li Y, He W, Liu T, Zhang Q (December 2010). "A new cyclo-oxygenase-2 gene variant in the Han Chinese population is associated with an increased risk of gastric carcinoma". Mol Diagn Ther 14 (6): 351–5. PMID 21275453. doi:10.1007/bf03256392.
- ↑ Liou JY, Deng WG, Gilroy DW, Shyue SK, Wu KK (September 2001). "Colocalization and interaction of cyclooxygenase-2 with caveolin-1 in human fibroblasts". J. Biol. Chem. 276 (37): 34975–82. PMID 11432874. doi:10.1074/jbc.M105946200.
Véxase tamén
[editar | editar a fonte]Bibliografía
[editar | editar a fonte]- Richards JA, Petrel TA, Brueggemeier RW (February 2002). "Signaling pathways regulating aromatase and cyclooxygenases in normal and malignant breast cells". J. Steroid Biochem. Mol. Biol. 80 (2): 203–12. PMID 11897504. doi:10.1016/S0960-0760(01)00187-X.
- Wu T, Wu H, Wang J, Wang J (2011). "Expression and cellular localization of cyclooxygenases and prostaglandin E synthases in the hemorrhagic brain.". J Neuroinflammation. 8: 22. PMC 3062590. PMID 21385433. doi:10.1186/1742-2094-8-22.
- Koki AT, Khan NK, Woerner BM, Seibert K, Harmon JL, Dannenberg AJ, Soslow RA, Masferrer JL (January 2002). "Characterization of cyclooxygenase-2 (COX-2) during tumorigenesis in human epithelial cancers: evidence for potential clinical utility of COX-2 inhibitors in epithelial cancers". Prostaglandins Leukot. Essent. Fatty Acids 66 (1): 13–8. PMID 12051953. doi:10.1054/plef.2001.0335.
- Saukkonen K, Rintahaka J, Sivula A, Buskens CJ, Van Rees BP, Rio MC, Haglund C, Van Lanschot JJ, Offerhaus GJ, Ristimaki A (October 2003). "Cyclooxygenase-2 and gastric carcinogenesis". APMIS 111 (10): 915–25. PMID 14616542. doi:10.1034/j.1600-0463.2003.1111001.x.
- Sinicrope FA, Gill S (2004). "Role of cyclooxygenase-2 in colorectal cancer". Cancer Metastasis Rev. 23 (1–2): 63–75. PMID 15000150. doi:10.1023/A:1025863029529.
- Jain S, Khuri FR, Shin DM (2004). "Prevention of head and neck cancer: current status and future prospects". Curr Probl Cancer 28 (5): 265–86. PMID 15375804. doi:10.1016/j.currproblcancer.2004.05.003.
- Saba N, Jain S, Khuri F (2004). "Chemoprevention in lung cancer". Curr Probl Cancer 28 (5): 287–306. PMID 15375805. doi:10.1016/j.currproblcancer.2004.05.005.
- Cardillo I, Spugnini EP, Verdina A, Galati R, Citro G, Baldi A (October 2005). "Cox and mesothelioma: an overview". Histol. Histopathol. 20 (4): 1267–74. PMID 16136507.
- Brueggemeier RW, Díaz-Cruz ES (March 2006). "Relationship between aromatase and cyclooxygenases in breast cancer: potential for new therapeutic approaches". Minerva Endocrinol. 31 (1): 13–26. PMID 16498361.
- Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa K (March 2006). "Role of cyclooxygenase-2 in the carcinogenesis of gastrointestinal tract cancers: a review and report of personal experience". World J. Gastroenterol. 12 (9): 1336–45. PMC 4124307. PMID 16552798.
- Bingham S, Beswick PJ, Blum DE, Gray NM, Chessell IP (October 2006). "The role of the cylooxygenase pathway in nociception and pain". Semin. Cell Dev. Biol. 17 (5): 544–54. PMID 17071117. doi:10.1016/j.semcdb.2006.09.001.
- Minghetti L, Pocchiari M (2007). "Cyclooxygenase-2, prostaglandin E2, and microglial activation in prion diseases". Int. Rev. Neurobiol. International Review of Neurobiology 82: 265–75. ISBN 9780123739896. PMID 17678966. doi:10.1016/S0074-7742(07)82014-9.
Outros artigos
[editar | editar a fonte]Ligazóns externas
[editar | editar a fonte]- Nextbio Arquivado 18 de outubro de 2019 en Wayback Machine.
- Explicación do risco cardiovascular e os AINE
- Wolfe MM (decembro de 2004). "Rofecoxib, Merck, and the FDA". N. Engl. J. Med. 351 (27): 2875–8; author reply 2875–8. PMID 15625749. doi:10.1056/NEJM200412303512719.
