Asam sitrat
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asam sitrat[1]
| |||
| Nama IUPAC (preferensi)
Asam 2-hidroksipropana-1,2,3-trikarboksilat[1] | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C6H8O7 | |||
| Massa molar | 192.123 g/mol (anhidrat), 210.14 g/mol (monohidrat)[2] | ||
| Penampilan | Padatan putih | ||
| Bau | Tak berbau | ||
| Densitas | 1.665 g/cm3 (anhidrat) 1.542 g/cm3 (18 °C, monohidrat) | ||
| Titik lebur | 156 °C (313 °F; 429 K) | ||
| Titik didih | 310 °C (590 °F; 583 K) terurai pada 175 °C[3] | ||
| 54% w/w (10 °C) 59.2% w/w (20 °C) 64.3% w/w (30 °C) 68.6% w/w (40 °C) 70.9% w/w (50 °C) 73.5% w/w (60 °C) 76.2% w/w (70 °C) 78.8% w/w (80 °C) 81.4% w/w (90 °C) 84% w/w (100 °C)[4] | |||
| Kelarutan | Larut dalam aseton, alkohol, eter, etil asetat, DMSO Tidak larut dalam C6H6, CHCl3, CS2, toluena[3] | ||
| Kelarutan dalam etanol | 62 g/100 g (25 °C)[3] | ||
| Kelarutan dalam amil asetat | 4.41 g/100 g (25 °C)[3] | ||
| Kelarutan dalam dietil eter | 1.05 g/100 g (25 °C)[3] | ||
| Kelarutan dalam 1,4-Dioksana | 35.9 g/100 g (25 °C)[3] | ||
| log P | −1.64 | ||
| Keasaman (pKa) | pKa1 = 3.13[5] pKa2 = 4.76[5] pKa3 = 6.39,[6] 6.40[7] | ||
| Indeks bias (nD) | 1.493–1.509 (20 °C)[4] 1.46 (150 °C)[3] | ||
| Viskositas | 6.5 cP (50% aq. sol.)[4] | ||
| Struktur | |||
| Monoklinik | |||
| Termokimia | |||
| Kapasitas kalor (C) | 226.51 J/(mol·K) (26.85 °C)[8] | ||
| Entropi molar standar (S |
252.1 J/(mol·K)[8] | ||
| Entalpi pembentukan standar (ΔfH |
−1543.8 kJ/mol[4] | ||
| Farmakologi | |||
| Kode ATC | A09 | ||
| Bahaya | |||
| Bahaya utama | Korosi mata dan kulit | ||
| Lembar data keselamatan | HMDB | ||
| Piktogram GHS |  [5] [5]
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H319[5] | |||
| P305+351+338[5] | |||
| Titik nyala | 155 °C (311 °F; 428 K) | ||
| 345 °C (653 °F; 618 K) | |||
| Ambang ledakan | 8%[5] | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
3000 mg/kg (rats, oral) | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Asam sitrat (bahasa Belanda: citroenzuur, secara harfiah "asam sitrun"; bahasa Inggris: citric acid) merupakan asam organik lemah dengan rumus kimia HOC(CO2H)(CH2CO2H)2 yang ditemukan pada daun dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan bahan pengawet yang baik dan alami, selain digunakan sebagai penambah rasa masam pada makanan dan minuman ringan. Dalam biokimia, asam sitrat dikenal sebagai senyawa antara dalam siklus asam sitrat yang terjadi di dalam mitokondria, yang penting dalam metabolisme makhluk hidup. Zat ini juga dapat digunakan sebagai zat pembersih yang ramah lingkungan dan sebagai antioksidan.[9]
Asam sitrat terdapat pada berbagai jenis buah dan sayuran, namun ditemukan pada konsentrasi tinggi, yang dapat mencapai 8% bobot kering, pada jeruk lemon dan limau (misalnya jeruk nipis dan jeruk purut).
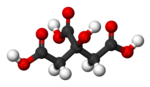
Rumus kimia asam sitrat adalah C6H8O7 (strukturnya ditunjukkan pada tabel informasi di sebelah kanan). Struktur asam ini tercermin pada nama IUPAC-nya, asam 2-hidroksi-1,2,3-propanatrikarboksilat.
Sifat fisika dan kimia
[sunting | sunting sumber]Sifat-sifat fisis asam sitrat dirangkum pada tabel di sebelah kanan. Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang dapat melepas proton dalam larutan. Jika hal ini terjadi, ion yang dihasilkan adalah ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk mengendalikan pH larutan.[10] Ion sitrat dapat bereaksi dengan banyak ion logam membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang kesadahan air (lihat keterangan tentang kegunaan di bawah).[11]
Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna putih. Serbuk kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul asam sitrat. Bentuk anhydrous asam sitrat mengkristal dalam air panas, sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam air dingin. Bentuk monohidrat tersebut dapat diubah menjadi bentuk anhydrous dengan pemanasan di atas 74 °C.[12]
Secara kimia, asam sitrat bersifat seperti asam karboksilat lainnya. Jika dipanaskan di atas 175 °C, asam sitrat terurai dengan melepaskan karbon dioksida dan air.[12]
Sejarah
[sunting | sunting sumber]Asam sitrat diyakini ditemukan oleh alkimiawan Arab-Yemen (kelahiran Iran) yang hidup pada abad ke-8, Jabir Ibn Hayyan. Pada zaman pertengahan, para ilmuwan Eropa membahas sifat asam sari buah lemon dan limau; hal tersebut tercatat dalam ensiklopedia Speculum Majus (Cermin Agung) dari abad ke-13 yang dikumpulkan oleh Vincent dari Beauvais. Asam sitrat pertama kali diisolasi pada tahun 1784 oleh kimiawan Swedia, Carl Wilhelm Scheele, yang mengkristalkannya dari sari buah lemon. Pembuatan asam sitrat skala industri dimulai pada tahun 1860, terutama mengandalkan produksi jeruk dari Italia.[13][14]
Pada tahun 1893, C. Wehmer menemukan bahwa kapang Penicillium dapat membentuk asam sitrat dari gula. Namun, pembuatan asam sitrat dengan mikrob secara industri tidaklah nyata sampai Perang Dunia I mengacaukan ekspor jeruk dari Italia. Pada tahun 1917, kimiawan pangan Amerika, James Currie menemukan bahwa galur tertentu kapang Aspergillus niger dapat menghasilkan asam sitrat secara efisien, dan perusahaan kimia Pfizer memulai produksi asam sitrat skala industri dengan cara tersebut dua tahun kemudian.[15]
Pembuatan
[sunting | sunting sumber]Dalam proses produksi asam sitrat yang sampai saat ini lazim digunakan, biakan kapang Aspergillus niger diberi sukrosa agar membentuk asam sitrat. Setelah kapang disaring dari larutan yang dihasilkan, asam sitrat diisolasi dengan cara mengendapkannya dengan kalsium hidroksida membentuk garam kalsium sitrat. Asam sitrat di-regenerasi-kan dari kalsium sitrat dengan penambahan asam sulfat.[12]
Cara lain pengisolasian asam sitrat dari hasil fermentasi adalah dengan ekstraksi menggunakan larutan hidrokarbon senyawa basa organik trilaurilamina yang diikuti dengan re-ekstraksi dari larutan organik tersebut dengan air.[12]
Kegunaan
[sunting | sunting sumber]
Penggunaan utama asam sitrat saat ini adalah sebagai zat pemberi cita rasa dan pengawet makanan dan minuman, terutama minuman ringan. Kode asam sitrat sebagai zat aditif makanan (E number ) adalah E330.[16] Garam sitrat dengan berbagai jenis logam digunakan untuk menyediakan logam tersebut (sebagai bentuk biologis) dalam banyak suplemen makanan. Sifat sitrat sebagai larutan penyangga digunakan sebagai pengendali pH dalam larutan pembersih dalam rumah tangga dan obat-obatan.[17]
Kemampuan asam sitrat untuk meng-kelat logam menjadikannya berguna sebagai bahan sabun dan deterjen. Dengan meng-kelat logam pada air sadah, asam sitrat memungkinkan sabun dan deterjen membentuk busa dan berfungsi dengan baik tanpa penambahan zat penghilang kesadahan. Demikian pula, asam sitrat digunakan untuk memulihkan bahan penukar ion yang digunakan pada alat penghilang kesadahan dengan menghilangkan ion-ion logam yang terakumulasi pada bahan penukar ion tersebut sebagai kompleks sitrat.[18]
Asam sitrat digunakan di dalam industri bioteknologi dan obat-obatan untuk melapisi (passivate) pipa mesin dalam proses kemurnian tinggi sebagai ganti asam nitrat, karena asam nitrat dapat menjadi zat berbahaya setelah digunakan untuk keperluan tersebut, sementara asam sitrat tidak.[19]
Asam sitrat dapat pula ditambahkan pada es krim untuk menjaga terpisahnya gelembung-gelembung lemak.
Dalam resep makanan, asam sitrat dapat digunakan sebagai pengganti sari jeruk.
Keamanan
[sunting | sunting sumber]Asam sitrat dikategorikan aman digunakan pada makanan oleh semua badan pengawasan makanan nasional dan internasional utama, tetapi asam sitrat dapat menyebabkan korosi pada gigi jika dikonsumsi secara belebihan. Asam sitrat secara alami terdapat pada semua jenis makhluk hidup, dan kelebihan asam sitrat dengan mudah dimetabolisme dan dihilangkan dari tubuh.[20]
Paparan terhadap asam sitrat kering ataupun larutan asam sitrat pekat dapat menyebabkan iritasi kulit dan mata. Pengenaan alat protektif (seperti sarung tangan atau kacamata pelindung) perlu dilakukan saat menangani bahan-bahan tersebut.[20][21][22]
Status pelengkap
[sunting | sunting sumber]Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ a b International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. hlm. 747. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ CID 22230 dari PubChem
- ^ a b c d e f g "citric acid". chemister.ru. Diarsipkan dari versi asli tanggal 29 November 2014. Diakses tanggal 1 Juni 2014.
- ^ a b c d e f CID 311 dari PubChem
- ^ a b c d e f Fisher Scientific, Citric acid. Retrieved on 2014-06-02.
- ^ "Data for Biochemical Research". ZirChrom Separations, Inc. Diakses tanggal 11 Januari 2012.
- ^ "Ionization Constants of Organic Acids". Michigan State University. Diakses tanggal 11 Januari 2012.
- ^ a b c Citric acid dalam Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (diakses tanggal 2 Juni 2014)
- ^ Apleblat, Alexander (2014). Citric acid. Springer. ISBN 978-3-319-11232-9.
- ^ Maniatis, T.; Fritsch, E. F.; Sambrook, J. 1982. Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, NY.
- ^ Matzapetakis, M.; Raptopoulou, C. P.; Tsohos, A.; Papaefthymiou, V.; Moon, S. N.; Salifoglou, A. (1998). "Synthesis, Spectroscopic and Structural Characterization of the First Mononuclear, Water Soluble Iron−Citrate Complex, (NH4)5Fe(C6H4O7)2·2H2O". J. Am. Chem. Soc. 120 (50): 13266–13267. doi:10.1021/ja9807035.
- ^ a b c d Verhoff, Frank H.; Bauweleers, Hugo (2005), "Citric Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_103.pub3
- ^ Scheele, Carl Wilhelm (1784). "Anmärkning om Citron-saft, samt sätt at crystallisera densamma" [Note about lemon juice, as well as ways to crystallize it]. Kungliga Vetenskaps Academiens Nya Handlingar [New Proceedings of the Royal Academy of Science]. 2nd series (dalam bahasa Swedia). 5: 105–109.
- ^ Graham, Thomas (1842). Elements of chemistry, including the applications of the science in the arts. Hippolyte Baillière, foreign bookseller to the Royal College of Surgeons, and to the Royal Society, 219, Regent Street. hlm. 944. Diakses tanggal June 4, 2010.
- ^ Lotfy, Walid A.; Ghanem, Khaled M.; El-Helow, Ehab R. (2007). "Citric acid production by a novel Aspergillus niger isolate: II. Optimization of process parameters through statistical experimental designs". Bioresource Technology. 98 (18): 3470–3477. doi:10.1016/j.biortech.2006.11.032. PMID 17317159.
- ^ Greenfield, Heather; Southgate, D.A.T. (2003). Food Composition Data: Production, Management and Use. Rome: FAO. hlm. 146. ISBN 9789251049495.
- ^ JOHNSON, WARREN C.; QUILL, LAURENCE L.; DANIELS, FARRINGTON (1947-09-01). "Rare Earths Separation Developed on Manhattan Project". Chemical & Engineering News Archive. 25 (35): 2494. doi:10.1021/cen-v025n035.p2494. ISSN 0009-2347.
- ^ Saleem, Muhammad Hamzah; Ali, Shafaqat; Rehman, Muzammal; Rizwan, Muhammad; Kamran, Muhammad; Mohamed, Ibrahim A.A.; Khan, Zaid; Bamagoos, Atif A.; Alharby, Hesham F.; Hakeem, Khalid Rehman; Liu, Lijun (2020-08-01). "Individual and combined application of EDTA and citric acid assisted phytoextraction of copper using jute (Corchorus capsularis L.) seedlings". Environmental Technology & Innovation (dalam bahasa Inggris). 19: 100895. doi:10.1016/j.eti.2020.100895. ISSN 2352-1864.
- ^ "Pickling and Passivating Stainless Steel" (PDF). Euro-inox.org. Diarsipkan dari versi asli (PDF) tanggal 12 September 2012. Diakses tanggal 1 Januari 2013.
- ^ a b "Citric acid". International Chemical Safety Cards. NIOSH. 18 September 2018. Diarsipkan dari versi asli tanggal July 12, 2018. Diakses tanggal 9 September 2017.
- ^ J. Zheng; F. Xiao; L. M. Qian; Z. R. Zhou (Desember 2009). "Erosion behavior of human tooth enamel in citric acid solution". Tribology International. 42 (11–12): 1558–1564. doi:10.1016/j.triboint.2008.12.008.
- ^ "Effect of Citric Acid on Tooth Enamel".
- ^ British Pharmacopoeia Commission Secretariat (2009). "Index, BP 2009" (PDF). Diarsipkan dari versi asli (PDF) tanggal 11 April 2009. Diakses tanggal 4 Februari 2010.
- ^ "Japanese Pharmacopoeia, Fifteenth Edition" (PDF). 2006. Diarsipkan dari versi asli (PDF) tanggal 22 Juli 2011. Diakses tanggal 4 Februari 2010.