Ciclodestrina
| Ciclodestrina | |
|---|---|
 | |
| Nomi alternativi | |
| zuccheri di Schardinger | |
| Caratteristiche generali | |
| Massa molecolare (u) | 972,86 g/mol |
| Aspetto | solido bianco |
| Numero CAS | (dell'α) |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 145 g/l (25 °C) |
| Temperatura di fusione | 278 °C (551 K) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
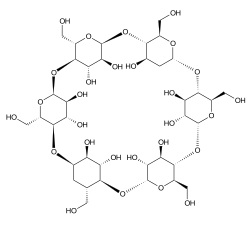
Le ciclodestrine (CyD o CD) sono un tipo di destrine costituite da oligosaccaridi ciclici naturali formati da 6, 7 o 8 monomeri di D-(+)glucopiranosio uniti tra loro con un legame α,1-4 glucosidico e chiusi ad anello.
Le ciclodestrine sono efficienti agenti chelanti. Posseggono una struttura supramolecolare a gabbia, la stessa formata da criptandi, calixareni, ciclofani ed eteri corona. Questi composti promuovono reazioni chimiche che coinvolgono interazioni intermolecolari senza la formazione di legami covalenti tra le molecole che interagiscono. La maggior parte di queste reazioni è di tipo “host-guest” (ospite/ospitante).
Tra tutti gli host conosciuti, le ciclodestrine ricoprono un ruolo particolarmente importante, perché, data la loro capacità di formare complessi stabili, possono essere significativamente modificate le proprietà dei materiali a cui esse aderiscono. Come conseguenza alla loro capacità di complessarsi con facilità, le ciclodestrine sono frequentemente usate in molti prodotti industriali, tecnologici e analitici. Il loro effetto citotossico trascurabile le porta ad un largo impiego come vettori, ma anche come cosmetici, negli imballaggi, nell'insaporimento di cibi, nei processi di separazione, nella tutela dell'ambiente, nella fermentazione e nella catalisi.
Storia
[modifica | modifica wikitesto]Conosciute anche come cicloamilosi, cliclomaltosi o destrine di Schardinger, si originano da una reazione intramolecolare di trans-glicosilazione, tramite degradazione dell'amido, da parte dell'enzima ciclodestrina-glucanotrasferasi (CGTasi).
Furono scoperte nel 1891, quando si ottenne una piccola quantità di materiale cristallino dalla digestione dell'amido da parte di un batterio, Bacilus amylobacter. Dopo poche settimane, in alcool, si ottenevano piccole quantità (circa 3 g/kg di amido) di un carboidrato, sotto forma di cristalli brillanti che avevano per formula un multiplo di (C6H10O3) · 3H2O.
Secondo altri, Antoine Villiers-Moriamé probabilmente ebbe contaminazioni nelle sue colture, e una contaminazione di Bacillus macerans produsse proprio le ciclodestrine. Villiers chiamò il suo prodotto cristallino "cellulosina".
Successivamente, nel 1903, Schardinger fu capace di isolare due prodotti cristallini: le destrine A e B, che erano caratterizzate dalla mancanza di "potere riducente". Purtroppo il ceppo batterico capace di formare questi prodotti dall'amido non le conservava.
Nel 1904 Franz Schardinger isolò un nuovo organismo, capace di sintetizzare acetone e alcol etilico da estratti vegetali contenenti amido e zucchero. Nel 1911 catalogò questo ceppo (Bacillus Macerans) capace di produrre una grande quantità di destrine cristalline dall'amido (25-30%). Schardinger chiamò i composti cristallini appunto "destrine cristallizzate". Solo nel 1935, ventiquattro anni dopo, le destrine vennero isolate. Furono sviluppati anche diversi schemi per il frazionamento e la ciclizzazione di destrine, costituendo appunto le ciclodestrine.
A quel tempo le strutture di questi composti erano ancora sconosciute, ma nel 1942 le strutture delle ciclodestrine furono determinate con la cristallografia a raggi X.
Nel 1946, a seguito di ulteriori esami ai raggi X, le ciclodestrine furono riconosciute come molecole in grado di formare complessi. La loro capacità di formare complessi di inclusione con diversi composti era alla base dell'interessamento generale.
Dalle strutture ai raggi X appariva che nelle ciclodestrine i gruppi ossidrilici secondari (sul C2 e C3) si trovavano sul lato più esteso dell'anello, mentre i gruppi ossidrilici primari (C6) erano sull'altro lato. Il C3 apolare, gli idrogeni sul C5 e l'ossigeno etereo, invece, erano posti all'interno della molecola.
Da quest'analisi risultava una molecola con un esterno idrofilo, che poteva quindi sciogliersi in acqua, e una cavità interna apolare, che conferiva invece un carattere idrofobo. Le ciclodestrine furono descritte come un "micro ambiente eterogeneo".
Caratteristiche chimico-fisiche
[modifica | modifica wikitesto]Le ciclodestrine hanno struttura cava a tronco di cono. In base al numero di monomeri (6, 7, o 8) sono dette alfa, beta o gamma ciclodestrine.
Le tre classi di ciclodestrine differiscono tra loro per grandezza dell'anello e dunque della cavità, pari a 5,70, 7,80 e 9,50 Å, e per la solubilità in acqua, pari a 18,5 g/l per la β, 145 g/l per l'α e 232 g/l per la γ. A temperatura ambiente si presentano come una polvere bianca cristallina inodore dal sapore debolmente dolce.
La struttura tridimensionale costringe i gruppi ossidrilici sui bordi esterni, mentre nella cavità sono presenti solo atomi di idrogeno e ponti ossigeno. Questo fa sì che la cavità centrale abbia natura idrofobica, mentre la parte esterna è idrofila: ciò si traduce nella possibilità per le ciclodestrine di ospitare molecole idrofobe all'interno della cavità e di essere solubili in acqua. Ne risulta anche l'abilità a indurre un incremento di solubilità delle sostanze idrofobe ospitate nella cavità in acqua. Quando una molecola di polarità e dimensioni opportune viene ospitata nella cavità della ciclodestrina si forma un cosiddetto complesso di inclusione di tipo supramolecolare.
Si ha così un rapporto tra le due molecole di ospite ed ospitante. Tra le tre ciclodestrine la più usata è la β, in quanto l'α risulta avere una cavità troppo piccola, la γ invece risulta avere costi di produzione troppo elevati. La β-ciclodestrina è meno idrosolubile rispetto alle altre due a causa dell'elevata tendenza con la quale forma dimeri insolubili, per questo sono state operate varie modifiche strutturali al fine di determinare un decremento della dimerizzazione e dunque un aumento della solubilità in acqua.
La formazione di un complesso di inclusione ospite/ospitante con ciclodestrina determina una variazione delle proprietà chimico-fisiche della sostanza inclusa: spesso infatti, come già detto, ne determina un notevole incremento della solubilità in acqua, ma anche un incremento delle intensità di fluorescenza, uno spostamento o un incremento delle bande di assorbimento.

Proprietà
[modifica | modifica wikitesto]In base al tipo di ciclodestrina e al tipo di molecola ospite, le ciclodestrine cristallizzano in due tipi di strutture: le strutture a canale (channel structures) e le strutture a gabbia (cage structures). Da queste strutture si osserva che le ciclodestrine quando sono complessate adottano la struttura ciclica tipica, cioè quella in cui tutte le unità glucopiranosiche hanno conformazione a sedia. Inoltre, studi con maltoesosi lineari, che formano una doppia elica antiparallela, indicano che l'α-ciclodestrina è la forma in cui l'ingombro sterico dovuto alla ciclizzazione è minore, mentre la γ-ciclodestrina è quella con più tensione.
A partire da queste ciclodestrine naturali, sono stati sintetizzati molti derivati. Questi ultimi, generalmente, sono ottenuti da reazioni di amminazione, esterificazione o eterificazione di gruppi ossidrili (primari o secondari) delle ciclodestrine. A seconda dei sostituenti, la solubilità dei derivati è di solito diversa da quella delle ciclodestrine di partenza. Praticamente tutti i derivati presentano una mutazione, sostanziale o meno, della cavità idrofobica, e tramite questa modifica possono essere aumentate la solubilità e la stabilità alla luce o all'ossigeno, e può essere controllata l'attività chimica delle molecole ospiti.
Circa venti sostituenti diversi sono stati legati alla β-ciclodestrina in modo regioselettivo. La sintesi delle nuove ciclodestrine derivate richiede l'utilizzo di reagenti regioselettivi, oltre ad un'ottimizzazione delle condizioni di reazione e una buona separazione dei prodotti. La reazione più utilizzata è un attacco elettrofilo sui gruppi -OH, che comporta la formazione di eteri ed esteri mediante alogenuri alchilici, epossidi, derivati acilici, isocianati e derivati di acidi carbossilici. Sono anche state promosse reazioni che riguardano i legami C-OH, coinvolgendo un attacco nucleofilo da parte di composti come ioni azide, alogenuri, tioli, tiourea e ammine; ciò richiede l'attivazione dell'atomo di ossigeno da parte di un gruppo elettron-attrattore.
Data la loro capacità di legarsi, covalentemente o non, ad altre ciclodestrine e data la capacità di formare complessi di inclusione con molecole organiche, le ciclodestrine possono essere usate come unità per la costruzione di complessi supramolecolari. In questo modo possono essere costruiti composti come catenani, rotaxani o poli-rotaxani. Tali composti, che non possono essere preparati con nessun altro metodo, possono essere impiegati, ad esempio, per la separazione di complessi da miscele di enantiomeri.
Ogni anno, le ciclodestrine sono oggetto di quasi 1000 articoli di ricerca e documenti scientifici, un gran numero dei quali si occupa di farmaci o prodotti legati ai farmaci. Inoltre, sono state descritte numerose invenzioni che includono ciclodestrine (oltre 1000 brevetti negli ultimi 5 anni).
Per quanto riguarda le β-ciclodestrine sono già disponibili pubblicazioni, sia su US Pharmacopoeia/National Formulary (USP 23/NF18, 1995) che su European Pharmacopoeia (3rd ed., 1997). Dopo più di un secolo dalla loro scoperta, le ciclodestrine sono state rapidamente accettate come "nuovi eccipienti farmaceutici".
Considerazioni tossicologiche
[modifica | modifica wikitesto]I profili di sicurezza delle tre più comuni ciclodestrine naturali e di alcuni dei loro derivati sono stati recentemente ridiscussi e rivisti. In generale, le ciclodestrine naturali ed i loro derivati idrofili sono in grado di permeare le membrane biologiche lipofile, come la cornea dell'occhio ad esempio, con una certa difficoltà. Anche le β-ciclodestrine metilate non permeano facilmente le membrane lipofile, sebbene interagiscano in modo nettamente migliore delle ciclodestrine idrofile.
Tutti gli studi di tossicità hanno dimostrato che le ciclodestrine somministrate per via orale sono praticamente non tossiche, a causa proprio del mancato assorbimento nel tratto gastrointestinale. Inoltre, una serie di valutazioni di sicurezza ha dimostrato che le γ-ciclodestrine, le 2-idrossipropil-β-ciclodestrine, le sulfobutil-eter-β-ciclodestrine, le β-ciclodestrine solfate e le β-ciclodestrine maltosilate sembrano essere sicure anche quando somministrate per via parenterale. Tuttavia, studi tossicologici hanno inoltre dimostrato che le α-ciclodestrine, le β-ciclodestrine e le β-ciclodestrine metilate non sono adatte alla somministrazione parenterale.
α-ciclodestrine
[modifica | modifica wikitesto]Le caratteristiche principali sono le seguenti:
- risultano relativamente irritanti dopo iniezione intramuscolo;
- legano diversi lipidi;
- comportano irritazioni oculari;
- vengono assorbite dai ratti tra il 2 e il 3% dopo somministrazione orale;
- non vengono metabolizzate nel tratto intestinale superiore;
- sono attaccate dalla flora intestinale (cieco e colon).
L'escrezione dopo somministrazione orale nei ratti è avvenuta per il 60% sotto forma di CO2 (nessuna esalazione, dopo somministrazione orale nei ratti sani), per il 26-33% come metabolita nel sangue, e per il 7-14% come metabolita nelle feci e urine (escrete principalmente immodificate per via renale), dopo iniezioni intravenose con tempo di dimezzamento di 25 min nei topi.
LD50 orale nel ratto > 10.000 mg/kg LD50 e.v. nel ratto tra 500 e 700 mg/kg.
β-ciclodestrine
[modifica | modifica wikitesto]Le caratteristiche principali sono le seguenti:
- risultano meno irritanti rispetto alle α-ciclodestrine dopo iniezione intramuscolo;
- legano il colesterolo;
- sono assorbite in quantità molto piccole nel tratto intestinale superiore, dopo somministrazione orale (1-2%);
- sono metabolizzate dai batteri nell'intestino cieco e nel colon.
Attualmente sono le ciclodestrine più comuni nelle formulazioni farmaceutiche e quindi probabilmente quelle meglio studiate. Risultano essere quelle meno solubili, in quanto possiedono un numero dispari di unità. L'utilizzo ad alte dosi potrebbe essere dannoso e perciò non è consigliato; la fermentazione e la degradazione batterica nel colon possono portare alla produzione di gas e diarrea.
LD50 orale nel ratto > 5.000 mg / kg LD50 e.v. nel ratto tra 450 e 790 mg / kg.
γ-ciclodestrine
[modifica | modifica wikitesto]Le caratteristiche principali sono le seguenti:
- generano irritazioni insignificanti dopo iniezioni intramuscolo;
- sono degradate rapidamente e completamente in glucosio nel tratto superiore intestinale da parte di enzimi (anche ad alte dosi giornaliere, ad esempio 10-20 g/kg);
- l'assorbimento dopo somministrazione orale è quasi nullo (0,1 %);
- non avviene praticamente nessun metabolismo dopo somministrazione intravenosa.
Probabilmente sono le ciclodestrine minormente tossiche, almeno tra le tre ciclodestrine naturali. Impiegate attivamente come additivo alimentare per le loro caratteristiche, presentano capacità complessanti, generalmente minori delle β-ciclodestrine e dei derivati idrosolubili delle β-ciclodestrine. I loro complessi spesso hanno una solubilità limitata in soluzioni acquose e tendono ad aggregarsi, il che rende la soluzione lattiginosa (opalescenza).
LD50 orale nel ratto > 8.000 mg / kg LD50 e.v. nel ratto > circa 4000 mg / kg.
Formazione del complesso di inclusione
[modifica | modifica wikitesto]La caratteristica principale delle ciclodestrine è la loro capacità di formare complessi di inclusione solidi (complessi host-guest), con una gamma molto varia di composti solidi, liquidi e gassosi, tramite complessazione molecolare. In questi complessi una molecola ospite si pone all'interno della cavità della ciclodestrina host. Le dimensioni del complesso sono in rapporto tra la cavità dell'host e la molecola guest. La cavità lipofila delle ciclodestrine fornisce un micro ambiente in cui frazioni apolari di dimensioni appropriate possono inserirsi per formare complessi di inclusione. Durante la formazione del complesso nessun legame covalente viene formato o rotto. Ciò che promuove principalmente la formazione del complesso è il rilascio di molecole d'acqua (altamente entalpiche) dalla cavità.
Le molecole d'acqua vengono spostate dalle molecole guest (idrofobiche) presenti in soluzione per formare un'"interazione idrofobica" e ridurre la tensione dell'anello ciclodestrinico. Come risultato si ha il raggiungimento di uno stato energetico inferiore e quindi più stabile. Il legame tra le molecole ospiti (guest) e la ciclodestrina (host), non è permanente, ma è regolato da un equilibrio dinamico. La forza del legame dipende dall'adattamento reciproco tra host e guest e da specifiche interazioni tra gli atomi sulla superficie. I complessi possono essere formati sia in soluzione, sia allo stato cristallino, e l'acqua è in genere il solvente preferito. L'inclusione di complessi può anche essere realizzata in un sistema, tramite co-solvente ed in presenza di solventi non acquosi. La struttura della ciclodestrina conferisce una vasta gamma di proprietà chimiche molto diverse da quelle mostrate da carboidrati non-ciclici a parità di peso molecolare. L'inclusione delle ciclodestrine, inoltre, esercita un profondo effetto sulle proprietà chimico-fisiche delle molecole ospiti, che sono temporaneamente bloccate o ingabbiate all'interno della cavità ospitante, dando luogo a determinate modificazioni che altrimenti non sarebbero ottenibili. Queste proprietà sono
- innalzamento della solubilità in acqua di molecole guest altamente insolubili;
- stabilizzazione di molecole guest contro possibili effetti di degradazione (ossidazione, luce, calore, UV);
- controllo della volatilità e della sublimazione;
- isolamento fisico di composti incompatibili;
- separazione cromatografica;
- modifica o mascheramento del gusto di cibi o farmaci;
- modifica di odori sgradevoli;
- rilascio controllato di farmaci.
Pertanto le ciclodestrine sono usate nei prodotti alimentari, farmaceutici e cosmetici, nella tutela dell'ambiente, negli imballaggi, nella bioconversione e nell'industria tessile.
La lista dei potenziali ospiti per l'incapsulamento molecolare in ciclodestrine è molto varia. Comprende composti come molecole alifatiche (lineari o ramificate), aldeidi, chetoni, alcoli, acidi organici, acidi grassi, molecole aromatiche, gas e composti polari quali alogenuri, ossiacidi e ammine. La funzionalità delle ciclodestrine può essere ampiamente aumentata tramite modificazioni chimiche sui diversi gruppi ossidrilici reattivi. Le applicazioni e gli impieghi di ciclodestrine modificate sono svariati. Le ciclodestrine vengono modificate mediante la sostituzione di vari gruppi funzionali (-OH), sia sulla faccia superiore, sia su quella inferiore della molecola. Le ciclodestrine modificate sono molto utili in quanto agiscono da enzimo-mimetici, perché i gruppi funzionali sostituiti interferiscono con il riconoscimento molecolare enzimatico. Questa proprietà viene sfruttata per la somministrazione di farmaci mirati ed in chimica analitica, dove le ciclodestrine modificate mostrano maggiore enantioselettività rispetto alle ciclodestrine originali.
La capacità di una ciclodestrina di formare un complesso di inclusione con una molecola ospite è funzione di due fattori chiave:
- il primo è sterico e dipende sia dalla dimensione della ciclodestrina, sia dalla dimensione della molecola ospite, o da alcuni gruppi funzionali nel guest stesso: se l'ospite non ha le dimensioni esatte, non si adatterà correttamente alla cavità della ciclodestrina;
- il secondo fattore critico è rappresentato dalle interazioni termodinamiche tra i diversi componenti del sistema (ciclodestrina, ospite, solvente); per la formazione di un complesso ci deve necessariamente essere una forza trainante favorevole, che attiri il guest nella ciclodestrina.
Mentre l'altezza della cavità della ciclodestrina è la stessa per tutti e tre i tipi (alfa, beta e gamma), il numero di unità determina il diametro interno ed il volume della cavità. Sulla base di queste dimensioni, l'α-ciclodestrina può generalmente complessare molecole a basso peso molecolare o molecole con catene laterali alifatiche, la β-ciclodestrina complessa invece molecole aromatiche ed eterocicliche, mentre la γ-ciclodestrina può ospitare molecole più grandi come macrocicli e steroidi. In generale quindi ci sono quattro interazioni energeticamente favorevoli che promuovono la formazione di complessi:
- lo spostamento delle molecole d'acqua dalla cavità idrofobica della ciclodestrina;
- l'aumento del numero di legami idrogeno;
- una riduzione delle interazioni repulsive tra il guest idrofobico e l'ambiente acquoso;
- un aumento delle interazioni idrofobiche con l'introduzione del guest nella cavità della ciclodestrina.
Mentre la formazione del complesso è molto rapida (spesso qualche minuto), raggiungere l'equilibrio finale può richiedere molto più tempo. Una volta all'interno della cavità della ciclodestrina, la molecola ospite opera adeguamenti conformazionali per sfruttare al massimo le deboli forze di Van der Waals che esistono.
I complessi possono essere formati con diverse tecniche, che dipendono dalle proprietà della molecola ospite, dalla cinetica di equilibrio, da altri elementi di formulazione e dal dosaggio finale desiderato. Tuttavia ciascuno di questi processi dipende strettamente da una piccola quantità d'acqua (termodinamica). Tra i metodi più utilizzati ci sono la semplice miscela secca, il mix in soluzione seguito da un'adeguata separazione, la preparazione di paste e diverse tecniche termo-meccaniche.
La dissociazione del complesso host-guest è un processo generalmente rapido, di solito guidato da un grande aumento di molecole d'acqua nell'ambiente circostante. Il gradiente di concentrazione risultante sposta nettamente l'equilibrio. In sistemi altamente diluiti e dinamici, come il corpo umano, il guest avrà difficoltà nel trovare un'altra ciclodestrina per complessarsi nuovamente, e sarà quindi lasciato libero in soluzione.
Produzione
[modifica | modifica wikitesto]Le ciclodestrine sono derivate dall'amido. La sintesi avviene per azione di un enzima chiamato ciclodestrina glicosiltransferasi (CGTasi) sull'amido degradato per idrolisi termica o utilizzando l'α-amilasi. In questo modo si ottengono miscele contenenti i tre tipi di ciclodestrina. È possibile variare il rapporto con cui i tipi di ciclodestrine vengono ottenuti variando i tipi di CGTasi utilizzati. Le CGTasi hanno caratteristiche diverse a seconda del microrganismo da cui vengono estratte.
Le β-ciclodestrine sono facilmente separate e purificate dalla miscela di reazione per cristallizzazione grazie alla loro scarsa solubilità in acqua, mentre le α e le γ-ciclodestrine richiedono l'utilizzo di tecniche cromatografiche ben più costose, che giustificano il costo notevolmente più basso della prima rispetto alle altre due.
Una variante della reazione descritta prevede l'utilizzo di uno specifico composto complessante in grado di interagire specificatamente con uno dei tre tipi di ciclodestrina, causandone la precipitazione. La ciclodestrina precipitata può essere raccolta per centrifugazione e in seguito separata dall'agente complessante. Gli agenti complessanti/precipitanti più utilizzati sono l'etanolo, l'acetone e il toluene.
L'inclusione di ciclodestrine è un fenomeno molecolare stechiometrico in cui di solito un solo ospite interagisce con la cavità della ciclodestrina. Diversi legami non covalenti, come le forze di Van der Waals, le interazioni idrofobiche, il trasferimento di carica, i legami a idrogeno, sono responsabili della formazione di un complesso stabile.
Generalmente una molecola ospite è inclusa in una molecola di ciclodestrina; tuttavia, nel caso di alcune molecole a basso peso molecolare, più di una molecola ospite può inserirsi nella cavità, mentre nel caso di alcune grandi molecole più di una ciclodestrina può legarsi al guest. Come risultato di ciò, non sono sempre rispettati rapporti molari 1:1, specialmente con ospiti ad alto o basso peso molecolare. In linea di principio vale la regola che solo una porzione della molecola ospite deve inserirsi nella cavità per formare un complesso.
Effetto della temperatura e dell'acqua
[modifica | modifica wikitesto]La temperatura ha diversi effetti sui complessi host-guest: il riscaldamento può aumentare la solubilità del complesso, ma allo stesso tempo può destabilizzarlo. Questi effetti hanno spesso bisogno di essere equilibrati. La stabilità termica del complesso varia da ospite a ospite: la maggior parte dei complessi inizia a decomporsi a 50-60 °C, mentre altri risultano stabili alle alte temperature, soprattutto se il guest presenta legami forti o se il complesso è altamente insolubile.
Quando la concentrazione d'acqua viene aumentata, le solubilità della ciclodestrina e del guest sono aumentate e quindi la complessazione si verifica molto più facilmente rispetto ad una situazione anidra. Tuttavia, poiché la quantità d'acqua è aumentata, la ciclodestrina e la molecola ospite si possono diluire in modo da non entrare in contatto facilmente, come invece avviene in una soluzione più concentrata. Pertanto, è bene tenere la percentuale d'acqua sufficientemente bassa per garantire una complessazione veloce. Alcuni composti ad alto peso molecolare, come gli oli ad esempio, hanno la tendenza ad associarsi a se stessi piuttosto che interagire con le ciclodestrine. In questi casi, utilizzando più acqua, assieme ad un'ottima miscelazione, si consentirà una migliore dispersione, nonché la separazione delle molecole d'olio, con successivo isolamento dell'una dall'altra. A questo punto quindi le molecole d'olio, quando verranno a contatto con le ciclodestrine, formeranno un complesso molto più stabile di quello che si otterrebbe con una percentuale d'acqua nettamente minore.
Guest volatili
[modifica | modifica wikitesto]I guest volatili possono subire dispersione durante la fase di complessazione, specialmente se si aumenta la temperatura. Quando si utilizzano guest altamente volatili, ciò può essere evitato utilizzando o un reattore sigillato, che evita la dispersione, o un sistema di reflusso in cui le molecole ospite verranno spinte indietro e torneranno al recipiente di miscelazione.
Tecniche di complessazione
[modifica | modifica wikitesto]Co-precipitazione
[modifica | modifica wikitesto]La co-precipitazione è il metodo più utilizzato in laboratorio.
La ciclodestrina viene disciolta in acqua e successivamente il guest è aggiunto mentre la soluzione è sempre sotto agitazione. La concentrazione della β-ciclodestrina, per esempio, può raggiungere il 20% se il guest tollera temperature elevate. Se viene scelta una concentrazione sufficientemente elevata di ciclodestrina, l'eccessiva solubilità del complesso host-guest sarà superata man mano che la reazione di complessazione procede o durante il raffreddamento. In molti casi la soluzione ciclodestrina-guest deve essere raffreddata sotto agitazione, prima che si formino precipitati. Qualora si formasse, il precipitato può essere raccolto tramite decantazione, centrifuga o filtrazione. Il precipitato inoltre può essere sciacquato con una piccola quantità d'acqua o un altro solvente polare, come metanolo, etanolo o acetone. Il solvente può essere però dannoso per alcuni complessi, e quindi dovrebbe essere sempre testato prima di ogni suo impiego.
Lo svantaggio di questo metodo risiede nella necessità di utilizzare grandi volumi d'acqua, a causa della limitata solubilità delle ciclodestrine: quindi la capacità d'assorbimento, il tempo e l'energia per il riscaldamento e il raffreddamento possono divenire importanti fattori di costo. Inoltre, anche il trattamento e il successivo smaltimento delle soluzioni ottenute dopo la raccolta del complesso possono destare preoccupazioni. In molti casi, però, le soluzioni possono essere riciclate. Inoltre, tensioattivi non-ionici hanno dimostrato di ridurre significativamente la complessazione della CD con Diazepam e con vari steroidi. D'altra parte, additivi come l'etanolo possono invece promuovere la formazione del complesso allo stato solido o semisolido. Farmaci non ionizzati, di solito, formano un complesso molto più stabile rispetto alle loro controparti ionizzate, e quindi l'efficienza della complessazione di farmaci può essere aumentata con l'aggiunta di ammoniaca alle soluzioni acquose. Ad esempio, la solubilizzazione di "pancratistatin" con idrossipropil-ciclodestrina è stata ottimizzata per aggiunta di idrossido d'ammonio.
Slurry complexation
[modifica | modifica wikitesto]Per formare un complesso non è necessario sciogliere completamente le ciclodestrine. Le ciclodestrine solide possono essere aggiunte all'acqua in agitazione, al 50-60% circa. La fase acquosa verrà saturata con le ciclodestrine in soluzione. Le molecole ospiti aggiunte si complesseranno con le ciclodestrine in soluzione e, dopo che il complesso ciclodestrina-guest avrà saturato la soluzione, esso cristallizzerà e precipiterà. I cristalli di ciclodestrina, quindi, si dissolveranno e continueranno a saturare la soluzione fino a formare il complesso, per poi precipitare o cristallizzare. I cristalli ottenuti possono essere raccolti nello stesso modo del metodo per "co-precipitazione". Il tempo necessario a completare la complessazione è variabile e dipende dal guest. Devono essere effettuati saggi preliminari per determinare il tempo necessario. Generalmente la slurry complexation è effettuata a temperatura ambiente. Con diversi tipi di guest si può aumentare la temperatura per migliorare la complessazione, ma è necessaria molta cautela, in quanto fornire troppo calore può destabilizzare il complesso e quindi la reazione di complessazione non avverrà o avverrà in maniera incompleta. Il vantaggio principale di questo metodo è l'enorme riduzione dell'acqua necessaria, oltre che la contenuta grandezza del reattore.
Paste complexation (kneading)
[modifica | modifica wikitesto]Questa è una variante della slurry complexation. Viene aggiunta una piccola quantità d'acqua per formare una "pasta", che viene miscelata con le ciclodestrine con un mortaio e un pestello, o su larga scala utilizzando un impastatore. La quantità di tempo richiesto dipende dal guest. Il complesso risultante può essere direttamente essiccato o lavato con una piccola quantità d'acqua e raccolto per filtrazione o centrifuga. Le paste, a volte, seccano formando una massa dura invece di una polvere fine: questo può dipendere sia dal guest, sia dalla quantità d'acqua utilizzata. Generalmente dalla massa dura si può comunque ottenere una polvere, mediante accurata asciugatura e macinatura.
Mescolamento e riscaldamento (damp mixing)
[modifica | modifica wikitesto]Questo metodo prevede l'utilizzo di poca, se non nessuna, acqua. La quantità di acqua può variare fino ad un massimo del 20-25% in base all'idratazione delle ciclodestrine e al guest aggiunto. Le ciclodestrine e i guest vengono accuratamente miscelati e riposti in un contenitore sigillato. Il contenitore viene poi riscaldato a circa 100 °C. Successivamente il contenuto viene rimosso ed essiccato. La quantità d'acqua aggiunta, il grado di miscelazione e il tempo di riscaldamento devono essere necessariamente ottimizzati per ogni guest.
Estrusione (extrusion)
[modifica | modifica wikitesto]L'estrusione è una variante del metodo di riscaldamento e mescolamento, ed è un sistema continuo. Le ciclodestrine, i guest e l'acqua possono essere premiscelati o miscelati ed aggiunti ad un reattore chiamato "estrusore". Il grado di miscelazione, il riscaldamento e la quantità di tempo possono essere facilmente controllati nella canna dell'estrusore. A seconda della quantità d'acqua, il complesso può seccare raffreddandosi naturalmente, o può essere asciugato in un forno. L'estrusione ha i vantaggi di essere un processo continuo e di richiedere pochissima acqua. A causa del calore generato, però, con questo metodo alcuni guest termolabili si decompongono.
Miscelazione a secco
[modifica | modifica wikitesto]Questo metodo è una variante della paste complexation. Alcuni guest possono essere complessati semplicemente mediante aggiunta alle ciclodestrine e miscelazione. Questo funziona bene con gli oli e con i guest liquidi. Il tempo di miscelazione necessario è variabile e dipende dai guest. Generalmente questo metodo viene eseguito a temperatura ambiente. Il principale vantaggio è che non è necessario aggiungere acqua se non si utilizza una fase di lavaggio. Gli svantaggi sono i rischi di formazione di grumi su larga scala, che portano ad una complessazione incompleta. Inoltre con molti guest il tempo di miscelazione necessario può essere eccessivamente lungo.
Rilascio
[modifica | modifica wikitesto]Una volta che il complesso si è formato ed è stato essiccato, risulta essere molto stabile, con una lunga conservazione a temperatura ambiente in condizioni asciutte. Lo spostamento di un guest complessato, in favore di un nuovo guest, richiede calore. In molti casi l'acqua può sostituire il guest. Quando un complesso è riposto in acqua, il rilascio del guest complessato prevede due passaggi:
- in primo luogo il complesso è disciolto;
- successivamente il guest viene scalzato dalle molecole d'acqua.
Sarà stabilito quindi un equilibrio tra le ciclodestrine libere e complessate, e il guest. Nel caso di complessi contenenti guest multipli o ciclodestrine multiple, le molecole ospite non sono necessariamente rilasciate nella stessa proporzione della miscela originale. Ogni complesso può avere diversa solubilità e quindi diversa velocità di rilascio. Se il rilascio è differente per ogni guest del complesso, è possibile modificarlo semplicemente alterando la formulazione dei guest stessi.
Applicazioni delle ciclodestrine
[modifica | modifica wikitesto]Poiché ogni guest è circondato da una ciclodestrina, possiamo dire che ogni guest risulterà micro-incapsulato. Il micro-incapsulamento può portare a cambiamenti vantaggiosi nelle proprietà chimiche e fisiche dei vari guest:
- stabilizzazione di sostanze sensibili alla luce o all'ossigeno;
- modificazioni della reattività chimica dei guest;
- inclusione di sostanze molto volatili;
- miglioramento della solubilità delle sostanze;
- conversione di sostanze liquide in polveri;
- protezione contro la degradazione da microrganismi;
- mascheramento di cattivo odore o sapore;
- pigmentazione o colorazione di sostanze;
- attività catalitica di ciclodestrine con diversi guest.
Queste caratteristiche rendono le ciclodestrine e i loro derivati adatti per applicazioni in svariati ambiti, dalla chimica analitica all'agricoltura, dal settore farmaceutico a quello alimentare e a quello igienico.
Spesso le ciclodestrine vengono utilizzate in campo alimentare per includere aromi ed essenze e migliorarne la stabilità cambiandone lo stato d'aggregazione da liquido a solido.
Le β-ciclodestrine possono essere usate in campo farmaceutico grazie all'assenza di tossicità che presentano quando somministrate per via orale. In questo campo vengono spesso impiegate per la capacità di questi ospitanti di mascherare il sapore sgradevole di alcuni farmaci, per convertire composti liquidi in solidi e inoltre per migliorare il profilo di biodisponibilità di molti farmaci grazie soprattutto alla capacità di migliorare la solubilità in acqua. La β-ciclodestrina non può essere utilizzata per somministrazione parenterale in quanto è nefrotossica, tuttavia derivati idrossipropilici di questa ciclodestrina e l'α-ciclodestrina possono essere utilizzate per questa via perché non presentano alcuna tossicità e consentono di formulare con estrema facilità farmaci insolubili in acqua. Comunque ad oggi vengono utilizzate soprattutto per la preparazione di forme farmaceutiche orali, in particolare di compresse, ma anche di capsule, suppositori e soluzioni.
Le ciclodestrine trovano impiego anche in gascromatografia come fase stazionaria per colonne chirali, ossia in grado di separare enantiomeri.
Ultimamente sono sempre più utilizzate in campo cosmetico.
Le ciclodestrine sono state proposte per donare nuove caratteristiche a tessuti e indumenti. In particolare sono state create fibre tessili contenenti ciclodestrine legate chimicamente in grado di garantire al tessuto una resistenza ai cattivi odori. Le ciclodestrine in questi tessuti intrappolano le molecole responsabili di cattivi odori impedendone l'evaporazione e dunque la percezione. Un'altra possibilità è quella di spruzzare profumi e fragranze su questi tessuti che verranno sequestrati dalle ciclodestrine che ne rallenteranno l'evaporazione prolungando l'efficacia della profumazione.
Applicazioni farmaceutiche
[modifica | modifica wikitesto]Un farmaco deve necessariamente avere una certa idrofilia per essere trasportato e solubilizzato nel sangue, ma deve essere anche sufficientemente idrofobo per attraversare le membrane. Una delle proprietà uniche delle CD è la loro capacità di migliorare il passaggio di farmaci attraverso le membrane biologiche.
Le ciclodestrine sono molecole relativamente grandi (hanno peso molecolare compreso tra 1000 e oltre 1500), con una superficie esterna idrofila. In condizioni normali permeano le membrane con notevole difficoltà. È generalmente riconosciuto che le CD agiscono come veri vettori, mantenendo le molecole di farmaco (guest) idrofobiche in soluzione e trasportandole verso la superficie delle membrane biologiche, ad esempio la pelle, le mucose o la cornea. La membrana lipofila ha una bassa affinità per le molecole di ciclodestrina che sono invece a carattere idrofilo e rimangono nell'ambiente acquoso esterno alla membrana, quale ad esempio un veicolo (crema o gel), o il fluido lacrimale.
I promotori di permeazione convenzionali, quali alcoli e acidi grassi, perturbano gli strati lipidici della barriera. Le ciclodestrine invece agiscono come promotori di permeazione, aumentando la disponibilità del farmaco sulla superficie della barriera biologica. Ad esempio, le ciclodestrine sono state utilizzate con successo in formulazioni dermiche, o in soluzioni acquose quali collutori, spray nasali e diversi colliri. La maggior parte dei principi attivi farmaceutici non possiede sufficiente solubilità in acqua, e i sistemi di formulazione tradizionali per i farmaci insolubili coinvolgono una combinazione di solventi organici, tensioattivi e condizioni estreme di pH, che spesso causano irritazioni o altre reazioni avverse.
Ci sono svariate applicazioni per le ciclodestrine in campo farmaceutico. Per esempio l'aggiunta di α- o β-ciclodestrine aumenta la solubilità di numerose sostanze scarsamente solubili in acqua. In alcuni casi questo si traduce in una migliore biodisponibilità, aumentando l'effetto farmacologico e permettendo quindi una riduzione del dosaggio del farmaco somministrato.
I complessi host-guest, come già detto, possono anche facilitare la manipolazione di sostanze volatili. Questo può portare ad una diversa via di somministrazione del farmaco, ad esempio in forma di compresse. Le ciclodestrine sono inoltre utilizzate per migliorare la stabilità delle sostanze e la resistenza a idrolisi, ossidazione, luce, calore e sali metallici. L'inclusione di prodotti irritanti nelle ciclodestrine può anche proteggere la mucosa gastrica da somministrazioni orali e ridurre i danni alla pelle per via cutanea. Inoltre, le ciclodestrine possono essere usate per mascherare gli effetti dei farmaci maleodoranti o amari.
Le ciclodestrine sono abbastanza resistenti alle amilasi, anche se possono essere degradate dalle α-amilasi. Le α-ciclodestrine sono le più lente a degradarsi, mentre le γ- sono le più velocemente degradabili, a causa della loro differenza di dimensione e flessibilità. La degradazione non viene eseguita dalle amilasi salivari o dalle amilasi pancreatiche, ma dalle α-amilasi dei microrganismi della flora del colon. Studi sull'assorbimento hanno rivelato che solo il 2-4% delle ciclodestrine è assorbito nell'intestino tenue, mentre la rimanenza è degradata e convertita in glucosio. Questo può spiegare la bassa tossicità delle cicldoestrine che è stata riscontrata dopo somministrazione orale.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 25.01.2011
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Ciclodestrina
Wikimedia Commons contiene immagini o altri file su Ciclodestrina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) IUPAC Gold Book, "cyclodextrins", su goldbook.iupac.org.
| Controllo di autorità | BNE (ES) XX547483 (data) · J9U (EN, HE) 987007538314905171 |
|---|
