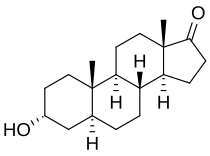
アンドロステロン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| データベースID | |
| CAS番号 | 53-41-8 |
| ATCコード | none |
| PubChem | CID: 5879 |
| ChemSpider | 5668 |
| UNII | C24W7J5D5R |
| ChEBI | CHEBI:16032 |
| ChEMBL | CHEMBL87285 |
| 化学的データ | |
| 化学式 | C19H30O2 |
| 分子量 | 290.45 g·mol−1 |
| |
| |
アンドロステロン(androsterone)または5α-アンドロスタン-3α-オール-17-オン(5α-androstan-3α-ol-17-one)は、内因性ステロイドホルモン、神経ステロイド、推定上のフェロモンである[1]。テストステロンの約7分の1の効力を持つ弱いアンドロゲン(雄ホルモン)である[2]。アンドロステロンはテストステロンおよびジヒドロテストステロン(DHT)の代謝物である。加えて、3α-ヒドロキシステロイドデヒドロゲナーゼおよび17β-ヒドロキシステロイドデヒドロゲナーゼによって、アンドロステンジオンやテストステロンといった従来型中間体を迂回してDHTへと元に戻る。そのようなものとして、アンドロステロンはそれ自体で代謝中間体を考えることができる[3][4]。
アンドロステロンは、GABAA受容体の正のアロステリック調節因子として働く[5]抑制性アンドロスタン神経ステロイドとしても知られており[6][7]、また抗てんかん作用を有する[8]。アンドロステロンの非天然型エナンチオマーはGABAA受容体の正のアロステリック調節因子や抗てんかん薬として天然型よりも高い効果を示す[9]。アンドロステロンの3β-異性体はエピアンドロステロン、5β-異性体はエチオコラノロン、3β,5β-異性体はエピエチオコラノロンである。
生物学的機能
[編集]アンドロステロンは一般的にテストステロンの不活性代謝物と考えられており、グルクロン酸抱合や硫酸抱合といった抱合を受けた時にテストステロンを人体から取り除くことができる。しかし、アンドロステロンは脳に入ることができる弱い神経ステロイドであり、脳機能に影響を与え得る[8]。
フェロモン
[編集]アンドロステロンはヒトの腋の下や皮膚、尿中に見出される[10]。アンドロステロンはヒトの皮脂腺によっても分泌されているかもしれない[10]。アンドロステロンはアンドロステノールと同様の麝香の香りを持つと記述されている[10]。アンドロステロンをヒトが嗅いだ時、ヒトの行動に影響を与えることが明らかにされている[10]。
生化学
[編集]生合成アンドロステロンとその5β-異性体のエチオコラノロンはテストステロンの代謝物として人体で生産される。テストステロンは5α-レダクターゼおよび5β-レダクターゼによってそれぞれ5α-ジヒドロテストステロンおよび5β-ジヒドロテストステロンへと変換される。3α-ヒドロキシステロイドデヒドロゲナーゼはこれらの還元型を5α-アンドロスタンジオールおよび5β-アンドロスタンジオールへとそれぞれ変換し、これらは次に17β-ヒドロキシステロイドデヒドロゲナーゼによってアンドロステロンおよびエチオコラノロンへとそれぞれ変換される。アンドロステロンおよびエチオコラノロンは5α-レダクターゼおよび5β-レダクターゼの働きによってアンドロステンジオンからも形成できる。これらの酵素は5α-アンドロスタンジオンおよび5β-アンドロスタンジオンを形成し、これらは次に3α-ヒドロキシステロイドデヒドロゲナーゼおよび3β-ヒドロキシステロイドデヒドロゲナーゼによってアンドロステロンおよびエチオコラノロンへとそれぞれ変換される[8]。
代謝
[編集]アンドロステロンは、硫酸抱合を受けると硫酸アンドロステロンになり、グルクロン酸抱合を受けるとアンドロステロングルクロニドになる。これらの抱合体は、主に尿中へと排泄される。
化学
[編集]所在
[編集]アンドロステロンはマツの花粉中に天然に存在することが知られており、多くの動物種においてもよく知られている[11]。
歴史
[編集]アンドロステロンは1931年にアドルフ・フードリヒ・ヨハン・ブーテナントとクルト・チェルニンク(Kurt Tscherning)によって初めて単離された。彼らは1万7千リットルの男性の尿を蒸留し、50 mgのアンドロステロン結晶を得た。この結晶から、アンドロステロンの化学式がエストロンと非常に似ていることが明らかになった。
出典
[編集]- ^ Motofei, Ion G. (2011). “A dual physiological character for cerebral mechanisms of sexuality and cognition: common somatic peripheral afferents”. BJU International 108 (10): 1634–1639. doi:10.1111/j.1464-410X.2011.10116.x. ISSN 1464-4096.
- ^ Scott T (1996). Concise Encyclopedia Biology. Walter de Gruyter. p. 49. ISBN 978-3-11-010661-9 25 May 2012閲覧。
- ^ Henderson BE; Ponder BAJ; Ross RK (13 March 2003). Hormones, Genes, and Cancer. Oxford University Press. p. 23. ISBN 978-0-19-513576-3 25 May 2012閲覧。
- ^ “Increased activation of the alternative "backdoor" pathway in patients with 21-hydroxylase deficiency: evidence from urinary steroid hormone analysis”. The Journal of Clinical Endocrinology and Metabolism 97 (3): E367–75. (March 2012). doi:10.1210/jc.2011-1997. PMID 22170725.
- ^ “Natural and enantiomeric etiocholanolone interact with distinct sites on the rat alpha1beta2gamma2L GABAA receptor”. Mol. Pharmacol. 71 (6): 1582–90. (June 2007). doi:10.1124/mol.106.033407. PMID 17341652.
- ^ “Neurosteroids — Endogenous Regulators of Seizure Susceptibility and Role in the Treatment of Epilepsy”. Jasper's Basic Mechanisms of the Epilepsies [Internet]. 4th edition. Bethesda (MD): National Center for Biotechnology Information (US). (2012)
- ^ Reddy DS (2010). “Neurosteroids: endogenous role in the human brain and therapeutic potentials”. Prog. Brain Res. 186: 113–37. doi:10.1016/B978-0-444-53630-3.00008-7. PMC 3139029. PMID 21094889.
- ^ a b c “Anticonvulsant activity of androsterone and etiocholanolone”. Epilepsia 46 (6): 819–27. (June 2005). doi:10.1111/j.1528-1167.2005.00705.x. PMC 1181535. PMID 15946323.
- ^ “Anticonvulsant potencies of the enantiomers of the neurosteroids androsterone and etiocholanolone exceed those of the natural forms”. Psychopharmacology 231 (17): 3325–32. (September 2014). doi:10.1007/s00213-014-3546-x. PMC 4134984. PMID 24705905.
- ^ a b c d Maiworm, R. E.; Langthaler, W. U. (1992). Influence of Androstenol and Androsterone on the Evalulation of Men of Varying Attractiveness Levels. pp. 575–579. doi:10.1007/978-1-4757-9655-1_88.
- ^ “Mammalian sex hormones in plants”. Folia Histochemica et Cytobiologica 43 (2): 71–79. (2005).
