플루토늄
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 개요 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 영어명 | Plutonium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기율표 정보 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 번호 (Z) | 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 족 | n/a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 주기 | 7주기 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 구역 | f-구역 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 화학 계열 | 악티늄족 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전자 배열 | [Rn] 5f6 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 준위별 전자 수 | 2, 8, 18, 32, 24, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 물리적 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 겉보기 | 은백색 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 상태 (STP) | 고체 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 녹는점 | 912.5 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 끓는점 | 3501 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 밀도 (상온 근처) | 19.816 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 융해열 | 2.82 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 기화열 | 333.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 몰열용량 | 35.5 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 증기 압력 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 산화 상태 | 6, 5, 4, 3 (양쪽성 산화물) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 음성도 (폴링 척도) | 1.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 이온화 에너지 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 원자 반지름 | 175 pm (실험값) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 그 밖의 성질 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 결정 구조 | 단순 단사정계 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열팽창 | 46.7 µm/(m·K) (25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 열전도율 | 6.74 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전기 저항도 | 1.460 Ω·m (0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 영률 | 96 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 전단 탄성 계수 | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 푸아송 비 | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS 번호 | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
플루토늄(←영어: Plutonium 플루토니엄[*], 문화어: 플루토니움←독일어: Plutonium 플루토니움[*])은 희귀한 초우라늄 방사성 동위원소로 원자번호 94, 기호는 Pu(←라틴어: Plutonium 플루토니움[*])이다. 원자로내서 우라늄 농축연료를 분열시키거나 238U에 중성자를 조사하여 플루토늄을 만들며, 반감기는 24,000년이다. 특히 239Pu은 고속증식로의 연료로 사용되며, 또한 원자폭탄 제조에 사용된다. 동위원소인 238Pu는 원자력 전지에 사용된다. 플루토늄은 독성이 강해 취급에 상당한 주의를 요한다. 최근에는 원자로 내에서 스스로 증식하는 특성을 이용하여 플루토늄을 주 연료로 하는 고속증식로를 전략원자로로 개발하고 있다.
개요
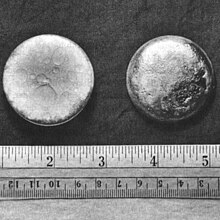
[편집]천연 우라늄 광석 중에 포함되어 있다는 것이 알려지기 전까지는 인공으로 만들어진 원소로만 여겨지고 있었다. 초우라늄 원소로, 방사성 원소이기도 하다. 239Pu, 241Pu 그 외 몇개의 동위원소가 존재하고 있다. 반감기는 239Pu의 경우 약 2만 4000년(알파 붕괴). 비중은 19.8로 몹시 무거운 금속이며, 금속 상태의 플루토늄은 니켈을 닮은 은백색의 광택을 갖고 있다. 녹는 점은 639.5 °C, 끓는 점은 3,230 °C이다.(끓는 점은 실험에 따라 다른 값으로 나타나기도 한다.)
질산이나 진한 황산에는 부동태화(부식 생성물이 피복이 되어 내부는 부식을 억제시키는 것) 되어 녹지 않으나, 염산이나 묽은 황산 등에는 녹는다. 원자가는 3가 ~ 6가가 있으며 그 중 4가가 가장 안정되어 있다. 금속 플루토늄은 발화성이 강해 분말상태에서는 그대로 자연발화하고, 덩어리 상태에서도 습기를 포함한 대기 중에서는 자연발화하기 때문에 다루는 데 어려움이 있으며, 과거에 일어난 플루토늄 사고의 대부분이 자연발화로 일어난 것들이다. 플루토늄과 그 화합물은 알파선을 방출하기 때문에 체내, 특히 폐에 축적되면 강한 발암성을 나타내므로 매우 유해하다.
원자로에서는 238U 이 중성자를 포획해 239U 가 되고, 그것이 베타 붕괴해 239Np가 되고, 239Np가 다시 베타 붕괴해 239Pu가 생긴다.(원자로 내에서는 다른 플루토늄 동위원소도 다수 생성될 수 있다.) 천연 우라늄의 대부분이 238U이고 천연 우라늄 내에서도 239Np와 239Pu이 위의 과정을 통해 생성되므로 플루토늄은 천연 상태에서도 극미량 존재한다. 또 동위원소 중에서는 가장 긴 약 8000 만 년의 반감기를 가진 244Pu도 극미량이지만 천연에 존재한다.
플루토늄은 핵무기의 원료나, 플루서멀(Plu-thermal) 발전에 있어서의 MOX 연료로서 주로 사용되고, 인공위성의 전원인 원자력 전지로서 사용된 적도 있다.
특성
[편집]플루토늄은 금속 상태에서는 은빛이지만, 산화된 상태에서는 황갈색이 된다. 금속 플루토늄은 온도가 오르면 수축한다. 또, 저대칭성 구조를 가지므로, 시간 경과와 함께 점차 약해진다.
알파 입자의 방출에 의한 열 때문에, 일정 이상량의 플루토늄은 체온보다 따뜻하며, 그 이상에서는 물을 끓일 수도 있다.
이용
[편집]
239Pu는 핵분열의 일어나기 쉽고 합성이 용이하기 때문에, 현대 핵무기의 주요한 원료가 되는 핵분열성 물질이다. 반사체가 없는 구상 플루토늄의 임계량은 16 kg이지만, 중성자를 반사하는 탬퍼를 이용하면 10 kg(직경 10 cm의 구에 상당)까지 줄일 수 있다. 1 kg의 플루토늄이 완전하게 반응했다고 하면, 20 킬로톤의 TNT에 해당하는 폭발 에너지를 낳을 수 있다. 239Pu 가 알파 붕괴하게 되면 핵분열이 잘 일어나는 235U로 변하게 되는데, 239Pu는 그런 235U보다 핵분열을 일으키기 쉽다.
동위체 238Pu는 반감기 87년의 알파 방사능 물질이기 때문에 인간의 수명 정도 기간 동안 직접 보수하는 일 없이 동작할 필요가 있는 기기의 전력원에 적절하다. 그 때문에 238Pu는 갈릴레오 호나 카시니-하위헌스 호의 전원이 되는 원자력 전지에 이용되었다. 또 같은 기술로 아폴로 달표면 탐사 계획의 지진 실험에도 이용되고 있다.
238Pu는 인공심장의 전원에도 이용되어 수술을 반복하는 위험을 피하는 데 도움이 되고 있다. 요즘에는 대부분 일차 전지인 요오드화 리튬을 이용하고 있지만, 2003년에 50에서 100개 정도의 플루토늄 전원을 사용한 인공심장이 이식되었다.
위험성
[편집]239Pu의 독성은 239Pu이 방출하는 알파선의 성질과 체내에 들어간 239Pu이 체류하는 시간의 길이에 기인한다. 다른 초우라늄원소와 마찬가지로 원자력 발전에 따른 239Pu의 발생 · 이용량이 증대함에 따라서 이 원소의 독성문제가 심각해졌다. 주로 문제가 되는 것은 발암(發癌) 효과이며, 1μg(방사능은 약 0.06μCi. Ci는 방사능의 단위이며, 1Ci=3.7×1010Bq) 이하의 239Pu를 투여한 쥐 · 비글견(犬)의 폐 · 뼈 · 피부 등에서 암이 발생하는 경우가 실험적으로 확인되었다.
인체에 불용성 입지(산화플루토늄)가 흡입되면 주로 폐에, 가용성 플루토늄을 섭취하면 뼈와 간(肝)에 모여, 각 장기의 암의 원인이 된다. 239Pu에 대한 허용농도는 공기중 6×10−13μCi/cm3 (=2.2×10−8Bq/cm3), 수중 5×10−6μCi/cm3 (=0.2 Bq/cm3)이며, 일반인의 폐의 최대허용 부하량(負荷量 ; 체내에 받아들일 수 있는 허용량)은 1.6nCi(2.6×10−8g)로 작다.
고순도(高純度) 239Pu은 5~10kg으로 원자폭탄이 될 수 있고, 또 수소폭탄의 기폭제가 된다. 인도가 1974년에 평화목적인 원자시설을 이용하여 239Pu을 제조·추출해 핵폭발을 성공시킨 이후, 239Pu을 에너지로 이용할 것인가 하는 문제를 둘러싸고 열띤 논쟁이 벌어지고 있다.
플루토늄의 치사량은 1140mg이며, 이는 치사량이 700mg인 청산가리와 같이 보다 일반적인 독성물질에 비해 화학적 독성이 낮다.[1]
각주
[편집]- ↑ 플루토늄과 기타 고도 독성물질과의 비교(치사량) Archived 2011년 9월 17일 - 웨이백 머신, 원자력 지식 정보 관문국.