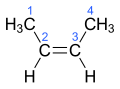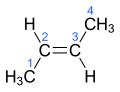Cheminė formulė
| |
Šiam straipsniui ar jo daliai trūksta išnašų į patikimus šaltinius. Jūs galite padėti Vikipedijai pridėdami tinkamas išnašas su šaltiniais. |
Cheminė formulė – formulė, kurioje cheminių elementų simboliais pateikiama informacija apie cheminę junginių sudėtį ir sandarą. Molekulę galima aprašyti empirine, molekuline ir struktūrine formulėmis, kurios pateikia kiek skirtingą informaciją. Pavyzdžiui, heksano empirinė formulė yra C3H7, molekulinė formulė – C6H14 ir struktūrinė formulė – CH3CH2CH2CH2CH2CH3, rodanti, kad heksanas yra linijinės struktūros.

Kai kurių funkciškai skirtingų junginių molekulinės formulės gali sutapti. Tą pačią molekulinę formulę C2H6O turi dimetileteris CH3-O-CH3 ir etanolis CH3CH2-OH. Šios dvi medžiagos vadinamos funkciniais izomerais.
Kitų molekulių sutampa ne tik empirinės, molekulinės, bet, atrodo, ir struktūrinės formulės, tačiau cheminis junginys skiriasi taip, kaip žmogaus kairė ranka skiriasi nuo dešinės. Šios molekulės, vadinamos enantiomerais, skiriasi savo biocheminėmis savybėmis. Žmogaus organizme metabolizuojamos tik L aminorūgštys, o D enantiomeras randamas bakterijų ląstelių sienelėse. Cheminės sintezės metu gaunamas racematas (abiejų enantiomerų po 50 %), o fermentinės sintezės metu selektyviai sintetinamas tik vienas iš jų. Vaistų atveju tik vienas enantiomeras pasižymi reikiamomis savybėmis.
Empirinė formulė
[redaguoti | redaguoti vikitekstą]Empirinė formulė – tai pati paprasčiausia junginio formulė, kuri pateikia informaciją apie kiekvieno elemento atomų santykį molekulėje. Atomų skaičių rodo cheminio simbolio dešinėje, apačioje parašyti skaičiai (O2 – du deguonies atomai). Jeigu jokio skaičiaus nėra, tai reiškia, jog jis lygus vienetui (H2O – du vandenilio atomai ir vienas deguonies atomas sudaro vandens molekulę). Ši formulė nedaug pasako apie cheminę medžiagą, pvz.: CH2O empirinė formulė tinka tiek acto rūgščiai, tiek gliukozei, tiek metanaliui.
Molekulinė formulė
[redaguoti | redaguoti vikitekstą]Molekulinė formulė pateikia informaciją apie iš tikro egzistuojančios molekulės atominę sudėtį, t. y. parodo, kiek ir kokių atomų sudaro molekulę, bet neteikia informacijos apie atomus jungiančius cheminius ryšius. Metanalio molekulinė formulė sutampa su jo empirine formule CH2O, acto rūgšties molekulinė formulė yra dviguba empirinė formulė C2H4O2, o gliukozės šešiakartinė empirinė formulė C6H12O6.
Struktūrinė formulė
[redaguoti | redaguoti vikitekstą]
Struktūrinėje formulėje pavaizduota, kokia tvarka ir kokio tipo ryšiais molekulėje esantys atomai yra išsidėstę vieni kitų atžvilgiu (molekulė nėra plokščia struktūra). Viengubais brūkšneliais (-) vaizduojamos viengubos kovalentinės jungtys, dvigubais (=) – dvigubos, o trigubais – trigubos kovalentinės jungtys.
Sutrumpinta struktūrinė 2-buteno formulė yra CH3CH=CHCH3, tačiau ji neteikia informacijos apie metilo grupę (CH3), kuri molekulėje gali būti arba cis (kitaip Z; vok. zusammen), arba trans (kitaip E; vok. entgegen) padėtyje. Pilna struktūrinė formulė parodo apie kurį 2-buteno (cis-2-butenas ar trans-2-butenas) erdvinį izomerą kalbama.
-
cis-2-butenas
-
trans-2-butenas
Kitos formulės
[redaguoti | redaguoti vikitekstą]- Aprašant nežinomo ilgio polimerus, naudojamas indeksas n (gali būti m, x, y ir pan.): nežinomo ilgio polipeptidas H(-NH-CH(R)-C(O)O-)nH. Jei žinoma, kad, tarkime, 50 aminorūgščių sudaro polipeptidą, tai jo formulė bus H(-NH-CH(R)-C(O)O-)50-H
- Aprašant jonus, cheminio simbolio dešinėje viršuje nurodomas jų krūvis, pavyzdžiui, K+, Cl-, H3O+ ar NO3-.
- Izotopai – to paties elemento atomai, turintys tą patį atominį skaičių, bet skirtingą masės skaičių – vienas nuo kito atskiriami, nurodant masės skaičių kairėje, viršuje elemento simbolio atžvilgiu: 18O, 16O.
Naudota literatūra
[redaguoti | redaguoti vikitekstą]- R. H. Petrucci, W. S. Harwood. 2000 m. Bendroji chemija. 1 dalis. „Tvermė“. 65-68 p.
- Iš anglų kalbos vertė Rimantas Vaitkus. Iliustruotas chemijos žinynas. 1998 m, Kaunas, „Šviesa“ 26p.