Amonjaks
| Amonjaks | |
|---|---|
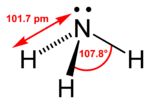  Amonjaka struktūrformula un molekulas modelis | |
| Ķīmiskā formula | NH3 |
| Molmasa | 17,027 g/mol |
| Blīvums | normālos apstākļos 0,7625[1] kg/m3 |
| Kušanas temperatūra | 195,42 K (-78,27 °C) |
| Viršanas temperatūra | 240,74 K (-33,49 °C) |
| Šķīdība ūdenī | 89,9 g/100ml (pie 0 °C) |
Amonjaks ir slāpekļa un ūdeņraža ķīmiskais savienojums, kura ķīmiskā formula ir NH3. Normālos apstākļos tā ir bezkrāsaina, salīdzinoši viegli sašķidrināma gāze ar asu smaku. Amonjaks ir indīgs, saindēšanās ar to ir atkarīga no tvaika koncentrācijas un saskares ilguma.[2] Amonjaks ir amfotēriska viela. Ūdenī tā ir kā bāze. Tas veido arī dažādus amonija sāļus. Amonjaks ļoti labi šķīst ūdenī — pie 0 °C 1 tilpumā ūdens izšķīst ap 1200 tilpumu amonjaka (pie 20 °C attiecīgi 700 tilpumu). Šķīdumā tas veido amonija jonu NH4+ un šo šķīdumu var uzskatīt par amonija hidroksīdu. 10% šķīdumu lieto medicīnā kā kairinošu līdzekli un sauc par ožamo spirtu. Viena no lielākajām amonjaka uzglabāšanas stacijām atrodas Ventspilī, Latvijā.[3]
Iegūšana
[labot šo sadaļu | labot pirmkodu]Amonjaku iegūst tiešā reakcijā starp slāpekli un ūdeņradi. Amonjaks ir galvenā visu slāpekļa savienojumu rūpnieciskā izejviela.
Īpašības
[labot šo sadaļu | labot pirmkodu]Reaģējot ar skābēm un skābajiem oksīdiem, amonjaks veido amonija sāļus. Nozīmīgākie amonija sāļi ir amonija sulfāts ((NH4)2SO4) un amonija nitrāts (NH4NO3), kurus lieto kā minerālmēslus (slāpekļa mēslojums).
Katalītiski oksidējot amonjaku, iegūst slāpekļskābi.
Amonjaks nedeg, taču, degot tīrā skābeklī, veidojas slāpeklis un ūdens:
- 4NH3 + 3O2 → 2N2 + 6H2O
Amonjaks reaģē arī ar daudziem organiskajiem savienojumiem, veidojot slāpekļorganiskos savienojumus (ar halogēnogļūdeņražiem veido amīnus, ar halogēnkarbonskābēm veido aminoskābes, ar formaldehīdu veido urotropīnu (heksametilēntetramīnu)).
Izmantošana
[labot šo sadaļu | labot pirmkodu]Galvenokārt lieto slāpekļa minerālmēslojuma ražošanai, sprāgstvielu, polimēru, slāpekļskābes, sodas un citu ķīmiskās rūpniecības produktu iegūšanai.
Šķidru amonjaku analītiskajā ķīmijā dažreiz lieto par neūdens polāru šķīdinātāju. Tajā šķīst sārmu metāli. Šķidru amonjaku plaši izmanto saldēšanas iekārtās (ar to aizstāj videi kaitīgos freonus).
Atsauces
[labot šo sadaļu | labot pirmkodu]- ↑ «Ammonia - Density at Varying Temperature and Pressure» (angļu). Engineering ToolBox. Arhivēts no oriģināla, laiks: 2019. gada 5. Jūnijs. Skatīts: 2019. gada 6. augustā.
- ↑ «Saindešanās». medicine.lv. Arhivēts no oriģināla, laiks: 2019. gada 6. Augustsss. Skatīts: 2019. gada 6. augustā.
- ↑ «Ventamonjaks». www.ventamonjaks.lv. Skatīts: 2021-10-20.
Ārējās saites
[labot šo sadaļu | labot pirmkodu] Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Amonjaks.
Vikikrātuvē par šo tēmu ir pieejami multivides faili. Skatīt: Amonjaks.
| Šis ar ķīmiju saistītais raksts ir nepilnīgs. Jūs varat dot savu ieguldījumu Vikipēdijā, papildinot to. |
|
